人粒细胞巨噬细胞集落刺激因子 DNA疫苗预防NOD小鼠的机制探讨
2019-04-25喻日成罗建华杨冬花范元硕吕利撒于瑞萍
喻日成,罗建华△,杨冬花,范元硕,刘 波,吕利撒,于瑞萍
(贵州省人民医院:1.分泌科;2.干医科,贵阳 550002)
1型糖尿病(T1DM)为胰岛β细胞特异性自身免疫性疾病,其因为自身免疫耐受障碍,T细胞介导自身免疫反应致β细胞破坏而发生。非肥胖糖尿病(non-obese diabetic,NOD)小鼠是一种遗传性自身免疫性糖尿病动物模型[1]。NOD鼠免疫耐受障碍是因为未成熟树突状细胞(iDC)和CD4+CD25+调节性T细胞(Treg)的数量及功能缺陷所致。这些缺陷引起iDC免疫耐受效率降低,触发持续的T细胞反应而致病[2]。
人粒细胞巨噬细胞集落刺激因子(GM-CSF)在DC功能调节上具有重要作用[3-4],因此在体内外通过使用GM-CSF增加和维持较高的抗iDC数量,促使产生外周免疫耐受,将成为一种有价值的预防自身免疫糖尿病策略。人GAD65(hGAD65)DNA疫苗成功延缓和降低了NOD鼠发生糖尿病[5],但其预防效率仍不够理想。迄今有关人GM-CSF DNA疫苗防治T1DM尚未见报道。我们拟用GM-CSF DNA疫苗预防NOD小鼠胰岛炎和T1MD,为GM-CSF基因疫苗用于防治T1DM提供实验依据。
1 材料和方法
1.1实验动物 4周龄NOD雌鼠[实验动物质量合格证No.006941,许可证号SCXH(沪)2007-0005]购自中国科学院上海实验动物中心。在无特定病原体(SPF)环境下饲养,自由饮水及进食营养颗粒饲料。NOD鼠群糖尿病自然发病率30周龄时约75%。
1.2主要试剂与仪器 人GM-CSF基因表达质粒(即GM-CSF DNA疫苗,载体为pcDNA3.1)由本项目组构建;质粒提取试剂盒(HiSpeed Plasmid Midi Kit)购自德国Qiagen公司;GM-CSF购自美国Sigma公司;Hanks液和RPMI-1640培养基购自美国HyClone公司;小鼠IL-4、IFN-γ,IL-10和IL-1β酶联免疫吸附试验(ELISA)检测试剂盒购自美国R&D公司。摇床及各种型号高速冷冻离心机为美国Beckman公司。
1.3方法
1.3.1GM-CSF质粒的提取与质粒DNA的纯化浓缩 从含酵母、选择性抗菌药物的LB培养基划痕平板中挑单个克隆。37 ℃摇床(220 r/min)培养8 h。以选择性LB培养基扩增质粒;37 ℃培养至细胞密度约3×109/mL~4×109/mL。按试剂盒操作步骤抽提质粒,测定质粒光密度(OD)值及浓度;在超净台去除乙醇,加无菌PBS溶解,浓度调至1 μg/μL。-20 ℃保存备用。
1.3.2实验动物分组、免疫及发病率观察 4周龄NOD雌鼠分为磷酸盐缓冲液(PBS)组、质粒载体PcDNA3.1组(PcDNA组)和GM-CS DNA疫苗组(GM组)3组,每组15只。以戊巴比妥钠65 mg/kg麻醉NOD雌鼠,剃除小鼠胫前毛后,肌肉注射25%蔗糖100 μL,15 min后于同一部位注射PBS或溶于PBS缓冲液(pH=7.4)中的质粒PcDNA3.1或人GM-CSF DNA疫苗,注射量为100 μg,1周重复1次,共200 μg,饲喂普通营养饲料。10周龄开始,测尿糖1次/周。出现尿糖阳性或有多饮、多尿等症状时,测血糖,连续2次血糖大于或等于16.7 mmol/L,则诊断为糖尿病。观察至糖尿病发生或30周龄时处死。
1.3.3胰岛病理学检查 取10~12周龄小鼠,剪尾取血测血糖,颈椎脱臼法处死,PBS、PcDNA、GM 3组均为6只。分离胰腺,布恩氏液固定24 h,制作常规石蜡切片。切片间相隔30 μm,苏木素-伊红(HE)染色,光镜下观察胰岛炎,由2位实验者采用盲法阅片。胰岛淋巴细胞浸润记分标准:胰岛周围和胰岛内无淋巴细胞浸润记0分;胰岛周围有淋巴细胞浸润但未侵入胰岛记1分;胰岛内淋巴细胞浸润小于25%记2分;胰岛内淋巴细胞浸润25%~75%记3分,胰岛内淋巴细胞浸润大于75%记4分[6]。每个胰腺观察3~4张不同的切片中15~30个胰岛,以胰岛平均积分表示胰岛炎的程度。
1.3.4NOD鼠脾细胞的分离和培养 取1.3.3小鼠脾脏剪成2~3段捻碎,用冷Hanks液悬浮细胞,细胞悬液离心(1 000 r/min)5 min,去上清液后加入6 mL的Tri-NH4Cl,混匀后室温下放置5 min,1 000 r/min离心5 min,去上清液,以Hanks 液洗涤细胞3次(1 000 r/min离心5 min)。RPMI-1640培养液4~5 mL悬浮细胞,调整细胞浓度至2.5×106/mL。取750 μL细胞悬液至6孔板,在37 ℃、5% CO2、饱和湿度条件下培养。培养72 h后,1 000 r/min离心5 min,留存上清液,收集脾细胞,均-20 ℃保存待检测。(2)将未处理未发生糖尿病的10~12周龄NOD雌鼠(n=5)脾细胞制备悬液(方法同前述),分别加RPMI-1640培养液(对照)、GM-CSF pcDNA3.1及pcDNA3.1-GM-CSF质粒处理脾细胞备用(每孔质粒终浓度为2 ng/mL)培育72 h,分离上清液存-20 ℃备检。
1.3.5细胞因子水平检测 用酶联免疫吸附试验(ELISA)检测血清及脾细胞培养上清液中干扰素-γ(IFN-γ)、白细胞介素-1β(IL-1β),IL-4及IL-10水平,实验操作按试剂盒说明书进行检测。

2 结 果
2.1人GM-CSF DNA疫苗对NOD雌鼠糖尿病发病率及发病时间的影响
2.1.1各组NOD鼠30周糖尿病累计发病率 PBS、PcDNA和GM 3组30周龄糖尿病累计发病率分别为80.0%、73.3%和46.7%。GM组与PBS组、PcDNA组比较,发病率分别下降了33.3%和26.6%,但差异无统计学意义(P=0.128和P=0.264)。
2.1.2各组NOD鼠30周发病时间 PBS、PcDNA及GM 3组30周龄时平均发病时间分别为(143.9±46.1)、(156.9±40.0)、(188.3±30.0)d;GM组与PBS组、PcDNA组比较,发病时间显著延迟(P=0.004和P=0.034)。
2.2人GM-CSF DNA疫苗对12周龄NOD雌鼠胰岛炎的影响 PBS、PcDNA和GM 3组NOD鼠10~12周龄时胰岛炎平均积分分别为(2.82±0.39)、(2.12±0.59)、(1.30±0.70)分。与PBS 和PcDNA组比较,GM组胰岛炎平均积分显著降低(P=0.001、0.026),病理学检查见图1。12周龄各组NOD雌鼠胰岛炎构成比见表1。
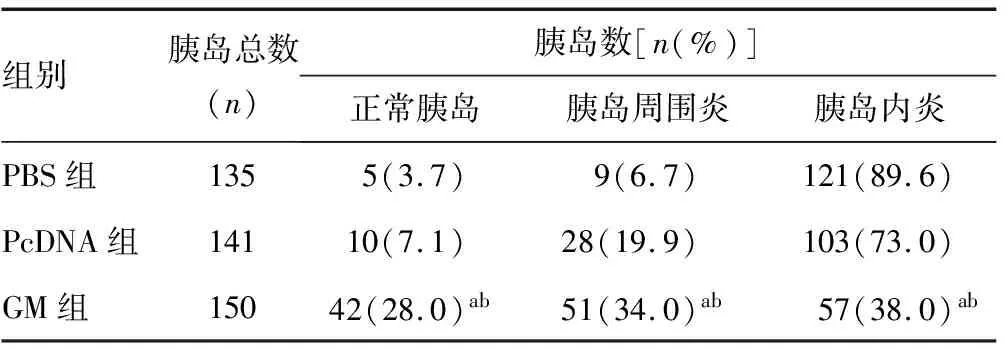
表1 10~12周龄时NOD雌鼠胰岛炎构成比
a:P<0.05,与PBS组比较;b:P<0.05,与PcDNA组比较

A:PBS组;B:PcDNA组;C:GM-CSF组
图1 12周龄NOD鼠胰岛炎(HE染色×200)

表2 各组血清细胞因子水平
a:P<0.05,与PBS组比较;b:P<0.05,与PcDNA组比较

表3 各组脾细胞原代培养上清液细胞因子水平
a:P<0.05,与PBS组比较;b:P<0.05,与PcDNA组比较
2.3血清IL-1β、IL-4、IL-10和IFN-γ的水平 GM组血清及上清液IL-10水平显著高于PBS组和PcDNA组,IL-4水平显著性高于PBS组;而IFN-γ、IL-1β水平则低于PBS组和PcDNA组。见表2、3。
2.4未处理的10~12周龄未发病NOD雌鼠脾细胞GM-CSF刺激后上清液细胞因子水平 未处理的10~12周龄未发病NOD雌鼠脾细胞GM-CSF DNA疫苗刺激后上清液IL-1β、IL-4、IL-10和IFN-γ的水平较刺激前差异均有统计学意义(P<0.05),见表4。

表4 未处理的10~12周龄未发病NOD雌鼠脾细胞GM-CSF刺激后上清液细胞因子水平
a:P<0.05,与对照组比较
3 讨 论
用人GM-CSF DNA疫苗免疫NOD雌鼠,发现12周龄时GM组胰岛炎积分较PBS、PcDNA组显著性降低;GM组正常胰岛比例较PBS、PcDNA组高,胰岛周围炎及胰岛内炎比例则较PBS、PcDNA组降低。提示人GM-CSF DNA疫苗可减轻NOD雌鼠胰岛炎,一定程度预防和延缓NOD鼠糖尿病的发生。
T1DM为T细胞介导破坏β细胞的一种自身免疫疾病。CD4+T细胞在T1DM患者和NOD鼠β细胞破坏中扮演着重要角色[7]。DC是浸润胰岛的主要抗原递呈细胞(APC)。病理性T细胞俘获APC上的β细胞抗原[正常情况靶细胞不表达组织相溶性复合物(MHC)Ⅱ类分子]。活化的T细胞识别APC上的β细胞抗原,并产生自我抗原反应[8]。大量研究发现DC细胞是首先浸润胰岛的炎症细胞,提示DC细胞在人类T1DM和NOD鼠糖尿病的发生发展中起着至关重要的作用[9]。DC细胞通过β细胞抗原递呈而启动和促进自身免疫。GM-CSF DNA疫苗减轻NOD鼠胰岛炎,减少NOD鼠糖尿病的发生说明GM-CSF能通过某种途径减轻病理性T细胞对胰岛的浸润破坏而保护β细胞,阻止NOD鼠发生糖尿病。
DC细胞对维持自身抗原的外周耐受有着重要作用。正常条件下,未成熟和未活化的DC细胞可诱导Treg细胞活化[10],通过与DC细胞的直接作用来维持人类和鼠正常的Treg细胞功能[11];T1DM患者和糖尿病动物模型中DC细胞和Treg细胞功能异常,异常DC细胞和Treg细胞促使T1DM的发生。已有报道显示,人类T1DM和NOD鼠DC 细胞功能异常,T1DM中DC细胞的正常功能减弱。NOD鼠中DC细胞不能有效活化Treg细胞,其部分原因可能与成熟障碍有关,从而病理性T细胞致β细胞免疫破坏[12]。因此,恢复DC细胞的免疫耐受和Treg细胞功能,抑制针对β细胞抗原的自身免疫反应,保护β细胞是治疗的途径。
近来研究显示,GM-CSF在免疫介导的自身免疫模型中能调节DC细胞功能,诱导T细胞免疫耐受[13]。其可能通过产生Treg细胞来诱导成熟-抵抗耐受的CD8a-DC细胞和抑制自身免疫反应。GM-CSF处理早期胰岛炎NOD鼠,明显增加DC细胞和CD4+CD25+Treg细胞,而显著延缓糖尿病的发生,其通过CD4+CD25+Treg细胞分泌IL-10和TGF1β发生保护作用[14]。
血清及原代脾细胞培养上清液中GM组IL-10显著高于PBS、PcDNA组,而IL-1β和IFN-γ低于PBS、PcDNA组;GM-CSF刺激的脾细胞上清液中IL-10高于刺激前,IL-1β和IFN-γ低于刺激前。这说明GM-CSF能上调NOD鼠IL-10,下调IL-1β和IFN-γ,这些作用是通过脾细胞产生的。
GM-CSF是DC细胞的生长因子,深刻影响DC细胞的扩增、成熟和不同亚群功能[15]。GM-CSF通过分泌IL-10的CD4+CD25+Treg细胞抑制实验性自身免疫甲状腺炎模型(EAT)和实验性自身免疫性肌炎模型(EAG)的进展[16]。DC细胞能产生低浓度前炎症细胞因子,不论细胞表面活性标志物水平,均可促使T细胞耐受[17]。前炎症细胞因子通过抑制Treg细胞扩增和发展打破免疫耐受,如肿瘤坏死因子-α(TNF-α)下调Treg细胞的数量和功能[18],IL-1β则直接增加效应T细胞破坏NOD鼠免疫耐受[19]。GM-CSF增加IL-Ra而影响DC的成熟,IL-Ra是外周单核细胞产生的IL-1β抑制剂,能活化DC细胞成熟的关键调节因子核因子-κB(NF-κB)[20]。GM-CSF通过下调细胞因子IL-1β和IL-12水平阻止NOD鼠发生糖尿病,这些保护作用可能是通过诱导DC细胞耐受及增进Treg细胞功能实现[14]。
实验显示人GM-CSF DNA疫苗可在小鼠体内较长时间表达。从实验结果推测,GM-CSF DNA疫苗预防和延缓糖尿病及减轻胰岛炎的机制可能为:GM-CSF DNA疫苗可在NOD鼠体内转录表达GM-CSF,上调了IL-10和IL-4等Th2细胞因子水平,下调IFN-γ和IL-1β等Th1细胞因子水平,减轻NOD鼠胰岛炎,预防和延缓NOD鼠发生糖尿病。GM-CSF DNA疫苗调节Th细胞因子尚有多个环节不清楚,如GM-CSF是如何与DC细胞发生联系的?之后是怎样诱导产生分泌IL-10的CD4+CD25+Treg细胞等?这些均需要更深入的研究和探索,以期能揭示T1DM发病机制和寻找T1DM防治方法。
