胃复合性淋巴瘤1例及文献复习
2019-04-25周泽平
刘 琳,周泽平
(昆明医科大学第二附属医院血液科,昆明 650101)
复合性淋巴瘤(CL)是指两种及以上形态学或免疫表型不同的淋巴瘤同时发生于同一解剖部位或瘤块内[1]。CL少见,而发生于胃肠道的经典型霍奇金淋巴瘤(HL)复合弥漫大B细胞淋巴瘤(DLBCL)的发生率更低,相关报道及研究较少。笔者报道本院收治的1例胃部CL患者,为胃部发生同时具有经典型HL及DLBCL的病理组织学和免疫表型特征的CL,并对于CL的临床、病理、免疫组织化学特性和临床预后进行文献复习。
1 临床资料
患者,女,39岁,农民。2014年6月无明显诱因出现上腹隐痛,无反酸嗳气、呕血黑便,无发热、盗汗、消瘦,在本院外科就诊,行胃镜检查后示:胃溃疡,予以质子泵抑制剂抑酸,保护胃黏膜等治疗后症状无好转,复查胃镜仍可见巨大溃疡,于9月20日在全身麻醉下行毕Ⅱ式胃大部切除术,术后病理检查示DLBCL和经典型HL结节硬化型。转入本科室进一步诊治。查体:一般可,皮肤未见出血点、皮疹,浅表淋巴结不大,心肺未见明显异常;血常规正常;便常规+潜血未见异常;肝、肾功能正常。血清乳酸脱氢酶(LDH)正常;浅表淋巴结超声未见肿大淋巴结;胸腹部CT未见异常。病理送华西医院会诊示:胃黏膜上皮下见形态较一致的中心母细胞样细胞成片排列,免疫组织化学染色呈CD20+,CD30ε+,部分CD30+,CD10-,MUM-1+,Bcl-6+,Ki67阳性率为80%~90%,诊断为DLBCL,并提示为非生发中心B细胞来源的肿瘤,PCR检测倾向存在Igκ基因重排,未检测出IgH基因重排。胃右网膜旁淋巴结滤泡间区增生,在混合细胞浸润的背景上见到一些大的异性细胞,多数为单核型,可见双核型及少数异形巨细胞散在分布,免疫组织化学染色呈CD20-,CD30ε-,CD30+,CD15-,MUM-1+,Bcl-6-,CD45-,EBV-,PCR未检测出Igκ、IgH基因重排,病理诊断考虑HL(经典型HL、混合细胞型)。综合胃及胃右网膜旁淋巴结形态学及免疫组织化学染色结果,诊断为CL,病理见图1。完善分期检查未发现胃以外的浸润,Lugano分期Ⅱ期。于2014年11月3日开始每21天予R-CHOP方案化疗6次,具体方案为:利妥昔单抗600 mg,第1天;环磷酰胺1.1 g,第1天;多柔比星60 mg,第1天;长春新碱2 mg,第1天;波尼松100 mg,第1~5天。2周期、4周期、6周期的疗效评价均为完全缓解。末次化疗时间为2015年3月。定期复查随访至今仍无病生存。
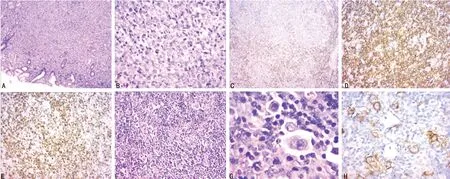
A:DLBCL(HE,×50);B:DLBCL(HE,×200);C:DLBCL(CD30+,×50);D:DLBCL(CD20+,×200);E:DLBCL Ki67(×100);F:经典型HL(HE,×100);G:经典型HL(HE,×400);H:经典型HL(CD30+,×200);
图1 患者手术切除的胃黏膜和胃右网膜旁淋巴结病理图
2 讨 论
CL定义为两种或两种以上不同类型的淋巴瘤同时存在于同一解剖部位的组织或器官中。这一名词是1954年CUSTER首先提出,后由KIM定义的。可以是HL合并非HL,或两种非HL复合,经典型HL与结节性淋巴细胞为主型HL同时存在也有报道[1]。1个惰性淋巴瘤发展成为侵袭性淋巴瘤不能称为CL,而是淋巴瘤的转化,例如慢性淋巴细胞白血病或者滤泡性淋巴瘤进展为DLBCL[2]。严格地说,同一患者在不同时间发生不同类型的淋巴瘤也不能称为CL。CL临床罕见,既往有报道其发病率占所有淋巴瘤的1.0%~4.7%,但近年的回顾研究表明,包括同时发生和相继发生的CL,真正的CL很少见,其发病率至今没有确切的统计数字[3]。
2.1病理和诊断 CL的诊断主要依靠组织活检。对于淋巴结活组织进行形态学、免疫组织化学和分子生物学检测。形态学标准包括肿瘤细胞和背景细胞的细胞学特征及淋巴瘤的生长方式。形态学不同的两种及两种以上的淋巴瘤发生于同一器官或解剖部位诊断为CL。CL包括:(1)HL和非HL;(2)非HL和非HL;(3)经典型HL和结节性淋巴细胞为主型HL。本文报道的是胃肠道DLBCL和经典型HL。胃肠道是DLBCL最常见的结外发病部位。但HL很少侵犯胃肠道,在胃肠道淋巴瘤中的发病率低于5%[4]。DLBCL是最常见的侵袭性B细胞淋巴瘤,瘤细胞表达CD20、CD19、CD79a、PAX5,可有Igκ或λ轻链限制[4]。经典型HL有特征性的霍奇金里斯(HRS)细胞,典型的免疫标记为CD30、CD15,MUM1、PAX5弱表达[5]。本例患者胃黏膜上皮病理检查形态学可见中心母细胞样细胞成片排列,免疫组织化学染色呈CD20+,CD30ε+,部分CD30+,CD10-,MUM-1+,Bcl-6+,Ki67阳性率为80%~90%,可以诊断为DLBCL。胃右网膜旁淋巴结滤泡间区增生,在混合细胞浸润的背景上见到一些大的异性细胞,多数为单核型,可见双核型及少数异形巨细胞散在分布,免疫组织化学染色呈CD20-,CD30ε-,CD30+,CD15-,MUM-1+,Bcl-6-,CD45-,EBV-,考虑诊断为经典型HL混合细胞型。两种不同病理类型的淋巴瘤同时发生于同一解剖部位,符合CL的诊断。GOYAL等[6]复习了21例DLBCL和HL的CL,其中仅有3例结外淋巴瘤,1例为前纵隔淋巴结DLBCL和肺实质的HL,1例为胃体、胃周淋巴结DLBCL和幽门、幽门前淋巴结HL,1例为结肠DLBCL和肠系膜淋巴结HL。而发生于淋巴结内的CL多存在于同一解剖部位的不同淋巴结或同一淋巴结内。
2.2发病机制 一般认为,基因易感性、慢性病毒感染、免疫紊乱与淋巴瘤的发病有关。最常见的CL组合为两种B细胞淋巴瘤,其中多包含1种低级别B细胞淋巴瘤,如滤泡性淋巴瘤和套细胞淋巴瘤、慢性淋巴细胞白血病和滤泡性淋巴瘤,它们共同的前体是生发中心B细胞。超过50例病例采用免疫球蛋白V基因分析或标志性的染色体易位分析、分子原位杂交等技术,发现61%的患者存在两个独立的B细胞恶性克隆,从1个共同的前体B细胞各自平行发展为不同的肿瘤[1-4,6]。B细胞淋巴瘤和HL的组合也很常见。HL虽然在组织病理上明显区别于非HL,但大部分研究证实经典型HL和非HL包括滤泡性淋巴瘤、套细胞淋巴瘤、DLBCL和慢性淋巴细胞白血病等组成的CL多是克隆相关的,起源于同一个前体B细胞[7]。在T细胞和B细胞共存的CL中,有证据表明T细胞系列肿瘤的发生与B细胞肿瘤的慢性免疫刺激有关[8]。HL和T细胞淋巴瘤的组合最为少见。通常HL的背景细胞中多为CD4阳性的T细胞,但CD8阳性T细胞来源的T细胞淋巴瘤也可同时发生HL,给诊断带来不小的挑战[9]。
淋巴瘤的发生、发展与多种细胞信号通路的异常有关。如核因子κB(NF-κB)通路的活化与DLBCL和HL的发病有确切关系[10],但在二者组成的CL中是否存在同一信号通路异常尚不清楚。抑癌基因TP53突变和FAS(CD95)突变在DLBCL的发病过程中起到很重要的作用,分别可见于20%和5%~20%的病例。但在HL中几乎没有类似的突变[11]。未来需要寻找CL中共同存在的基因突变和细胞信号通路的异常,进一步揭示疾病的演变过程。
EB病毒(EBV)感染与B细胞淋巴瘤和HL的发病有较为明确的关系。GOYAL等[6]复习了21例DLBCL和HL的CL,有31%的病例的两种淋巴瘤EBV均为阳性,提示瘤细胞可能起源于共同被EBV感染的祖细胞。而仅有1种淋巴瘤EBV阳性也不能排除其克隆相关性。
2.3治疗及预后 CL的治疗需要考虑兼顾两个不同的病理类型。但因为病例数少,没有公认的最佳治疗方案。因为恶性程度高的病理类型对患者的预后影响更大,医生多选择针对侵袭性较强的淋巴瘤的治疗方案。HL与惰性B细胞淋巴瘤同时存在,治疗主要选择针对HL的方案,同时可加用抗CD20单抗治疗惰性B细胞淋巴瘤。如HL和侵袭性B细胞淋巴瘤复合,选择针对侵袭性B细胞淋巴瘤的方案,可辅以局部放疗。如T细胞淋巴瘤和需要治疗的B细胞淋巴瘤共存,可选择对两种淋巴瘤都有效的方案加抗CD20单抗[12-13]。本例患者为复合DLBCL和HL,化疗选择治疗DLBCL的方案。本例患者确诊后给予6周期R-CHOP方案化疗,达到完全缓解,随访36个月,目前仍无病生存。
CL的预后主要取决于侵袭性较强的病理类型。但因本病罕见,其与单独的淋巴瘤的生存期、治疗反应等难以比较。现在已知EBV感染与CL的不良预后具有明显的相关性[6,14]。随着遗传学和分子生物学的发展,对于CL的预后的判断会有更进一步的认识,新药的研发和应用将进一步改善其预后。
总之,CL少见,有时诊断较为困难。克隆相关的CL是研究肿瘤多步骤转化演变过程的极佳模型。随着分子病理学技术的进步,有望揭示疾病的本质,提高对本病的认识。
