23例手术和非手术疾病所致的心源性休克患者应用体外膜肺氧合的疗效研究*
2019-04-25韩磊,吴蔚,何萍
韩 磊,吴 蔚,何 萍
(陆军军医大学西南医院:1.医教部;2.胸外科;3.心脏外科,重庆 400038)
当常规治疗无效时,静脉-动脉(VA)体外膜肺氧合(ECMO)为危及生命的心源性休克(CS)患者提供了短期的心脏辅助功能。CS多见于急性心肌梗死(AMI)、急性暴发性心肌炎、心脏术后难治性低心排血量综合征(PCS)、急性大面积肺栓塞、慢性心力衰竭急性失代偿、心脏移植术后移植心脏急性功能障碍、严重心律失常、围生期心肌病、应激性心肌病等。目前我国循环衰竭接受ECMO辅助患者中,手术所致的PCS占多数[1]。未经手术的CS患者所患病疾病包括急性暴发性心肌炎(AFM)、心肌梗死、脓毒症休克等。ECMO总撤机率和总治愈率为50%~70%[2-5]和5%~45%[6-7]。其中未经手术CS患者,例如AFM总生存率为50%~70%[8]。心脏外科手术后ECMO使用率较低,但这些患者的相关病死率偏高,据体外生命支撑组织(ELSO)统计大约只有33%的患者存活[9]。未经手术的ECMO患者与手术所致ECMO患者生存率的差异提示,ECMO转流期间的临床管理侧重点应该有所区别[10]。手术所致ECMO患者中的PCS患者,通常有较长时间的心力衰竭病史、体外循环(CPB)、手术创伤等,而大多数未经手术的ECMO患者,例如AFM和AMI常伴有致命的心律失常[11]。本研究观察本中心2017年1-12月外科手术后的CS患者和未经手术的CS患者在ECMO治疗期间相关临床指标的差异,现将研究结果报道如下。
1 资料与方法
1.1一般资料 选择2017年1-12月在本院ECMO中心接受治疗的CS患者23例。其中,11例患者未接受开胸等外科手术,纳入非手术组;12例患者接受了心脏外科手术,纳入手术组。非手术组中AFM 8例,急性冠状动脉综合征1例,脓毒症2例。手术组中风湿性心脏瓣膜置换术7例,冠状动脉旁路移植术(CABG)手术3例, 心包炎手术2例。两组患者的一般临床资料比较差异无统计学意义(P>0.05),具有可比性(表1)。所有患者的ECMO持续时间为(148.2±77.6)h,平均住院时间(34.1±8.7)d。纳入标准:CS患者在充分补充容量的基础上,仍需大剂量血管活性/正性肌力药物或主动脉球囊反博泵(IABP)辅助,并且在血流动力学不平稳和外周组织低灌注状态无明显改善时,排除禁忌证[1]。具体指针包括:持续心脏指数(CI)<1.5 L·min-1·m-2,低血压[平均动脉压(MAP)<60 mm Hg],少尿(尿量小于0.5 mL·kg-1·h-1)和使用血管活性药(IE)>40 μg·kg-1·min-1;心脏骤停和无法控制危及生命的心律失常患者接受持续的心肺复苏术。排除标准参考成人ECMO循环辅助专家共识[1]。
1.2方法
1.2.1ECMO设备和管理 ECMO由离心泵、氧合器(德国Maquet公司)、肝素涂层的插管(美国Medtronic公司)和变温水箱(美国Sarns公司)组成。插管采用17-19 Fr动脉插管和19-21 Fr静脉插管,所有患者均经股动、静脉置管,常规留置侧支保证置管侧的下肢血供。ECMO的管理和撤机根据指南进行[12]。初始流速为3.0~4.5 L/min,维持MAP>60 mm Hg。根据组织灌注和血流动力学状态调整IE的剂量。持续泵入肝素维持ACT时间160~200 s,混合静脉血氧饱和度(SvO2)>65%,血红蛋白(Hb)>100 g/mL或血细胞比容(HCT)>30%、血小板(PLT)>50 000 mL,常规采用肺保护性通气策略。根据周围循环指标(动脉血气分析、SvO2、乳酸和尿量)及心功能逐渐恢复时逐渐下调ECMO流量。

表1 两组患者临床一般资料
1.2.2观察指标 动态监测血清尿素氮(UN)、天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、血肌酐(Cr)、视黄醛结合蛋白(RBP)、部分凝血活酶时间(APTT)、PLT。动态监测ECMO置管前,ECMO转流的24~48 h,ECMO撤机后的24 h内及出院时左心室射血分数(LVEF)、左心室短轴缩短率(LVFS)。

2 结 果
2.1临床指标比较
2.1.1临床生化指标 肾功能方面,在ECMO置管前1 d至置管后2 d,两组血清UN和Cr比较差异无统计学意义(P>0.05);手术组ECMO置管后3~7 d的血清UN,以及ECMO置管后3~5 d的Cr与非手术组比较明显升高(P<0.05);两组BUN和Cr均呈先升高后下降趋势。 肝功能方面,在ECMO置管前1 d和置管当天,非手术组的血清ALT和AST水平相比手术组明显升高(P<0.05);ECMO置管后1~3 d,手术组RBP水平明显高于非手术组(P<0.05),非手术组ALT和AST水平呈下降趋势,手术组呈升高趋势,两组比较差异无统计学意义(P>0.05);ECMO置管后4~7 d两组均呈下降趋势。凝血功能方面,在ECMO置管当天至置管后2 d,手术组的PLT和APTT较非手术组明显降低(P<0.05);ECMO置管后期,两组APTT均呈先升高后下降并趋于正常趋势,而PLT水平均呈下降趋势,见表2、图1。
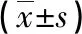
表2 两组患者临床生化指标的变化
-1 d:ECMO置管前1 d;0 d:ECMO置管当天;a:P<0.05,与手术组比较;b:P<0.05,与-1 d比较

-1 d:ECMO置管前1 d;0 d:ECMO置管当天;a:P<0.05,与手术组比较
图1 两组患者临床生化指标变化的折线图
2.1.2心功能指标 在出院时,非手术组LVEF和LVFS明显高于手术组(P<0.05)。其余时间段非手术组LVEF和LVFS比较差异无统计学意义(P>0.05),见表3。

表3 两组患者LVEF和LVFS比较
2.2ECMO并发症和生存率 本研究患者中13例(56.52%)成功撤机,11例(47.83%)存活出院,3例(13.04%)死于多脏器功能衰竭。并发症包括可控出血4例(17.39%),AKI 5例(21.74%),脑死亡1例(4.35%),肺部感染2例(8.70%),心包填塞2例(8.70%),插管肢体神经功能轻度障碍3例(13.04%),切口感染1例(4.35%)。其中1例患者因心跳停止时间较长,导致左心室大量血栓,再次手术取血栓后存活并出院。
3 讨 论
ECMO技术在中国已经开展了20余年,主要包括静脉-静脉(VV)ECMO和VA ECMO。VV ECMO主要支持肺脏功能,而VA ECMO可以同时支持心、肺功能。本院ECMO中心以VA ECMO为主,病种涵盖广泛,治疗包括AMI、PCS、暴发性心肌炎、肺栓塞、严重心律失常、围生期心肌病、应激性心肌病等。
本研究结果显示,手术组的PLT在ECMO的前3 d,明显低于非手术组,可能与手术创伤、体外循环消耗等原因相关。非手术组患者的APTT峰值明显高于手术组患者,APTT反映的是内源性凝血途径,其中的凝血因子主要由肝脏合成,这提示心源性休克患者的原发疾病导致的肝功能损伤更重,可能合并了凝血因子合成障碍。
本研究中非手术组患者ALT和AST水平在ECMO置管前明显高于手术组患者(P<0.05),主要是因为非手术组患者多为病毒感染诱导的AFM患者,往往合并全身多脏器功能受损,尤其是严重的肝损伤,而手术组患者术前肝功能指标一般基本正常或轻度增高。但是ECMO转流期间,手术组和非手术组的ALT和AST并无差异,且最终两组均呈下降趋势,这可能是由于ECMO提高了肝脏血供,改善了肝脏微循环,降低了肝损伤的缘故。ROJAS等[13]也发现ECMO可以改善实验猪的肝脏血流灌注、氧供和胆汁分泌,并且AST比ALT对热缺血时间更敏感。此外,RBP值降低也是肝功能受损的准确和敏感指标,本研究结果也进一步提示两组患者肝脏损伤的不同。因此在临床ECMO治疗中,更应密切监测非手术组患者肝损伤情况并在转流初期加强保肝治疗。
此外,本研究的结果还显示,在ECMO转流期间,手术组的UN和Cr明显高于非手术组。UN和Cr是肾功能的主要指标之一,主要反映了非蛋白氮的影响。只有当肾小球滤过率下降到正常水平的50%或更低时,才会使UN和Cr水平迅速增加。手术患者的UN和Cr水平增加,可能主要是因为手术患者有长期的心力衰竭病史,常导致心肾综合征。当ECMO患者需要进行血液透析时,生存率仅为45%,远低于不需要进行血液透析的患者(77%)[14],因此,对于心脏外科手术患者,在ECMO转流期间更需要注意肾脏功能的维护。
动态观察两组患者左心室功能变化的情况,本研究结果发现,非手术组患者LVEF和LVFS仅在出院时明显高于手术组患者。与本研究的结果相似,FELKER等[15]报道,AFM患者出院时复查,LVFS显著改善。在本研究中,出院的非手术组患者主要为AFM患者,在ECMO前无心脏疾病。因此,在心脏功能恢复后,这些患者的LVFS和LVEF比存活的心脏病患者要高。
综上所述,在ECMOC治疗的CS患者中,非手术组患者的肝功能障碍更严重,而手术组患者的心、肾功能障碍更严重,在ECMO转流时需要更密切地监测这种病理生理特点,分别加强心、肝、肾等脏器功能的维护。
