“南薯88”茎叶多糖的分离纯化,结构鉴定及其生物活性的研究
2019-04-25侯怡铃赵大群谭春梅刘兴丽侯万儒
刘 露,侯怡铃,王 梅,赵大群,谭春梅,刘兴丽,侯万儒,丁 祥*
(1.西华师范大学 生命科学学院,西南野生动植物资源保护教育部重点实验室,四川 南充 637009;2.南充市农业科学研究院 国家甘薯改良中心南充分中心,四川 南充637001)
红薯是旋花科一年生的草本植物[1]。红薯为我国主要的粮食,有食用、饲养等多种用途。“南薯88”[2]是四川省南充市农业科学院甘薯研究所在1980年用晋专7号作母本,美国红作父本进行有性杂交后培育选择而成的品种。该品种在1988年3月通过四川省品种委员会审定,1991年通过国家审定,1992年获得国家科技进步一等奖。“南薯88”自育成以来,因其产量高、适应性广、熟食品质优而受到广大农户的喜爱,并长期作为国家区试验对照种,在长江中下游薯区覆盖率一度超过70%。
多糖又称多聚糖(polysaccharide),是由至少十个单糖通过糖苷键聚合组成的聚合物。多糖在药理学和生理学等方面起着不同的作用,它们作为细胞壁与环境之间的屏障,具有介导宿主-病原物相互作用,形成生物膜结构的功能。近年来,由于活性多糖具有免疫调节、抗肿瘤、抗病毒、抗氧化及降血糖[3]的功能而广泛受到关注。同时活性多糖能够多途径、多环节、多靶点的调控免疫系统,激活免疫细胞并活化补体,促进生成细胞因子。植物多糖分布范围广,原料来源简便,在医药、农业、食品等领域具有独特的作用[4-5]。
本研究以南充市农业科学研究院专利品种“南薯88”为对象,运用热水浸提技术、柱层析技术分离纯化“南薯 88”多糖(N88P-1),通过红外光谱技术(IR),高效凝胶渗透色谱(HPGPC),高效液相色谱色谱(HPLC)和核磁共振谱(1H NMR和13C NMR)等对“南薯88”多糖(N88P-1)进行结构鉴定;并对“南薯88”多糖(N88P-1)的抗氧化活性和免疫调控能力做了初步探究。为进一步研究“南薯88”多糖(N88P-1)的药理作用、构效关系和更为广泛的应用提供科学依据。
1 材料与方法
1.1 主要材料与仪器
1.1.1 主要材料“南薯88”茎叶由四川省南充市农业科学研究院提供;无水乙醇购买于安徽安特生物化学有限公司;氯化钠购于成都市科龙化工试剂厂;DEAE纤维素购于生兴生物技术(南京)有限公司;葡萄糖,果糖,阿拉伯糖,甘露糖,半乳糖,木糖;ABTS溶液(本实验室提供);DPPH溶液(本实验室提供);cell counting kit(CCK-8 细胞计数试剂盒)购买于上海碧云天生物技术研究所,PBS缓冲液(本实验室提供);RPMI1640培养基,无酚红,购于gibco公司;0.5%Trypsin-EDTA购于gibco公司;胎牛血清购于Clark Bioscience,实验药品均为分析纯。
1.1.2 主要实验仪器小鼠巨噬细胞RAW264.7、B淋巴细胞、T淋巴细胞购买于中国科学院上海生命科学研究院生物化学与细胞生物学研究所;CO2恒温培养箱;超净工作台;紫外分光光度计;电子天平;96孔微量培养板;徕卡倒置显微镜;台式低温高速离心机;Epoch酶标仪;旋转蒸发器;电热恒温水浴锅;高效液相色谱仪;徕卡DMI 3000倒置荧光显微镜。
1.2 方法
1.2.1 “南薯88”多糖(N88P-1)的提取称取烘干后的南薯88茎叶300 g,剪成小段再放于粉碎机中粉碎;以料液比1∶3的比例在水浴锅90℃蒸馏水中煮6 h,煮3次[6];收集上清液,旋转蒸发浓缩至200 mL,加入4倍体积无水乙醇[7],用玻璃棒搅拌有絮状沉淀产生,离心收集沉淀,烘干后得到“南薯88”多糖(N88P-1)的粗多糖[8]。
1.2.2 “南薯88”多糖(N88P-1)的分离纯化使用DEAE cellulose-52 色谱柱[9](2 cm×60 cm),自然沉降柱填料。精密称取“南薯88”多糖(N88P-1)的粗多糖5 g,溶解于5 mL蒸馏水中,离心后的上清液加入 DEAE cellulose-52 色谱柱 (2 cm×60 cm),配制 不 同 浓 度 的 NaCl 溶 液 (0、0.1、0.2、0.3、0.4、0.5 mol/L)作为流动洗脱相,流速2 mL/min,每管收集5 mL的洗脱液于试管中,采用硫酸苯酚法[10],在490 nm波长下测定吸光度值,横坐标为管数,纵坐标为吸光度值做洗脱曲线图。并将收集的“南薯88”多糖命名为N88P-1。
1.2.3 N88P-1的分子量测定称取5 mg N88P-1样品用1 mL蒸馏水溶解,超声5 min。用高效凝胶渗透色谱法(HPGPC)测定N88P-1的分子量。测得的数据用GPC软件与葡聚糖制备标准曲线对照得到分子量[11-12]。
1.2.4 N88P-1的红外谱分析称取N88P-1样品5 mg,在研钵中与KBr粉末一起研细后压片,在傅里叶红外光谱仪4 000 cm-1~400 cm-1[13]的范围内扫描。
1.2.5 N88P-1的核磁共振分析称取N88P-1样品20 mg溶解于D2O中,常温下在核磁共振仪上测定,400 MHz测1H NMR谱,150 MHz测13C NMR谱[14]。
1.2.6 N88P-1的水解称取N88P-1 20 mg到安瓿瓶,加入2 mol/L的TFA溶液[15]5 mL,110℃完全密封水解6 h,离心除残渣,烘干,用蒸馏水洗3次除去三氟乙酸,然后再加几滴甲醇,烘干后用水溶解,得到完全酸水解产物,保存备用。
1.2.7 N88P-1的单糖组成分析N88P-1经过三氟乙酸水解后得到完全酸水解产物,通过高效液相色谱仪[16]对N88P-1进行单糖组成分析。 色谱条件为:4.6 mm×250 mm,5 μm 色谱柱; 柱温:25 ℃;流动相:75% 乙腈;流速:1.4 mL/min;RID检测器温度:35 ℃;进样量:5 μL。
1.2.8 N88P-1对ABTS+自由基清除能力的测定将N88P-1样品用蒸馏水配制成浓度梯度(0.5、1、2、3、4、5、10 mg/mL), 取配制好的各浓度溶液 2 mL于试管,分别加入2 mL ABTS+自由基工作液,振荡混合,室温放置20 min,测定吸光度值A1;同时取配制好的各浓度溶液2 mL,分别加入2 mL蒸馏水,测得734 nm处的吸光度值A2;再测定734 nm处2 mL蒸馏水与2 mL ABTS+自由基工作液的吸光值,记为A0。重复测三次,阳性对照组为VC。ABTS+自由基清除能力 =[1-(A1-A2)/A0]×100%[17]。
1.2.9 N88P-1对DPPH-自由基清除能力的测定将N88P-1样品用蒸馏水配制成浓度梯度(0.5、1、2、3、4、5、10 mg/mL),取配制好的各浓度溶液 2 mL,加入2.0 mL 0.2 mmol/L DPPH-溶液[18-19],测定517 nm处的吸光度值A1;同时测定2 mL样品溶液与2 mL水在517 nm处的吸光度值A2;在517 nm处测定水和DPPH-溶液的吸光度值A0。重复测3次,阳性对照组为VC。
DPPH-清除能力 =[(A1-A2)/A0]×100%。
1.2.10 N88P-1对T、B细胞和RAW264.7细胞的增殖作用用细胞计数试剂盒 CCK-8[20](cell counting kit) 法测定 N88P-1对 T、B细胞和RAW264.7细胞的增殖实验中的细胞数。用培养液溶解N88P-1多糖,用0.22 μm滤器除菌储存备用,用时用培养液逐级稀释(2.5、5、10、20、40、80 μg/mL)。取对数生长期的T、B细胞和RAW264.7细胞,更换新鲜的培养液,并用培养液稀释至2×105细胞/mL,将PBS缓冲液加入96孔板的四周,保持无菌的水环境,再在其余的孔加入100 μL细胞稀释液。在37℃、5%CO2的培养箱中培养24 h后,依次加入100 μL细胞培养液 (空白对照)、LPS(终质量浓度10 μg/mL,阳性对照)以及不同浓度的N88P-1溶液,在37℃、5%CO2的培养箱中培养24 h。每孔加入CCK-8溶液5 μL继续培养3 h,测定450 nm下吸光值,记录结果。绘制以浓度为横坐标,吸光值为纵坐标的曲线,并拍照。
1.2.11 统计与分析所有数据均用mean±SD表示,用t-test检验差异的显著性,与对照组对比显著用 * 表示,P<0.05,极显著用 ** 表示,P<0.01。
2 结果与分析
2.1 N88P-1 EAE cellulose-52色谱柱层析分级结果
DEAE cellulose-52纤维素柱填料为阴离子交换剂,是一种颗粒大小为50 μm的高度交联纤维素。多用于分离提纯多糖、核苷酸等生物大分子。多糖在硫酸的作用下先水解成单糖,并迅速脱水生成糖醛衍生物,然后与苯酚生成橙黄色化合物,再以比色法测定。本研究采用DEAE cellulose-52色谱柱,用不同浓度的 NaCl溶液(0 mol/L、0.1 mol/L、0.2 mol/L、0.3 mol/L、0.4 mol/L、0.5 mol/L)作为流动洗脱相,采用硫酸苯酚法在490 nm测定多糖的吸光度值,洗脱曲线如图1所示,用0.1 mol/LNaCl洗脱时出现一个较大的洗脱峰,合并0.1 mol/L NaCl段中第4~8管中的多糖溶液,浓缩干燥后得到淡黄色无定型粉末,即“南薯 88”多糖(N88P-1)。
2.2 N88P-1高效凝胶渗透色谱(HPGPC)结果
本研究采用高效凝胶渗透色谱法 (HPGPC)测定N88P-1的分子量。结果显示(见图2),在14 min左右出现单一峰,曲线呈对称分布的钟罩型曲线,提示N88P-1是单一多糖成分,无其他杂质。同时,测得的N88P-1的重均分子量为14 328 D,数均分子量为4 707 D,峰值分子量为7 199 D,多分散系数为 3.04(见图 3)。

图1 N88P-1的DEAE cellulose-52纤维素柱层析洗脱曲线Fig.1 Chromatogram of N88P-1 on a DEAE cellulose-52 column

图2 N88P-1的高效凝胶渗透色谱Fig.2 High performance gel permeation chromatogram of N88P-1

图3 N88P-1的分子量Fig.3 Molecular weight of N88P-1
2.3 N88P-1的FTIR谱分析
傅里叶红外光技术(FTIR)是对多糖的酯化度进行定量分析的方法,操作简单,重现性好。本研究采用傅里叶红外光技术在4 000~460 cm-1范围内测定N88P-1的红外吸收。数据如图4所示,3 444.81 cm-1出现的一处宽吸收峰宽吸收峰指定为O-H的伸缩振动峰,这说明N88P-1存在分子内或分子间氢键;1 640.20 cm-1指定为C=O的伸缩振动峰;1 401.27 cm-1附近的吸收峰是由 C-H的变角振动引起。以上显示了多糖在1 400~4 000 cm-1范围内的特征吸收峰。在指纹峰区域范围内950~1 250 cm-1的一组峰是2种C-O的伸缩振动引起的,1种是C-O-C的振动峰,另1种是C-O-H的吸收峰(N88P-1的吸收峰在1 102.25 cm-1和1 041.70 cm-1处)。该结果进一步证明此物质为多糖结构,特征峰明显,且成分单一,无其他结构特征峰,应为纯品多糖。

图4 N88P-1的红外分析Fig.4 Fourier transform infrared spectra of N88P-1
2.4 N88P-1的1H-NMR谱分析
N88P-1的1H-NMR谱如图5所示,结果显示N88P-1杂质含量较少。在δ 4.93~δ 4.86存在单糖异头氢信号。 δ 3.19~δ 4.39为各单糖中2-6位碳上的氢信号峰的重叠,其中 δ 3.18~δ 3.30可指示为单糖亚甲基上的氢信号。 δ 4.08~δ 4.39可指示为单糖3位碳上的氢信号。δ 4.67则指示为溶剂重水的氢信号。

图5 N88P-1的1H NMR谱数据Fig.5 1H NMR spectra of N88P-1
2.5 N88P-1的高效液相色谱(HPLC)结果
采用高效液相色谱法(HPLC)测定多糖的单糖组成,此方法操作简单,灵敏度高,反应条件温和。本研究通过三氟乙酸(TFA)得到N88P-1的完全酸水解产物,采用高效液相色谱法得到高效液相色谱,再对比各种单糖的出峰时间分析N88P-1的单糖组成。结果显示,在保留时间为7.294 min及7.955 min处有两处明显的吸收峰 (图7),与单糖(包括葡萄糖,甘露糖,果糖等)的高效液相图谱(图6)对比发现,该两处吸收峰分别与甘露糖(保留时间为7.386 min)和半乳糖(保留时间为8.014 min)的吸收峰吻合。提示N88P-1由甘露糖和半乳糖两种单糖组成,同时吸收峰峰面积比值提示甘露糖和半乳糖两种单糖比例为1∶1。


图6 高效液相图谱Fig.6 Analysis of standard monosaccharides by HPLC

图7 高效液相色谱法测定N88P-1的单糖组分分析Fig.7 Component monosaccharides analysis of N88P-1 by HPLC
2.6 N88P-1对ABTS自由基的清除能力
适当的氧化剂会使ABTS氧化为绿色,如果存在抗氧化物,就会抑制绿色产物的生成。抗氧化物的浓度不同会造成ABTS的产物颜色改变,抗氧化物越强则产物的颜色越浅,并在734 nm的波长下测定吸光度值,计算总抗氧化能力。如图8所示,在一定浓度的范围内,N88P-1对ABTS自由基的清除率和N88P-1浓度有一定的量效关系,ABTS自由基的清除率随着N88P-1浓度的增加而逐步增加。在低浓度(<2 mg/mL)时,提高N88P-1浓度,清除率增加明显;同时其IC50值为0.48 mg/mL。当N88P-1的浓度为3 mg/mL时,清除率可达到最大值。其后再增加N88P-1的浓度,对ABTS的清除率提高不大。值得注意的是,低浓度的VC对ABTS自由基的清除作用强于N88P-1,但随着浓度的增大N88P-1和维生素C清除能力接近。

图8 N88P-1对ABTS自由基的清除能力Fig.8 ABTS radical cation scavenging activity of N88P-1
2.8 N88P-1对DPPH自由基的清除能力
DPPH溶液是一种在517 nm波长处有一个特征吸收峰,为紫色的一种化合物。适当的自由基清除剂会与DPPH自由基反应导致反应颜色变浅,517 nm处测定的吸光度值也会变小,所以判定DPPH自由基的清除效果可以通过测定吸光度。本实验研究N88P-1对DPPH自由基的清除能力结果如图9所示,在低浓度的范围内,N88P-1对DPPH自由基的清除率与浓度呈正相关,IC50值为0.96 mg/mL,其中,N88P-1对DPPH自由基清除的最适浓度为3 mg/mL。

图9 N88P-1对DPPH自由基的清除能力Fig.9 Scavenging effect of N88P-1 on 1,1-dipheyl-2-picrydrazyl radicals
2.9 N88P-1对T淋巴细胞的增殖作用
T淋巴细胞简称T细胞,由骨髓中的造血干细胞迁移到胸腺内分化成熟,成为具有免疫活性的T细胞。成熟的T细胞能与靶细胞特异性结合,直接杀伤靶细胞,或释放淋巴因子,使得免疫效应增强,主要参与机体的细胞免疫。T增殖效果如图10所示,对照组为浓度为10 μg/mL的LPS。N88P-1在2.5~80 μg/mL的浓度范围内,与T细胞增殖效果呈正相关;N88P-1 浓度为 5~10 μg/mL 时,T 细胞增殖效果显著(P<0.05),在浓度为 20~80 μg/mL 时,T 细胞增殖效果为极显著(P<0.01);当N88P-1浓度在40 μg/mL 时达到最大值(P<0.01),继续增大浓度,细胞受到周围环境的影响导致细胞增殖效果反而下降。
T细胞的增殖形态如图11所示。 随着N88P-1浓度的增大,细胞加速分裂,变大成团。在用40 μg/mL的N88P-1浓度刺激时,细胞成团最多且最大。

图10 N88P-1对T细胞增殖的影响Fig.10 Effect of N88P-1 on the cell proliferation of T cell

图11 N88P-1对T细胞形态的影响Fig.11 Effect the cell morphology of T cell by N88P-1
2.1 0 N88P-1对B淋巴细胞增殖的影响
B淋巴细胞来源于骨髓的多能干细胞,能够分泌抗体,是体液免疫的主要介质。B细胞的增值效果如图12所示,对照组为10 μg/mL的LPS。N88P-1在浓度为2.5~10 μg/mL时,增殖效果显著;在浓度为20~80 μg/mL的时,增殖效果达到极显著 (P<0.01);在40 μg/mL的浓度增殖效果亦为最好。 从形态上看,B细胞呈规则的圆形,明显的集簇生长。本研究的B细胞增殖形态如图13所示,B细胞悬浮在培养孔中,生长状态良好,受到N88P-1刺激后,细胞体积变大后聚成团,增殖能力旺盛。
激活巨噬细胞后能在抵御感染和抗肿瘤方面发挥着重要作用。本研究采用CCK-8法检测巨噬细胞增殖效果如图14所示,N88P-1浓度为2.5 μg/mL时,增殖并不显著;浓度为5 μg/mL时增殖效果显著(P<0.05);N88P-1 浓度继续增加为 10~40 μg/mL时,N88P-1对巨噬细胞增殖效果为极显著 (P<0.01);但是,当N88P-1浓度为80 μg/mL时,增殖效果反而降低为显著(P<0.05)。

图12 N88P-1对B细胞增殖的影响Fig.12 Effect of N88P-1 on the cell proliferation of B cell
巨噬细胞体积大,有伪足且有马蹄状单核,在细胞板中培养的时候易于沉降和贴壁。本研究巨噬细胞增殖形态如图15所示。在N88P-1的刺激下,巨噬细胞伸出伪足,进行分裂;在图15中可以看出,空白组的巨噬细胞多呈圆形;而N88P-1实验组的巨噬细胞伸出伪足,只有少量的圆形细胞,提示N88P-1能有效的促进巨噬细胞的增殖作用。

图13 N88P-1对B细胞形态的影响Fig.13 Effect the cell morphology of B cell by N88P-1

图14 N88P-1对巨噬细胞增殖的影响Fig.14 Effect of N88P-1 on the cell proliferation of RAW264.7 cell
3 讨论与结语
蛋白质、核酸与多糖共同构成人体内三大物质。蛋白质与核酸的发展较为成熟,相比之下的多糖因复杂性和多样性而发展较晚,因此,对多糖结构鉴定都提出了巨大挑战。本研究以南充市农业科学研究院专利品种“南薯88”为对象,用热水浸提法,DEAE-cellulose column进行柱层析分离纯化后得到多糖纯品(N88P-1)。分别进行高效凝胶渗透色谱(HPGPC),红外光谱技术(IR)和核磁共振技术(NMR)等现代化技术对N88P-1进行了初步的结构分析;结果显示,N88P-1由半乳糖和甘露糖组成,且比例为1∶1。这是首次确定“南薯88”多糖(N88P-1)的单糖类型和含量,为进一步确定“南薯88”多糖(N88P-1)的精细结构提供了很好的基础。
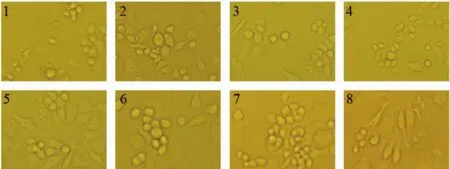
图15 N88P-1对巨噬细胞形态的影响Fig.15 Effect the cell morphology of RAW264.7 cell by N88P-1
活性氧产生于细胞或组织的正常生理代谢等过程,活性氧能够对蛋白质、核酸等生物大分子产生损伤。本研究采用ABTS+和DPPH-检测N88P-1的总抗氧化能力。结果显示,一定范围内的N88P-1浓度具有清除ABTS+自由基的能力,且对ABTS自由基的清除能力强于对DPPH自由基的清除能力。当N88P-1的质量浓度为3 mg/mL时,对ABTS+和DPPH-自由基的清除能力均达到最高值。DPPH作为一种稳定的自由基,可以捕获其他的自由基。而N88P-1是一种高分子化合物,随着质量浓度的增加,糖链相互缠绕,很难与DPPH自由基反应,因此可能导致DPPH自由基清除率降低。
免疫细胞中T细胞、B细胞和巨噬细胞在人体免疫系统中起着非常重要的作用。本研究分别用N88P-1激活T细胞、B细胞、巨噬细胞的增殖来调控免疫活性。N88P-1在20~80 mg/mL的质量浓度下,对B细胞和T细胞增殖效果为极显著 (P<0.01);在10~40 mg/mL的质量浓度下,对巨噬细胞增殖效果为极显著(P<0.01),提示N88P-1对巨噬细胞的增殖作用强于对T淋巴细胞核B淋巴细胞的增殖作用。但值得注意的是,N88P-1在40 mg/mL的质量浓度下对3种免疫细胞的增殖效果均达到最佳。
综上,“南薯88”多糖(N88P-1)作为一类生物大分子,对不同类型自由基具有不同的清除效率,且对不同的免疫细胞具有不同的增殖效果,可以作为一种天然来源的抗氧化剂及免疫调控剂资源。但是关于“南薯88”多糖(N88P-1)的精细结构及抗氧化作用和免疫调控作用的相关分子机制还有待于进一步研究。
