海洋源蛋白酶产生菌筛选及酶学特性的初步研究
2019-04-25王秀娟翁佩芳周小敏高志中吴祖芳
曹 红,王秀娟,翁佩芳*,周小敏,高志中,吴祖芳,张 鑫
(1.宁波大学 海洋学院,应用海洋生物技术教育部重点实验室,浙江 宁波 315211;2.浙江兴业集团有限公司,浙江 舟山 316100)
传统的鱼酱油是自然温度下通过耐盐微生物和鱼体自身所含的酶对原料鱼中的蛋白质、脂肪等成分进行发酵分解,形成气味浓郁、滋味独特、营养丰富的发酵液[1-2],包括其中的微生物产生的蛋白酶降解蛋白质形成多肽、氨基酸等风味物质[3-4]。但是传统的鱼酱油生产盐度过高,生产周期长达数月乃至数年,产量难以提高;另一方面,自然发酵过程中菌群复杂,特征风味物质不稳定,进行速酿工艺研究是鱼酱油产业发展的必然要求[5]。目前速酿工艺主要依靠超高压水解、外加酶发酵、外加曲发酵和加酸减盐等快速发酵方法[6],但是这些方法均存在一定的局限性,如超高压水解法操作要求较高,不容易达到产业化规模[7];外加酶发酵会产生苦味肤,影响风味[8];外加曲发酵需要在发酵初期加足盐量,防止鱼体腐烂,但由过高的盐浓度抑制了种曲与鱼体内脏酶活力,生产周期没有明显缩短[9];加酸减盐发酵虽可促进鱼肉的自溶并缩短发酵时间,但是所得鱼露口感偏酸,不符合人们的饮食习惯[10]。
近几年国内外研究者对鱼酱油发酵过程中微生物分解蛋白质对产品影响机理的研究[11-12],进一步证明利用产蛋白酶微生物菌株作为发酵剂可改善产品品质和缩短发酵周期。文献 [11]将T.halophilus接种至鱼肉汤中,发现其风味物质、氨基酸等营养物质与自然发酵鱼酱油中的基本一致。文献[5,13]均发现将嗜盐古生菌接种到鱼露发酵中,不仅缩短鱼露发酵周期,并且达到了去腥、防腐的效果,避免不良风味的产生。因此外加产蛋白酶微生物法,为鱼露的速酿工艺及产品品质改善提供了一种新的解决途径。
本课题组在前期分析了鱿鱼鱼酱油自然发酵过程中的微生物多样性及几种鱼酱油的品质比较分析,期望从海洋源的原料中直接筛选出产蛋白酶微生物应用于鱼酱油发酵生产。鱼酱油的原料主要为海洋低值鱼类,其体内本身就存在大量产蛋白酶微生物,可以直接从其体内筛选。鱿鱼及其副产物常作为鱼酱油发酵的原料,且鱿鱼蛋白质含量高,体内菌群分布广泛,其优势菌群为假单胞菌、芽孢杆菌等产蛋白酶的微生物[14]。但针对应用鱼酱油发酵的产蛋白酶微生物的研究较少,本文通过从海洋源鱿鱼分离筛选出高产蛋白酶菌株,旨在为鱼酱油的速酿工艺及品质改善提供微生物来源。
1 材料与方法
1.1 材料和试剂
材料:从宁波路林市场采购新鲜的鱿鱼,4℃保存备用。
试剂:福林酚试剂(国药集团化学试剂有限公司);L-酪氨酸 (国药集团化学试剂有限公司);E.Z.N.A.TM Bacterial DNA Kit(大连宝生物工程有限公司)。
培养基:脂牛奶固体培养基(g/L):脱脂奶粉75 g,105℃下灭菌 15 min,琼脂15 g,121℃下灭菌15 min,将两者在无菌环境下混合;干酪素固体培养基(g/L):A 液:Na2HPO4·12H2O 1.07 g,干酪素 4 g,200 mL水溶解,70℃下水浴 2 h;B 液:KH2PO43 g,200 mL水溶解;A、B液混合后加入琼脂15 g,定容至1 000 mL,121℃下灭菌15 min;液体发酵培养基(g/L):蛋白胨 10 g,牛肉膏 3 g,氯化钠 5 g,121 ℃下灭菌 15 min;斜面保藏培养(g/L):蛋白胨 10 g,牛肉膏3 g,氯化钠5 g,琼脂15 g,121℃下灭菌15 min。
1.2 仪器
QYC-2102C恒温振荡培养箱 (宁波江南仪器厂);HWS智能型恒温培养箱 (宁波江南仪器厂);LV-3300分光光度计(上海美谱达仪器有限公司);5804R高速冷冻离心机 (德国Eppendorf公司);5814R小型高速离心机 (德国Eppendorf公司);5331 PCR仪(德国Eppendorf公司);Gel Doc XR 凝胶成像系统(美国Bio-Rad公司)。
1.3 实验方法
1.3.1 原料预处理将新鲜的鱿鱼采用无菌操作分离鱼皮、内脏,并用整鱼作对照,用灭菌的组织绞碎机绞碎后,用无菌生理盐水浸泡冲洗并收集洗液到无菌离心管中,此为样品原液。
1.3.2 高产蛋白酶菌株的初筛取1 mL样品原液制备成10-1、10-2和10-33个梯度菌悬液,分别取200 μL菌悬液涂布于脱脂牛奶固体培养基上,每个梯度设3个平行,于30℃恒温培养箱培养3 d,选取菌落周围具有明显透明圈的菌株,于脱脂牛奶固体培养基上进行划线纯培养。
将上述纯化的菌株用接种环点种在干酪素固体培养基上,每株菌株设3个平行,于30℃恒温下培养3 d,挑选能够产生较大透明圈的菌株,并记录其透明圈直径(D)和菌落直径(d),比较D/d值,选择D/d>2的菌株进行复筛。
1.3.3 高产蛋白酶菌株的复筛挑取初筛得到的菌株,接种到50 mL基础发酵培养基中,置于恒温摇床中,30℃、150 r/min活化24 h,作为种子液,再以4%接种量,接种到发酵培养基中,30℃、150 r/min 培养 3 d,取发酵液,离心(6 000 r/min,15 min,4℃)收集上清液,上清液即为粗酶液,测定粗酶液蛋白酶活力。筛选出酶活力较高的菌株即为代表菌株,其中酶活力最高菌株即为目的菌株。
1.4 蛋白酶活力的测定
采用福林酚法(GB/T 23527—2009)测定蛋白酶活力。
1.5 代表菌株的鉴定
1.5.1 目的菌株形态及生理生化鉴定菌落形态观察:将目的菌株划线接种于牛肉膏-蛋白胨培养基,30℃培养培养2 d,观察菌落形态特征和革兰氏染色特征。
生理生化试验:参照《伯杰氏细菌鉴定手册》和《常见细菌系统鉴定手册》,对目的菌株进行糖发酵试验、V-P试验、甲基红试验等生理生化试验。
1.5.2 代表菌株16S rRNA鉴定使用细菌DNA试剂盒E.Z.N.A.TM Bacterial DNA Kit提取分离纯化出的代表菌株DNA,以提取出的细菌DNA为模板,采用通用引物序列 27F(5'-AGAGTTTGATCCTGGCTCAG-3') 和 1492R (5'-TACGGCTA CCTTGTTACGACTT-3')扩增菌株的16S rRNA基因[15]。聚合酶链式反应(polymerase chain reaction,PCR)反应体系包括:上下游引物(10 umol/L)各 2 μL,模板 DNA 2 μL,Taq 酶 25 μL,无菌去离子水补充至50 μL。PCR扩增条件为:(1)95℃预变性 3 min;(2)94 ℃变性 50 s,52 ℃退火 50 s,72 ℃延伸 90 s,30个循环;(3)72 ℃延伸 10 min。
1.5.3 16S rRNA基因序列分析及系统发育分析将经电泳检测扩增良好的PCR产物,送往上海桑尼生物科技有限公司进行测序,测序所用引物与PCR扩增引物相同。测序所得序列使用BLAST程序,通过美国国家生物信息中心(NCBI)的GenBank数据库进行同源性比较分析。依据序列分析结果,选择与目的菌株序列相似性较高(99%以上)的已知菌株序列,利用MEGA5.05[16]软件构建系统发育树。
1.6 粗蛋白酶特性研究
1.6.1 pH对粗蛋白酶活的影响分别配制pH为3.0~11.0的梯度缓冲溶液,以1%酪蛋白溶液作为粗酶活测定的反应底物,以最高点的粗蛋白酶活力为100%,其他与之相比得相对酶活力,绘制粗蛋白酶的最适pH值曲线。
1.6.2 pH稳定性研究将粗蛋白酶液分别与不同pH的缓冲溶液混合均匀,置于40℃下水浴保温1 h后,测定剩余酶活,以最高点粗蛋白酶活力为100%,其他pH条件下与之相比为相对酶活,绘制粗蛋白酶的pH值稳定性曲线,计算相对酶活力。
1.6.3 温度对粗蛋白酶活的影响在温度分别为4、10、20、30、40、50、60、70、80、90、100 ℃下 测 定 该菌株粗蛋白酶液酶活,其他条件不变,以最高点粗蛋白酶活力为100%,其他与之相比得相对酶活,以确定粗蛋白酶的最适反应温度,绘制酶催化温度曲线,计算相对酶活力。
1.6.4 热稳定性研究在35、40、45℃不同温度条件下,将粗蛋白酶液置分别保温一定时间,取出后迅速冷却,以pH 7.2的1%酪蛋白溶液为反应底物,40℃下测定剩余粗蛋白酶活力,以未处理的粗蛋白酶液的酶活为100%,其他温度条件下与之相比为相对酶活,绘制酶热稳定性曲线,计算相对酶活力。
1.6.5 金属离子对酶活的影响向反应体系中加入终浓度为 1 mmol/L不同金属离子:Ca2+、Mg2+、Fe3+、Cu2+、Zn2+、Ba2+、Mn2+,充分混匀后,在 40 ℃下放置24 h,测定酶活,以超纯水为空白对照的粗蛋白酶液的酶活力为100%,其他金属离子下与之相比为相对酶活,计算相对酶活力。
2 结果与分析
2.1 高产蛋白酶菌株的筛选
2.1.1 高产蛋白酶菌株的初筛从脱脂牛奶平板培养基上挑取具有明显透明圈的菌株,接种在干酪素平板分离培养上,筛选透明圈D/d>2的菌株,透明圈结果如图1所示。分别从鱿鱼鱼皮、内脏、整鱼(分别记为SE、SV、SW,下同)中分离得到5株、4株、7株产蛋白酶菌株。由此看出,产蛋白酶菌株在鱿鱼不同部位的数量无明显差异,这表明在鱿鱼体内产蛋白酶菌株分布较均匀。一般来讲,新鲜捕获的健康鱿鱼其组织内部是无菌的,然而在鱼表面的黏液及内脏内存在微生物,这主要是鱿鱼蛋白质含量丰富利于微生物的寄生[17]。
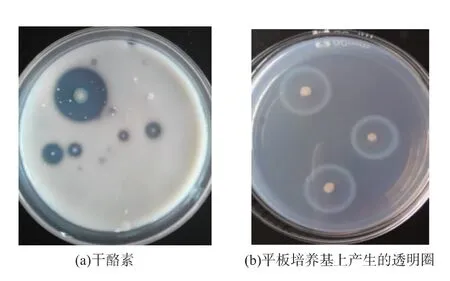
图1 产蛋白酶菌株在脱脂牛奶平板培养基Fig.1 Transparent circles on skim-milk culture
2.1.2 高产蛋白酶菌株的复筛将上述初筛得到的16株产蛋白酶菌株发酵培养,测定发酵液的蛋白酶活力。酪氨酸标准曲线公式:y=0.010 3x-0.006 8(R2=0.999 7,0<x<100 ug/mL),根据酶活力公式计算各菌株产酶能力。复筛结果如表1所示,由表1可以看出SW5产酶活性最高为257.67±2.44 U/mL,对比文献[18]从南海深海海泥中筛选出的产蛋白酶菌株苏云金芽孢杆菌(Bacillus thuringiensis)酶活力为90 U/mL提高近3倍,并将SW5菌株作为目的菌株,进一步做产酶特性研究,将表1中所有菌株作为代表菌株,进行菌株鉴定。
2.2 代表菌株鉴定
将上述复筛得到的10株菌株,革兰氏染色观察。以细菌通用引物27F和1492R对代表菌株进行PCR扩增,扩增产物进行琼脂糖凝胶电泳检测,均得到重复性好且稳定、清晰的特异性条带,片段大小为1200 bp左右,电泳图谱如图2所示。再将测序后的序列在NCBI数据库进行比对,所得结果如表2所示。结果表明筛选出的菌株可以分为3类:芽孢杆菌属(Bacillussp.)、普罗威登斯菌属(Providenciasp.)、假单胞菌属 (Pseudomonassp.),且置信度≥98%,其中解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、枯草芽孢杆菌(Bacillus subtilis)较多。目的菌株SW5为甲基营养型芽孢杆菌(Bacillus methylotrophicus),置信度为 100%。研究发现鱿鱼中产蛋白酶的微生物主要为芽孢杆菌属和假单胞菌属[19-20]。芽孢杆菌产生蛋白酶能力较强,是常见的商业产蛋白酶菌株,有学者对芽孢杆菌所产的蛋白酶学性质进行了研究,发现此类菌具有较高的酶活力,可能是通过产生蛋白酶降解蛋白质[21]。鱿鱼中的优势菌群主要为假单胞菌,假单胞菌大多耐低温,分泌的蛋白酶却耐高温,即使经过高温处理后,在食品中仍然能检测到这种酶的存在,在低温储藏条件下,残留的蛋白酶也可以继续分解蛋白质[22]。国内对普罗威登斯菌的报道较少,一般在肉类食品中容易检测到,是动物肠道的正常菌群,同样对蛋白质具有分解作用[23]。

表1 产蛋白酶菌株复筛结果Table 1 Results of the screening protease producing strain
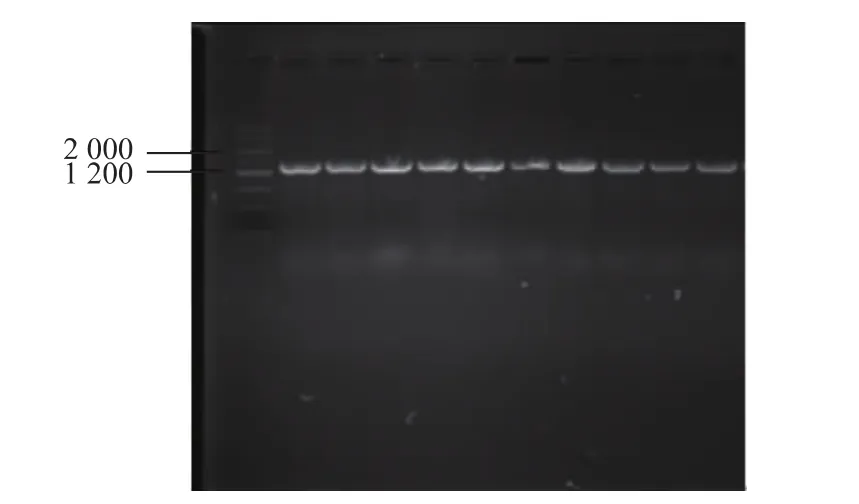
图2 菌株DNA的PCR扩增产物电泳图谱Fig.2 Electrophoregram of PCR amplification products of strains'DNA
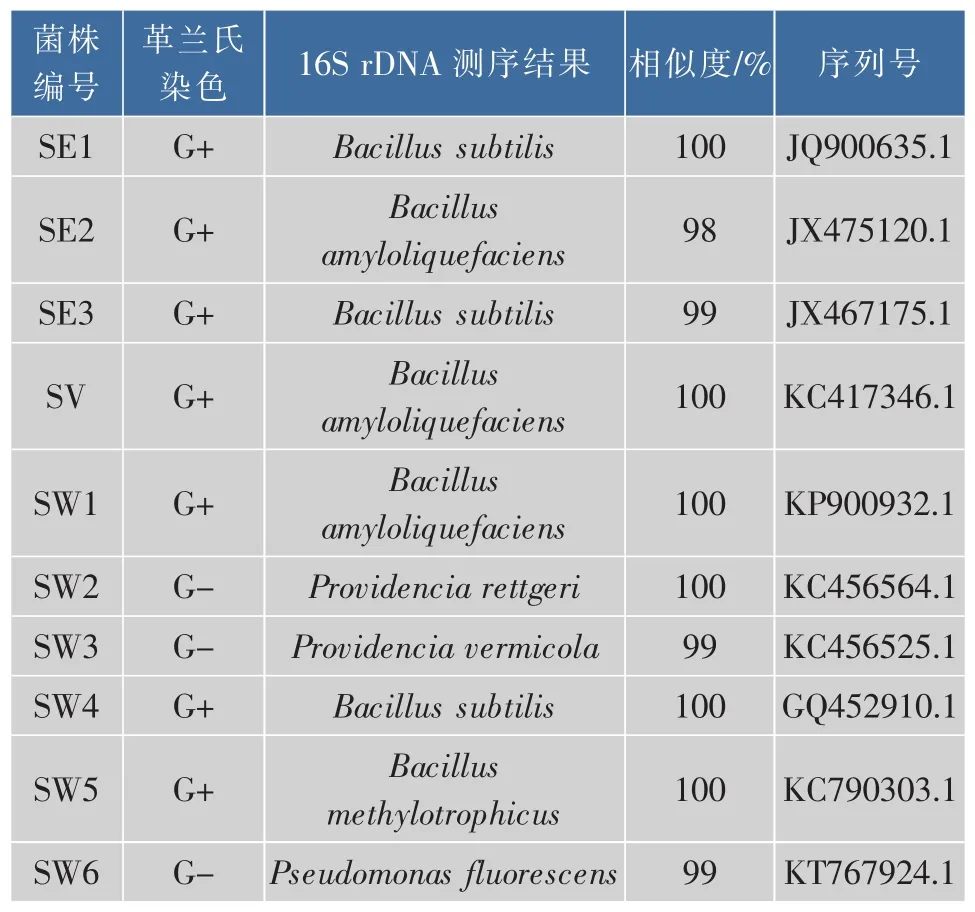
表2 代表菌株鉴定结果Table 2 Identification results of the representative strains
2.3 目的菌株SW5鉴定及其系统发育树建立
菌株SW5革兰氏染色为阳性,芽孢染色阳性,生理生化试验结果见表3。根据 《伯杰细菌鉴定手册》和《常见细菌系统鉴定手册》中芽孢杆菌属的特征描述,可以确定菌株SW5属于芽孢杆菌属。将SW5的16S rRNA序列提交NCBI,在Genbank数据库中进行同源性比较分析,选取同源性在99%以上的菌株的序列,用Mega5.05软件进行序列对比,建立的系统发育树如图3所示。从图3可以看出,SW5菌株与甲基营养型芽孢杆菌(Bacillus methylotrophicusKC790303.1)同源性最高,可达100%。由此可以推断出高产蛋白酶菌株SW5为甲基营养型芽孢杆菌。研究报道甲基营养型芽孢杆菌对外界有害因子抵抗力强、分布广,存在于土壤、水、及动物肠道等处[24]。张岩等从合浦珠母贝黏液中同样分离得到一株甲基营养型芽孢杆菌,经研究发现其蛋白酶的酶解发酵液具有抑菌作用,可作为天然防腐剂的开发,其抑菌成分为蛋白或多肽类物质[25]。杨佳等从肖尔布拉克酒业酱香型高温大曲中分离得到的甲基营养型芽孢杆菌不仅产蛋白酶活力高,而且能够发酵产生香气物质,调节食品风味[26]。
2.4 粗蛋白酶特性分析
2.4.1 粗蛋白酶的最适pH及其酸碱稳定性测定不同pH对粗蛋白酶活性的影响,结果如图4所示,pH在3~8时,SW5菌株所产粗蛋白酶的酶活力随pH增加逐渐升高,pH为8.0时,粗酶活力达到最高,若继续pH升高,则粗酶活力逐渐下降,由此看出该菌株所产蛋白酶的最适pH为6.0~8.0。黄紫燕研究发现鱼酱油发酵过程中的优势乳酸菌所产蛋白酶的最适pH为7.0,本实验结果与其报道一致,发酵液的pH与鱼露的各项理化指标及风味密切相关[27]。蛋白酶在鱼酱油发酵过程中的主要作用是不断把鱼肉蛋白分解成小分子的肽或游离氨基酸,进而影响发酵液pH及风味[28]。

表3 SW5菌株的生理生化特征Table 3 Physiological and biochemical characteristics of SW5

图3 菌株SW5的16S rRNA基因序列系统发育树Fig.3 Phylogenetic tree based on 16S rRNA sequence of strain SW5
SW5菌株所产粗蛋白酶对pH的稳定性如图5所示,pH为8.0~10.0时,该粗蛋白酶的稳定性较好,均已达到85%以上;但当反应体系为酸性条件时,粗酶活力损失比较严重,因此可以判断该菌株所产粗蛋白酶在碱性条件下能够发挥其优势作用。
2.4.2 粗蛋白酶的最适温度及其热稳定性测定SW5菌株所产粗蛋白酶在不同温度条件下的酶活性,结果如图6所示,由图可知当温度较低时,粗蛋白酶活力随温度的升高而逐渐增大,当温度升高到40℃时,该粗蛋白酶活力达到了最高,在30~50℃时具有较高酶活性。当温度低于30℃或高于50℃时,粗蛋白酶活力均会显著下降。国内外研究发现鱼酱油发酵的温度一般在30~45℃[29],张豪等研究了鱼酱油曲的制备工艺,当发酵温度为37℃时得到的鱼酱油具有固有香型,达到了速酿的目的[30]。因此,该菌株所产的蛋白酶可以作为外源酶添加到鱼酱油发酵中,为鱼酱油发酵提供一种新的参考。

图4 pH对粗蛋白酶活性的影响Fig.4 Effect of pH on crude protease activity

图5 pH稳定性Fig.5 pH stability
SW5菌株所产粗蛋白酶对温度的稳定性如图7所示,若保温相同时间,随温度的升高,粗蛋白酶活性逐渐降低;在35℃下,保温不同时间测定粗蛋白酶活性,保温60 min后仍保留80%以上的酶活性,相对稳定;当温度为55℃时,保温30 min后粗蛋白酶活力损失了25%,保温60 min后,粗蛋白酶活力仅剩余60%。由此可知,该蛋白酶在35℃拥有良好的稳定性。
2.4.3 金属离子对粗蛋白酶活力的影响测定不同金属离子对SW5菌株所产粗蛋白酶活性的影响,金属离子浓度均设为1 mmol/L,实验结果如图8所示,Mn2+、Ba2+和Ca2+对该菌株所产粗蛋白酶的酶活力均有较高的激活作用,其中Mn2+的激活作用最大,Fe2+和Zn2+对粗蛋白酶活性有明显抑制作用。

图6 温度对粗蛋白酶活性的影响Fig.6 Effect of temperature on crude protease activity

图7 热稳定性Fig.7 Thermal stability

图8 金属离子对粗蛋白酶活性的影响Fig.8 Effect of metal ions on crude protease activity
3 结语
本研究从鱿鱼中分离筛选高产蛋白酶菌株,通过脱脂牛奶平板培养基和干酪素平板培养基初筛得到16株产蛋白酶菌株,结合福林酚法测定菌株的产蛋白酶活力,复筛得到10株产酶活力较高的代表菌株。经PCR鉴定,发现代表菌株属于芽孢杆菌属 (Bacillussp.)、普罗威登斯菌属(Providenciasp.)、假单胞菌属(Pseudomonassp.)。其中以 SW5 菌株产蛋白酶活力最高,粗酶活力可达257.67 U/mL,经鉴定为甲基营养型芽孢杆菌(Bacillus methylotrophicusKC790303.1)。对SW5菌株的产酶特性进行初步研究发现其产粗蛋白酶的最适pH为6.0~8.0,在 pH 8.0~10.0 时酶较稳定;最适温度为40℃,在30~50℃时具有较高酶活性,在35℃下保温60 min后,仍保留80%以上的活性;金属离子试验发现终离子浓度为1 mmol/L时Mn2+、Ba2+和Ca2+对该菌株所产蛋白酶的酶活力均有较高的激活作用,Fe2+和Zn2+对其有明显抑制作用。鱼酱油发酵的温度为40±5℃,该菌株所产蛋白酶能够适应其发酵温度,可以作为外源酶添加到鱼酱油发酵中,通过分解鱼肉蛋白影响其发酵液pH及风味,为鱼酱油发酵提供一种新的蛋白酶来源。
