MicroRNA-29a 在结直肠癌组织中的表达及意义
2019-04-25蔡锐文梁伟成黄冀华梁华艳黄开劲邓波
蔡锐文,梁伟成,黄冀华,梁华艳,黄开劲,邓波
(广东省高州市人民医院 1.胃肠外科,2.检验科,广东 高州 525200)
微RNA(MicroRNA,miR)作为广泛存在于生物体内 的短链核糖核酸(ribonucleic acid,RNA),可通过影响 靶基因转录或翻译而参与多种生理病理过程[1],同时,在多种恶性肿瘤发生、进展中发挥重要作用[2]。miR-29a 作为miR-29 家族重要成员,与乳腺癌[3]、胶质瘤等[4]恶性肿瘤发生、进展密切相关。本研究拟分析miR-29a 在结直肠癌组织中表达,采用反义寡核苷酸(antisense oligonucleotides,ASO)特异性抑制结直肠癌LoVo 细胞中miR-29a 表达,观察其对细胞增殖、凋亡的影响。
1 资料与方法
1.1 一般研究
1.1.1 临床资料 选取2013年3月—2016年4月在广东省高州市人民医院治疗的结直肠癌患者195 例,术前均未行放化疗治疗,均经术后病理检查证实。其中,男性109 例,女性86 例;年龄33 ~82 岁,平均(60.1±12.8)岁;肿瘤部位:结肠91 例,直肠104 例;TNM 分期:Ⅰ期35 例,Ⅱ期64 例,Ⅲ期81 例,Ⅳ期15 例;分化程度:低分化17 例,中分化166 例,高分化12 例。所有患者均于术中留取结直肠癌及距离肿瘤边缘>4 cm 处的癌旁组织,生理盐水清洗后置于液氮中,置入-80℃冰箱冷冻保存。研究经本院医学伦理委员会批准,所有患者均行知情同意。
1.1.2 主要试剂和设备 人结直肠癌LoVo 细胞株购自中科院上海生命科学研究院细胞库,Trizol 总RNA 提取试剂盒、LipofectamineTM2000 转染试剂盒、Matrigel 胶购自美国Invitrogen 公司,DMEM 培养基、胎牛血清、胰酶购自美国Gibco 公司,逆转录和聚合酶链式反应(polymerase chain reaction,PCR)试剂盒购自日本TaKaRa 公司,MTT 试剂盒、DMSO 购自美国Sigma 公司,Transwell 小室购自德国Millipore 公司。
1.2 方法
1.2.1 利用实时荧光定量聚合酶链反应(qRT-PCR) 检测结直肠癌和癌旁组织中miR-29a 表达 取结直肠癌和癌旁组织,研磨后,加入细胞裂解液,用Trizol总RNA 提取试剂盒提取细胞中总miR,利用紫外分光光度计检测总miR 纯度,以A260/A280 在1.80 ~2.10作为合格样品。将总miR 逆转录为模板链cDNA,利用PCR 试剂盒进行PCR,引物序列为:正向5'-CG GCGGTAGCACCATCTGAAAT-3',反向5'-CCAGTGCA GGGTCCGAGGTA-3';U6 引物:正向5'-GGAGAGTGT TTCCTCGTCCC-3',反向5'-ATGAAGGGGTCGTTGATG GC-3'。PCR 反应条件:95℃预变性2 min,94℃变性30 s,54℃退火30 s,73℃延伸30 s,重复循环38 次,每个样品设3 个平行复孔。用2-△△Ct法计算结直肠癌和癌旁组织中miR-29a 相对表达量[5-6]。
1.2.2 细胞培养及分组处理 将LoVo 细胞株置于含10%胎牛血清的DMEM 培养基中,于含5%二氧化碳CO2的37℃恒温培养箱中常规培养。待细胞对数生长时,胰酶消化后,接种于6 孔板中,调整细胞密度为2×105个/孔,继续恒温培养,待细胞融合度在80%左右时,对细胞进行分组转染:①ASO-miR-29a 组:利用LipofectamineTM2000 转染试剂盒转染miR-29a 的ASO 序列5'-ACTGATTTCTTTT GGTGTTCAG-3';②ASO-对照序列组:5'-TCATTGGC ATGTACCATGCAGCT-3';③空白对照组:不作任何处理。转染后各组细胞继续恒温培养,完成后续实验。
1.2.3 qRT-PCR检 测 各 组 细 胞 中miR-29a 表 达 取各转染组转染后培养48 h 细胞,加入细胞裂解液,其余步骤同1.2.1。
1.2.4 MTT 法检测各组细胞增殖能力 取各组细胞,胰酶消化后,离心取细胞沉淀,重悬后调整细胞密度为2×104个/ml,各取100 μl 加入96 孔板,各组均设6 个平行反应复孔,于含5% CO2的恒温培养箱中培养,分别于转染后12、24、48、72 和96 h 时,将20 μl 的MTT 液加入各孔,孵育4 h,将孔内培养液去除,各加入150 μl 的DMSO 液,振荡15 ~20 min 待沉淀完全溶解后,利用酶标仪取570 nm 处对各孔吸光度(A)值进行检测[7]。
1.2.5 Transwell 小室检测各组细胞迁移能力 取各组转染后培养48 h 细胞,胰酶消化后收集细胞,利用无血清培养液制备单细胞悬液,调整细胞密度为2×105个/ml。取200 μl 单细胞悬液置于Transwell 小室上室,将800μl 的含20%胎牛血清的培养液加入小室下室,于含5% CO2的培养箱中37℃恒温培养24 h。将小室取出后,用PBS 冲洗3 次,用棉签轻轻将小室上散落细胞擦除,多聚甲醛室温下固定15 min,1%结晶紫染色15 min,PBS 冲洗3 次,用倒置显微镜观察,拍照,计数穿膜细胞数[7]。
1.2.6 Transwell 小室检测各组细胞侵袭能力 取Matrigel 胶预先平铺于Transwell 小室上室,风干后以备用。其余步骤同1.2.5。
1.3 统计学方法
数据分析采用SPSS 21.0 统计软件,计量资料以均数±标准差(±s)表示,比较采用t检验、方差分析或重复测量设计的方差分析,两两比较采用LSD-t检验,影响因素分析采用多元线性回归分析,P<0.05为差异有统计学意义。
2 结果
2.1 结直肠癌和癌旁组织中miR-29a 表达比较
结直肠癌组织中miR-29a 相对表达量为(1.93± 0.19),癌旁组织中miR-29a 相对表达量为(1.26± 0.12),经t检验,差异有统计学意义(t=41.596,P= 0.000)。
2.2 结直肠癌组织中miR-29a 表达与临床病理特征之间的关系
不同年龄、性别、肿瘤部位、肿瘤大小和分化程度结直肠癌组织中miR-29a 相对表达量差异无统计学意义(P>0.05),而TNM 分期Ⅲ、Ⅳ期和发生淋巴结转移结直肠癌组织中miR-29a 相对表达量增加,差异有统计学意义(P<0.05),TNM 分期和淋巴结转移是影响结直肠癌组织中miR-29a 表达的因素。见表1。
2.3 结直肠癌组织中miR-29a 表达影响因素分析
多元线性回归分析结果显示,TNM 分期和淋巴结转移是影响结直肠癌组织中miR-29a 表达的因素(P<0.05)。见表2。
2.4 各组细胞中miR-29a 表达比较
3 组细胞中miR-29a 相对表达量分别为(1.14± 0.07)、(1.84±0.12)和(1.82±0.21),经方差分析,差异有统计学意义(F=45.940,P=0.000),两两比较,ASO-miR-29a 组细胞中miR-29a 相对表达量低于ASO-对照序列组和空白对照组(P<0.05)。
2.5 各组细胞增殖能力比较
3 组细胞24、48、72 和96h 时A 值比较,采用重复测量设计的方差分析,结果:①不同时间点的A 值有差异(F=46.351,P=0.000)。②3 组时间A 值有差异(F=102.861,P=0.000),ASO-miR-29a 组与ASO-对照序列组和空白对照组相比A 值比较低,细胞增殖被抑制。③3 组的A 值变化趋势有差异(F=21.573,P=0.000)。见表3。
表1 不同因素对结直肠癌组织中miR-29a 表达水平的影响 (±s)
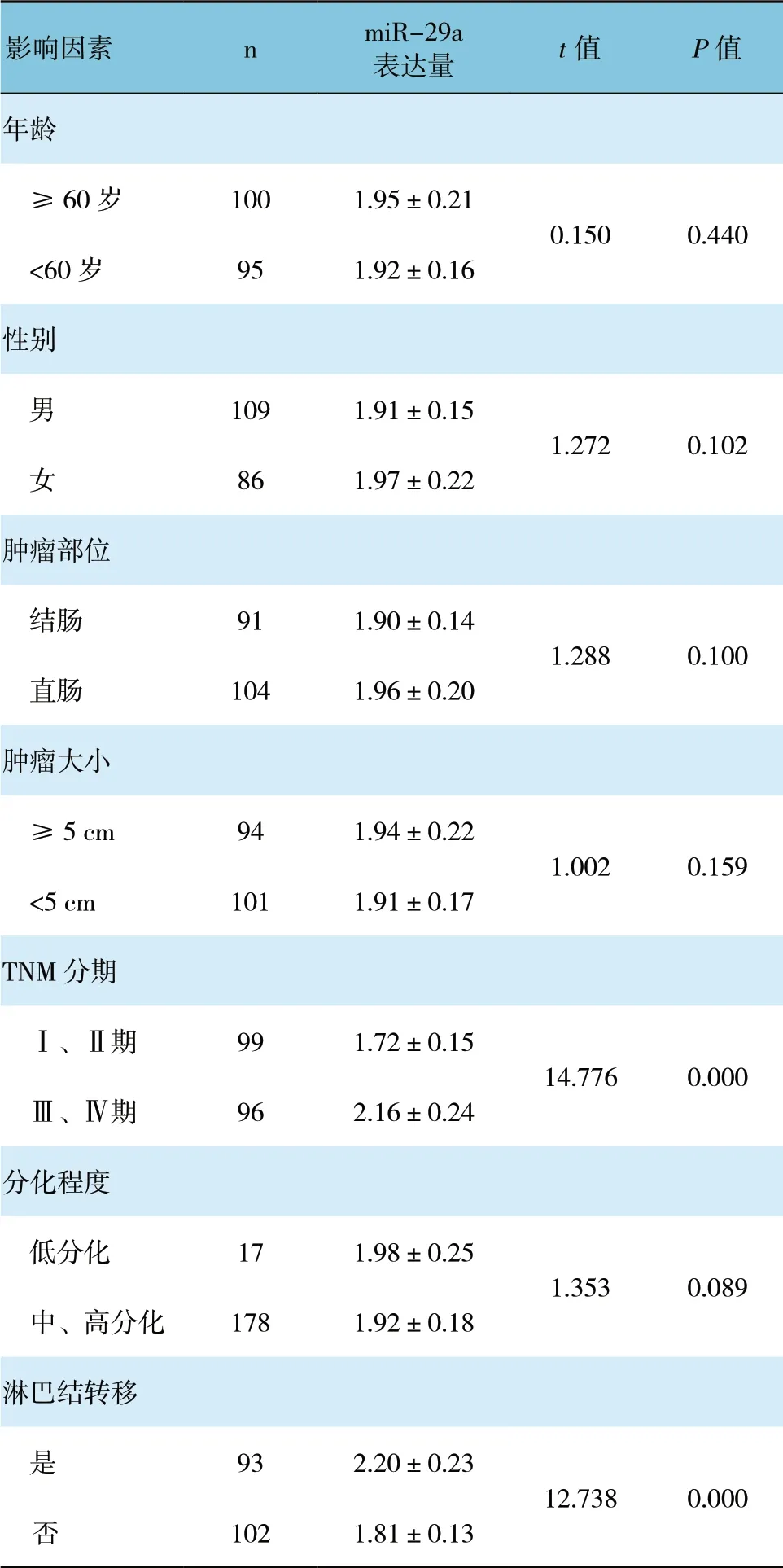
表1 不同因素对结直肠癌组织中miR-29a 表达水平的影响 (±s)
影响因素 n miR-29a 表达量 t 值 P 值年龄 ≥60 岁 100 1.95±0.21 0.150 0.440<60 岁 95 1.92±0.16性别 男 109 1.91±0.15 1.272 0.102 女 86 1.97±0.22肿瘤部位 结肠 91 1.90±0.14 1.288 0.100 直肠 104 1.96±0.20肿瘤大小 ≥5 cm 94 1.94±0.22 1.002 0.159<5 cm 101 1.91±0.17 TNM 分期 Ⅰ、Ⅱ期 99 1.72±0.15 14.776 0.000 Ⅲ、Ⅳ期 96 2.16±0.24分化程度 低分化 17 1.98±0.25 1.353 0.089 中、高分化 178 1.92±0.18淋巴结转移 是 93 2.20±0.23 12.738 0.000 否 102 1.81±0.13
2.6 各组细胞迁移和侵袭能力比较
3 组迁移细胞数和侵袭细胞数差异有统计学意义(P<0.05),与ASO-对照序列组和空白对照组比较,ASO-miR-29a 组迁移细胞数和侵袭细胞数均减少,差异有统计学意义(P<0.05)。见图1、2 和表4。
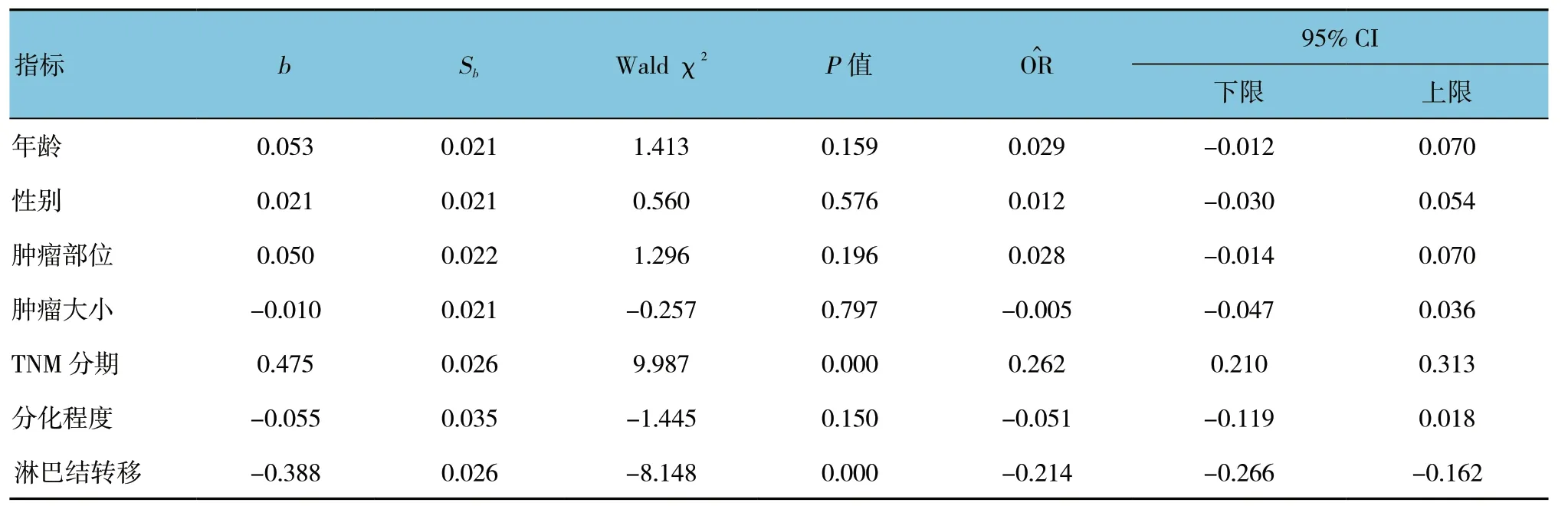
表2 结直肠癌组织中miR-29a 表达影响因素的多元线性回归分析
表3 各组细胞增殖能力比较 (±s)

表3 各组细胞增殖能力比较 (±s)
组别 12 h 24 h 48 h 72 h 96 h ASO-miRNA-29a 组 0.15±0.04 0.26±0.05 0.31±0.05 0.41±0.14 0.57±0.10 ASO-对照序列组 0.17±0.06 0.40±0.07 0.48±0.05 0.64±0.12 0.80±0.12空白对照组 0.18±0.02 0.41±0.12 0.49±0.06 0.60±0.10 0.87±0.14

图1 各组细胞迁移能力比较 (结晶紫×400)

图2 各组细胞侵袭能力比较 (结晶紫×400)
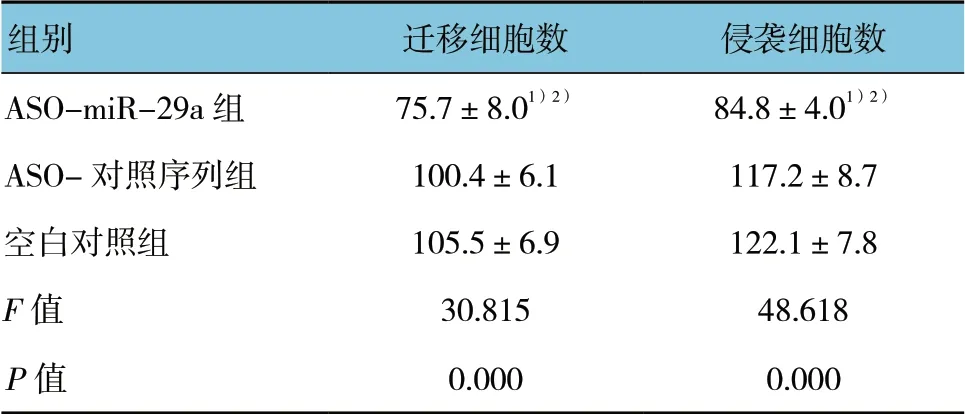
表4 各组细胞迁移和侵袭能力比较 (个,x±s)
3 讨论
结直肠癌作为消化道发病率仅次于胃癌的恶性肿瘤,是我国三大癌症之一,目前尚无特效的治疗手段,多数患者预后较差,给我国人群及社会带来沉重的疾病负担[8]。近年来研究发现[9],miR 可通过发挥类似癌基因或抑癌基因的作用而参与肿瘤发生、进展过程。亦有研究指出[10],miR 参与调控肿瘤细胞增殖、凋亡、迁移、侵袭等过程。有研究指出[11],结直肠癌患者外周血中多种miR 出现表达异常,其靶基因可能在结直肠癌生长、转移等过程中发挥关键性作用。miR-29a 位于人染色体7q32 上,可通过发挥促癌或抑癌基因功能而参与多种肿瘤发生[12-13]。本研究结果显示,结直肠癌组织中miR-29a 相对表达量高于癌旁组织,说明miR-29a 在结直肠癌组织中呈高表达,可能参与了结直肠癌发生过程。
本研究结果显示,TNM 分期和淋巴结转移是结直肠癌组织中miR-29a 相对表达量的影响因素,TNM分期Ⅲ、Ⅳ期、发生淋巴结转移的结直肠癌组织中表达量增加,进一步说明miR-29a 可能参与结直肠癌病程进展过程。为进一步探讨miR-29a 在结直肠癌发生、进展中的作用,本研究利用ASO 技术特异性抑制结直肠癌LoVo 细胞中miR-29a 表达,结果显示,ASO-miR-29a 组细胞中miR-29a 相对表达量低于ASO-对照序列组和空白对照组,说明LoVo 细胞中miR-29a 基因表达被抑制。MTT 实验结果显示,ASO-miR-29a 组与ASO-对照序列组和空白对照组相比A 值降低,说明特异性抑制miR-29a 基因表达可减少LoVo 细胞增殖,提示miR-29a 可能与结直肠癌细胞增殖有关。本研究结果显示,与ASO-对照序列组和空白对照组比较,ASO-miR-29a 组迁移细胞数和侵袭细胞数均减少,说明特异性抑制miR-29a 基因表达可有效减少LoVo 细胞迁移和侵袭能力,提示miR-29a 可能参与结直肠癌细胞迁移和侵袭过程。
目前,miR-29a 已证实与多种恶性肿瘤发生、进展有关,且参与了肿瘤多药耐药[14],为肿瘤期诊断、分期及预后判定提供了可靠生物学标志物,有望为包括结直肠癌在内的多种恶性肿瘤的靶向治疗提供新的靶点,但鉴于肿瘤发生涉及多基因、多步骤,miR-29a在肿瘤发生、进展中的具体作用机制尚待进一步开展后续研究以明确。
综上所述,miR-29a 在结直肠癌组织中呈高表达,参与结直肠癌发生、进展过程,特异性抑制结直肠癌细胞中miR-29a 表达可减少细胞增殖,抑制细胞迁移和侵袭能力。
