SIRT1 基因在衰老雌鼠卵巢中的表达变化*
2019-04-25王飞清李艳菊陶奕汐杨华黄璜王琨刘洋
王飞清,李艳菊,陶奕汐,杨华,黄璜,王琨,刘洋
(1.贵阳中医学院第一附属医院 检验科,贵州 贵阳 550001;2.贵州医科大学附属医院 血液科,贵州 贵阳 550004)
衰老是机体在生命活动过程中一种渐进性的组织、器官退行性改变,其发生机制复杂,涉及多个衰老基因的异常调控。目前研究认为,衰老的病理生理学机制主要是随着年龄增长导致机体损伤的累积所致[1-2]。SIRT1是一种长寿基因,该基因的缺失将导致机体提前衰老,其参与大量与衰老相关的生理病理过程[3]。研究发现,SIRT1具有修复细胞的DNA 损伤、延长寿命、抗氧化等作用,在氧化应激条件下维持细胞存活并达到延长细胞寿命的效果[4-5]。机体中卵巢是较早发生衰老的器官之一,有研究发现卵泡闭锁是卵巢功能减退的的直接因素,在该过程中卵巢细胞凋亡发挥重要作用[6]。本实验复制了自然衰老雌鼠模型,通过观察雌鼠体重、氧化水平、性激素水平的变化,并进一步检测卵巢SIRT1基因表达情况,解析SIRT1在卵巢功能中的作用。这将为缓解雌性卵巢衰老提出新的思路和方法,为临床卵巢功能保护和生殖能力改善的药物开发提供有实用价值的科学依据。
1 材料与方法
1.1 材料
1.1.1 动物 30 只5 周清洁级SD 雌性大鼠由贵州医科大学动物实验中心提供,批号为[SCXK(黔)2012-0001])。
1.1.2 主要仪器和试剂 T5000Y 型电子天平(美国双杰兄弟有限公司常熟双杰测试仪器厂),FA1204B分析天平(上海精科天美科学仪器有限公司),Olympus 双目光学显微镜(奥林巴斯光学工业株式会社),TGL-16M 高速台式冷冻离心机(长沙湘仪离心机仪器有限公司),-80℃冰箱(日本Sanyo 公司)。谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、总抗氧化能力(total-anti-oxidation capacity,T-AOC)试剂盒(南京建成生物工程研究所),SIRT1 抗体(武汉博士德生物工程有限公司),促黄体激素(luteotropic hormone,LH)、促卵泡激素(follicle-stimulating hormone,FSH)、雌二醇(Estradiol,E2)试剂盒(上海联科生物技术有限公司),实时荧光定量聚合酶链反 应(quantitative real-time polymerase chain reaction,qRT-PCR)(北京全式金生物技术有限公司),Trizol试剂盒(大连宝生物工程有限公司)。引物序列由Primer 3 设计,上海英俊公司合成。
1.2 方法
1.2.1 动物处理 雌鼠自由饮用自来水和饲料,根据医用实验动物学显示[7],大鼠在4 周相当于3 ~5 岁,12 周相当于10 ~12 岁,24 周相当于18 ~20 岁,48 周 相当于35 ~40 岁,72 周相当于50 ~55 岁,72 周确定为大鼠老年期。因此本实验将雌鼠分为6、12、24、48 及72 周饲养,于不同时间段用10%水合氯醛麻醉,股动脉取血处死6 只雌鼠。取出卵巢剔除脏器周围脂肪和结缔组织,滤纸吸干表面血液,将一侧卵巢迅速分装至-80℃冰箱冷冻保存备用,另一侧卵巢用多聚甲醛溶液固定。
1.2.2 体重测量 每3天早上(8:00 ~10:00)用电子天平对雌鼠进行称重并记录。
1.2.3 氧化水平检测 股动脉取血,3 500 r/min 离心10 min 分装血清低温保存备用。采用二硫代二硝基苯甲酸法检测GSH-Px 活性;采用Fe3+还原法检测T-AOC,严格按照试剂盒说明书步骤完成实验。
1.2.4 性激素检测 股动脉取血,用黄色分离胶促凝管收集血液8 ~10ml,3500r/min 离心10min,分离血清于Epp 管中分装,放于-20℃的冰箱中保存备用。血清放37℃电热恒温水浴锅中解冻,采用ELISA 法检测血清中的LH、FSH、E2水平,严格按照试剂盒说明书步骤完成实验。
1.2.5 qRT-PCR 检测卵巢组织中SIRT1 mRNA 表达 取1 g 卵巢组织加入Trizol 试剂,根据试剂盒说明书操作提取卵巢组织总RNA,进行基因片段扩增并定量。cDNA 反应体系:总RNA 样品为2.5 μl,Random primer 1 μl,2×ES Reaction Mix 10 μl,Enzyme Mix 1 μl,gDNA Remover 1 μl,加无酶水至总体积20 μl。PCR 反应体系:各PCR 反应管中所加模板RNA 的量约为1.8 μl,正反向引物各0.5 μl,Green qPCR Super Mix 10 μl,加无酶水至总体积20 μl。反应条件:94℃预变性30 s,94℃变性5 s,45℃退火15 s,72℃ 延伸10 s,共45 个循环。SIRT1PCR 扩增结果通过PCR 仪记录的Ct 值对起始模板相对定量分析。引物序列见表1。

表1 引物序列
1.2.6 免疫组织化学法检测卵巢组织SIRT1 蛋白 处死雌鼠后,迅速取其一侧卵巢,立即放入10%中性甲醛固定液中固定,待固定液浸透后,用锋利的刀片取大小1 mm×1 mm×1 mm 左右的卵巢组织,石蜡包埋,常规切片,免疫组织化学法检测卵巢组织SIRT1 蛋白表达情况。SIRT1 蛋白定位于细胞浆中,阳性细胞胞浆着色呈棕黄色,不显棕黄色者为阴性细胞。在高倍镜下,每张切片随机取5 个视野,计算每个视野下100 个细胞中阳性细胞百分比(阳性细胞数/总细胞数)。
1.2.7 观察卵巢组织病理形态 处死雌鼠后,迅速取下一侧卵巢,经多聚甲醛溶液固定3d 后,常规取材、脱水、石蜡包埋、切片、HE 染色。光学显微镜下观察卵巢组织结构有无形态学改变。
1.3 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准(±s)表示,符合正态分布且方差齐的数据,多组比较采用单因素方差分析,进一步的两两比较采用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 不同时间点雌鼠体重变化
雌鼠体重6、12、24、48 及72 周分别为(178.167± 11.957)、(236.833±14.580)、(303.667±13.171)、(334.850±10.504)及(346.500±5.541)g,随着时间的延长,雌鼠体重逐渐增加(F=223.470,P=0.000),除48 与72 周比较差异无统计学意义(P>0.05),其他时间点两两比较差异均有统计学意义(P<0.05)。见图1。

图1 各时间点大鼠体重变化趋势 (n =6,±s)
2.2 不同时间点雌鼠氧化水平变化
雌 鼠 血 清GSH-Px 在6、12、24、48 及72 周表达水平比较,差异有统计学意义(F=19.471,P=0.000),6、12 及24 周比较,雌鼠血清GSH-Px 差异无统计学意义(P>0.05),48和72周雌鼠血清GSH-Px较6、12 及24 周下降,72 周雌鼠血清GSH-Px 与48 周比较差异有统计学意义(P<0.05)。
雌鼠血清T-AOC 在6、12、24、48 及72 周表达水平比较,差异有统计学意义(F=6.518,P=0.001),6、12 及24 周比较,雌鼠血清T-AOC 差异无统计学意义(P>0.05),48 和72 周雌鼠血清T-AOC 下降较6、12及24 周(P<0.05),且12 与48 周比较,差异有统计学意义(P<0.05),72 周雌鼠血清T-AOC 与6、12 及24 周比较差异有统计学意义(P<0.05)。见表2。
2.3 不同时间点雌鼠性激素变化
雌鼠血清FSH 和LH 在6、12、24、48 及72 周表达水平比较,差异有统计学意义(F=73.421 和28.503,均P=0.000),6、12 及24 周比较,雌鼠血清FSH 和LH 差异无统计学意义(P>0.05),48 和72 周较6、12及24 周升高(P<0.05),且48 与72 周比较,差异有统计学意义(P<0.05)。
表2 不同时间段雌鼠血清GSH-Px 和T-AOC 比较 (n =6,u/ml,±s)

表2 不同时间段雌鼠血清GSH-Px 和T-AOC 比较 (n =6,u/ml,±s)
注:1)与48 周比较,P<0.05;2)与6、12 及24 周比较,P<0.05
时间 GSH-Px T-AOC 6 周 1 147.817±127.535 19.583±1.876 12 周 1 106.050±112.249 20.500±2.1271)24 周 1 180.017±109.772 19.367±2.351 48 周 922.983±100.1872) 17.533±1.226 72 周 714.150±87.4601)2) 15.783±1.1392)
雌鼠血清E2在6、12、24、48 及72 周表达水平比较,差异有统计学意义(F=22.579,P=0.000),6、12 及24 周雌鼠血清E2逐渐升高,差异无统计学意义(P>0.05),48 和72 周雌鼠血清E2逐渐降低,48 周与12 和24 周比较,差异有统计学意义(P<0.05),72 周与各组比较,差异有统计意义(P<0.05)。见表3。
2.4 不同时间点雌鼠卵巢SIRT1 mRNA 和蛋白水平变化
雌鼠 卵 巢SIRT1 mRNA 在6、12、24、48 及72周表达水平比较,差异有统计学意义(F=56.271,P= 0.000),雌鼠卵巢SIRT1mRNA 逐渐降低,24 与6 周比较差异有统计学意义(P<0.05),48 和72 周与各组比较,差异有统计学意义(P<0.05)。见表4。
雌鼠卵巢SIRT1 蛋白在6、12、24、48 及72 周表达水平比较,差异有统计学意义(F=6.556,P= 0.001),48 周与6 和12 周比较差异有统计学意义(P<0.05),72 周与6、12 和24 周比较差异有统计学意义(P<0.05)(见表4)。免疫组织化学结果见图2。
表3 不同时间点雌鼠血清性激素水平比较 (n =6,±s)

表3 不同时间点雌鼠血清性激素水平比较 (n =6,±s)
注:1)与48 周比较,P <0.05;2)与6、12 及24 周比较,P <0.05
时间 FSH/(IU/L) LH/(u/ml) E2/(ng/L)6 周 10.367±1.447 2.917±0.376 135.371±18.284 12 周 10.200±0.815 3.067±0.339 141.765±13.4231)24 周 10.283±1.375 2.633±0.301 144.473±15.351)48 周 14.933±1.1222) 3.667±0.5392) 120.069±17.885 72 周 21.433±1.9761)2) 5.217±0.6941)2) 69.374±14.4311)2)
表4 不同时间点雌鼠SIRT1 mRNA 和蛋白水平比较 (n =6,±s)
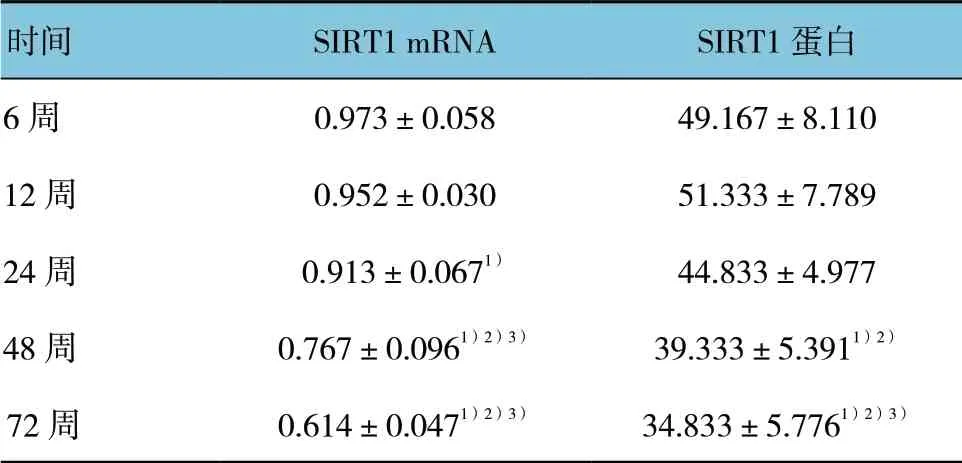
表4 不同时间点雌鼠SIRT1 mRNA 和蛋白水平比较 (n =6,±s)
注:1)与6 周比较,P <0.05;2)与12 周比较,P <0.05; 3)与24 周比较,P <0.05
时间 SIRT1 mRNA SIRT1 蛋白6 周 0.973±0.058 49.167±8.110 12 周 0.952±0.030 51.333±7.789 24 周 0.913±0.0671) 44.833±4.977 48 周 0.767±0.0961)2)3) 39.333±5.3911)2)72 周 0.614±0.0471)2)3) 34.833±5.7761)2)3)

图2 不同时间点雌鼠卵巢SIRT1 表达水平 (HE×200)
2.5 不同时间点雌鼠卵巢组织病理变化
各时间点雌鼠卵巢外观未见萎缩、水肿等病变,卵巢组织色泽正常质软。光学显微镜下6、12 及24 周卵巢组织结构形态未见明显病变,可见各级卵泡,卵泡颗粒细胞形态规则,可见清晰卵丘等结构。随着时间延长,48 周雌鼠卵巢组织与6、12 及24 周比较,闭锁卵泡增多,黄体和各级发育卵泡减少,组织间隙可见少量脂滴。72 周雌鼠卵巢组织闭锁卵泡明显增多,黄体和各级发育卵泡明显减少,卵泡颗粒细胞减少,排列松散,组织间隙可见大量脂滴,呈现明显衰老的特征。见图3。

图3 不同时间点雌鼠卵巢组织病理变化 (HE×200)
3 讨论
衰老是生命运动中不可避免的过程,只是不同个体在不同时期衰老的进程并不相同,环境污染、生活工作压力增加以及生育政策等加速女性的衰老。研究表明,体重增加导致肥胖可影响包括心血管疾病、糖尿病、癌症、代谢紊乱以及生殖功能衰退的风险[8-9]。流行病学调查发现,随着机体衰老,体重增加对女性生殖功能有着不利的影响[10]。根据动物学实试验显示,48周雌鼠进入衰老进程,且72 周确定为大鼠老年期。本实验结果显示,随着饲养时间的延长,雌鼠体重逐渐增加,且48 和72 周雌鼠体重高于其他各组。纵观近一个世纪的衰老研究历程,产生许多有关衰老分子机制的学说,其中,包括经典的氧自由基学说等[11-12]。本实验结果显示,随着饲养时间的延长,雌鼠血清GSH-Px和T-AOC 水平降低,可推断在机体衰老过程中,机体内环境发生了明显变化。
卵巢衰老是自然的生理过程,主要原因在于卵泡的不断消耗引起卵巢储备功能的下降。其机制是卵巢内微环境的改变,导致卵泡质量下降,进一步出现卵巢分泌E2水平下降等一系列表现[13]。现代医学研究表明,雌激素是女性青春魅力的源泉,其含量能促进女性卵泡发育、成熟、排卵,乳腺等女性生殖器官的生长和发育[14-15]。本实验结果显示,随着时间的延长,雌鼠血清E2逐渐降低,此时性腺轴垂体负反馈调节FSH 和LH 水平升高。同时本实验卵巢病理结果进一步显示,雌鼠卵巢组织随着时间延长闭锁卵泡明显增多,黄体和各级发育卵泡水平减少,卵泡颗粒细胞减少,排列松散,组织间隙可见大量脂滴,呈现明显衰老的特征。
衰老是生物机体必然发生的复杂生命现象,整体表现为代谢能力下降、适应能力减退等。近年来抗衰老 基因SIRT1已成为国内外学者研究的热点,SIRT1是调节生物体衰老进程的一个重要基因,在调节基因表达、细胞凋亡、代谢和老化过程中发挥积极作用[16-17]。SIRT1的特殊结构决定它的生物学功能,包括参与基因转录、DNA 复制、损伤修复和代谢调控等一系列的细胞活动,其依赖NAD+的组蛋白去乙酰化酶SIRT1在调节细胞的代谢、分化与衰老等方面都有着关键的影响与作用。SIRT1还与年龄有关的活性氧之间有极重要的关系,两者都依赖于线粒体的代谢来维持其高浓度而发挥作用。国外研究报道,SIRT1基因缺陷小鼠不能生育,同时表现出卵泡发育成熟受抑制以及性成熟推迟[18-19]。本实验结果显示,随着时间延长雌鼠卵巢SIRT1基因和蛋白水平降低,同时性激素分泌明显异常,卵巢呈现明显衰老特征,表明SIRT1在调控哺乳动物生殖系统的生物学功能方面有着不可或缺的作用。
本实验成功复制自然衰老雌鼠模型,表现在衰老雌鼠体重明显增加,抗氧化水平降低加速机体的衰老,卵巢呈现明显衰老症状诱发性激素的异常,且抗衰老基因SIRT1在衰老雌鼠卵巢表达降低,推断SIRT1基因在衰老大鼠卵巢生殖功能异常中发挥重要作用。未来临床利用相关技术激活SIRT1基因活化是否成为延缓卵巢早衰靶点有待进一步研究。
