沉默ADAM17 对HT29 人结肠癌细胞体外侵袭能力的影响及机制探究
2019-04-25张琪杨光华黄志强葛志鹏刘少鹏田炜张国志王长友
张琪,杨光华,黄志强,葛志鹏,刘少鹏,田炜,张国志,王长友
(1.华北理工大学附属医院,河北 唐山 063000;2,华北理工大学 医学实验中心,河北 唐山 063000)
结肠癌是一种常见的消化道恶性肿瘤,我国结肠癌的发病率呈上升且年轻化发展趋势[1-2]。肿瘤坏死因子α 转换酶,又称解聚素-金属蛋白酶17(adisintegrin and metalloprotease 17,ADAM17)[3],有着水解剪切酶类作用,在肿瘤的发生、发展起着重要作用,且对肿瘤患者的生存预后有一定的提示意义[4-5]。恶性侵袭和转移是肿瘤细胞恶性病因的原因之一。因此,本研究通过抑制HT29 人结肠癌细胞ADAM17 的表达,探讨其对HT29 人结肠癌细胞体外侵袭的影响作用及可能机制。
1 材料与方法
1.1 材料
HT29 人结肠癌细胞株(购自中国科学院干细胞库),DMEM 培养基、胎牛血清、胰酶(美国Gibco 公司),Trizol、Go ScriptTM逆 转 录 试 剂 盒、real-time PCR 试剂盒(美国Invitrogen 公司),Transwell 小室、Matrigel胶(美国BD 公司),抗体ADAM17(美国Abcom 公司),磷酸化细胞外调节蛋白激酶(phosphorylation extracellular regulated protein kinases,p-ERK)、细胞外调 节 蛋 白激酶(extracellular regulated protein kinases,ERK)、基质金属蛋白酶-9(matri metalloproteinase-9,MMP-9)及β-actin 抗体(美国Sigma 公司),HR 标记山羊抗兔IgG 二抗、DAB 显影液(上海碧云天生物技术研究所),BCA 蛋白浓度测定试剂盒、RIPA 裂解液、PMSF、SDS-PAGE 凝胶配制试剂盒(北京索莱宝科技有限公司),酶标仪、湿转系统(上海Bio-Rad公司)。
1.2 细胞培养及慢病毒转染
HT29 细胞用含10%胎牛血清(FBS)的DMEM培养基,在5%二氧化碳CO2,37.0 ℃条件孵育箱中 培 养。ADAM17 小 干 扰RNA(ADAM17-shRNA) 由上海吉玛公司合成,序列如下:转染组,5'-GCATCAT GTATCTGAACAACG-3';无意义序列组,5'-TTCTCCG AACGTGTCACGT-3'。
HT-29 细胞的转染组(ADAM17-shRNA)和无意义序列组(nonsense shRNA)根据使用说明书在进行转染时加入5 μg/ml 聚凝胺(Polybrene)。空白对照组加入等量的磷酸盐缓冲液(phosphate buffer saline,PBS),转染后48 h 荧光显微镜下观察转染效率。
1.3 慢病毒沉默ADAM17 表达的检测
根据病毒转染说明书,细胞转染后48 h,收集各组细胞,Trizol 法提取RNA。通过Go ScriptTM逆转录试剂盒将RNA 逆转录为cDNA。然后进行实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)。引物序列设计如下:ADAM17 正向引物:5'-ATCAAACCTTTCCTG CG-3',反向引物:5'-CAAACCCATCCTCGTCCA-3';GAPDH正向引物:5'-GAAGGTGAAGGTCGGAGTC-3',反向引物:5'-GAAGATGGTGATGGGATTTC-3。
PCR 仪器进行以下循环:95℃变性2 min,45℃退火30 s,60℃延伸60 s,共40 个循环。根据qRTPCR 体系参照GAPDH 做为内参的表达水平来检测HT29 结肠癌细胞的ADAM17 mRNA 表达水平。每组设2 个副孔,平行实验3 次。采用相对定量法(CT 法)分析所得数据,ADAM17 shRNA 转染后细胞mRNA 相对表达量=2-△△Ct。
1.4 细胞迁移能力检测
利用单层细胞划痕损伤修复实验检测细胞迁移能力,细胞转染后48 h,HT29 细胞在对数生长阶段制备成单细胞悬液,按照转染组、无意义序列组和空白对照组以每孔1×105个接种于6 孔板上,培养12 h使形成单层细胞。用200 μl 移液枪枪头在单层细胞上水平划出一道痕迹,用PBS 清洗3 次,加入含有10% FBS的DMEM培养基 37℃培养24 h。吸去培养液,用PBS 清洗3 次后,在倒置显微镜下观察并拍照记录。Image J 软件分析迁移面积。实验均重复进行3 次。
1.5 Transwell 体外侵袭实验
通过观察穿过Matrigel 胶的细胞数量检测不同处理对于结肠癌细胞侵袭能力的影响。HT29 细胞在对数生长阶段用不含有FBS 的培养基饥饿培养12 h,以同步化细胞,然后制备成细胞悬液。将Matrigel 胶与DMEM 按照1 ∶8 稀释,取出70 μl 覆盖在Transwell小室底部膜的上室面,置于37℃下30 min,使Matrigel聚合成凝胶。按照空白对照组,无意义序列组和转染组以每孔1×104个,体积为200 μl 的细胞悬液接种于Transwell 小室的上室。下室加入750 μl 含FBS的DMEM 培养基。培养箱中培养24 h。去掉上室的Matrigel 胶,4%甲醛固定液中30 min,苏木精-伊红染色1 min 后PBS 冲洗3 次,显微镜下随机选取3 个视野进行细胞计数。重复进行3 次独立操作加以验证。
1.6 Western blotting 检测相关蛋白表达
取转染后48 h 各组细胞,RIPA 裂解液裂解,离心收集蛋白。BCA 法定量总蛋白,加入等体积2×蛋白上样缓冲液后100℃变性5 min,置入-80℃冰箱冷冻保存备用。进行SDS-PAGE 蛋白电泳,再分别进行转膜(90 V,90 min),10%脱脂奶封闭,一抗孵育过夜(1 ∶1 000),二抗(1 ∶1 000)37℃孵育2 h,上机荧光显色。Image J 软件分析灰度值。相关蛋白表达量计算=(所测蛋白灰度值/内参灰度值)×100%。
1.7 统计学方法
数据分析采用SPSS 19.0 统计软件,计量资料以均数±标准差(±s)表示,比较采用方差分析,两两比较采用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 ADAM17-shRNA 转染HT29 人结肠癌细胞情况
转染效率为90%以上的感染复数(multiplicity of infection,MOI)值为100,体外转染48h,荧光显微镜下观察,根据荧光强度和荧光数判断转染情况,可见转染效率90%以上。见图1。
2.2 转染细胞后ADAM17 的表达情况
空白对照组mRNA 表达量分析系统设定恒定为1,转染组相对表达量为(0.104±0.013),无意义序列组为(1.003±0.036),经方差分析,差异有统计学意义(F=1649.515,P=0.000),转染组ADAM17 mRNA 的表达被抑制且低于空白对照组和无意义序列组(P<0.05)。空白对照组和无意义序列组ADAM17 mRNA 表达差异无统计学意义(P>0.05)。Western blotting 结果同样证实慢病毒转染后ADAM17 表达被抑制。见图2。
2.3 单层细胞划痕损伤修复情况
24 h 后,空白对照组(0.646±0.022)、无意义序列组(0.671±0.027)和转染组(0.986±0.032)的划痕间距相对比,经方差分析,差异有统计学意义(F= 10.176,P=0.012),沉默ADAM17 后HT29 细胞的迁移速度均慢于空白对照组和无意义序列组的细胞(P<0.05),空白对照组和无意义序列组的细胞迁移能力差异无统计学意义(P>0.05)。见图3。
2.4 转染ADAM17 后细胞体外侵袭能力变化情况
空白对照组和无意义序列组可观察到穿过Matrigel 胶到达下室的肿瘤细胞多于转染组。各组的侵袭细胞数分别为(151.004±5.025)、(147.113± 6.333)及(52.002±5.196)个/视野。经方差分析,差异有统计学意义(F=136.936,P=0.000),与空白对照组比较,无意义序列组到达下室的细胞数量差异无统计学意义(P>0.05)。但与空白对照组和无意义序列组比较,转染组细胞到达下室的HT29 人结肠癌细胞数量减少很多,差异有统计学意义(P<0.05)。见图4。
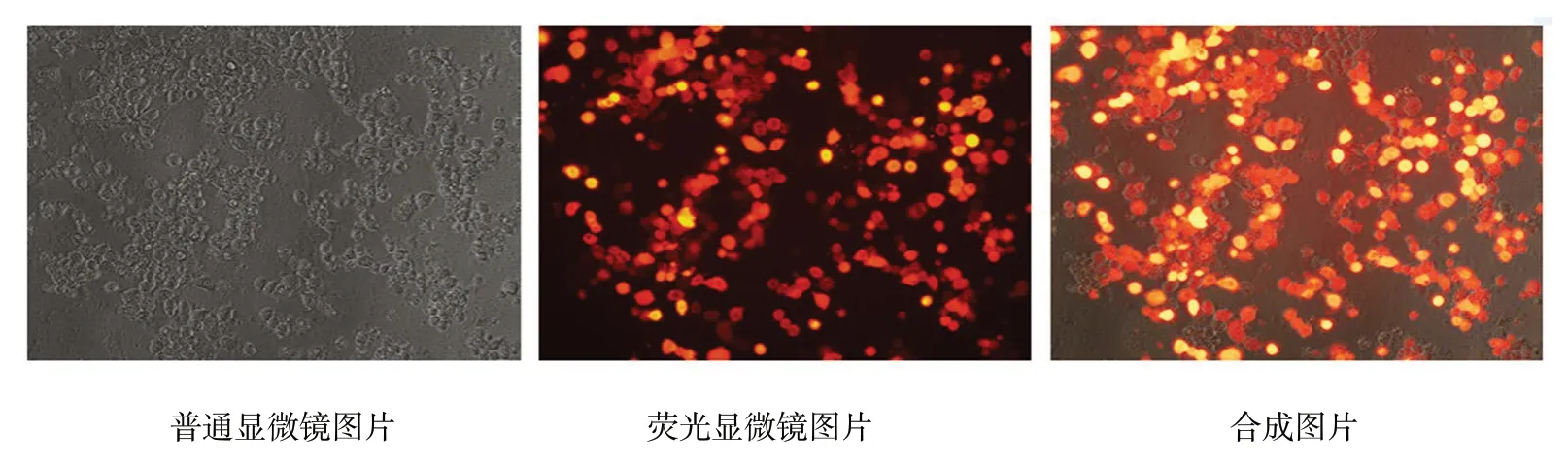
图1 ADAM17 慢病毒转染HT29 人结肠癌细胞48 h 后的转染情况 (×200)

图2 转染后各组ADAM17 mRNA 及ADAM17 蛋白表达情况
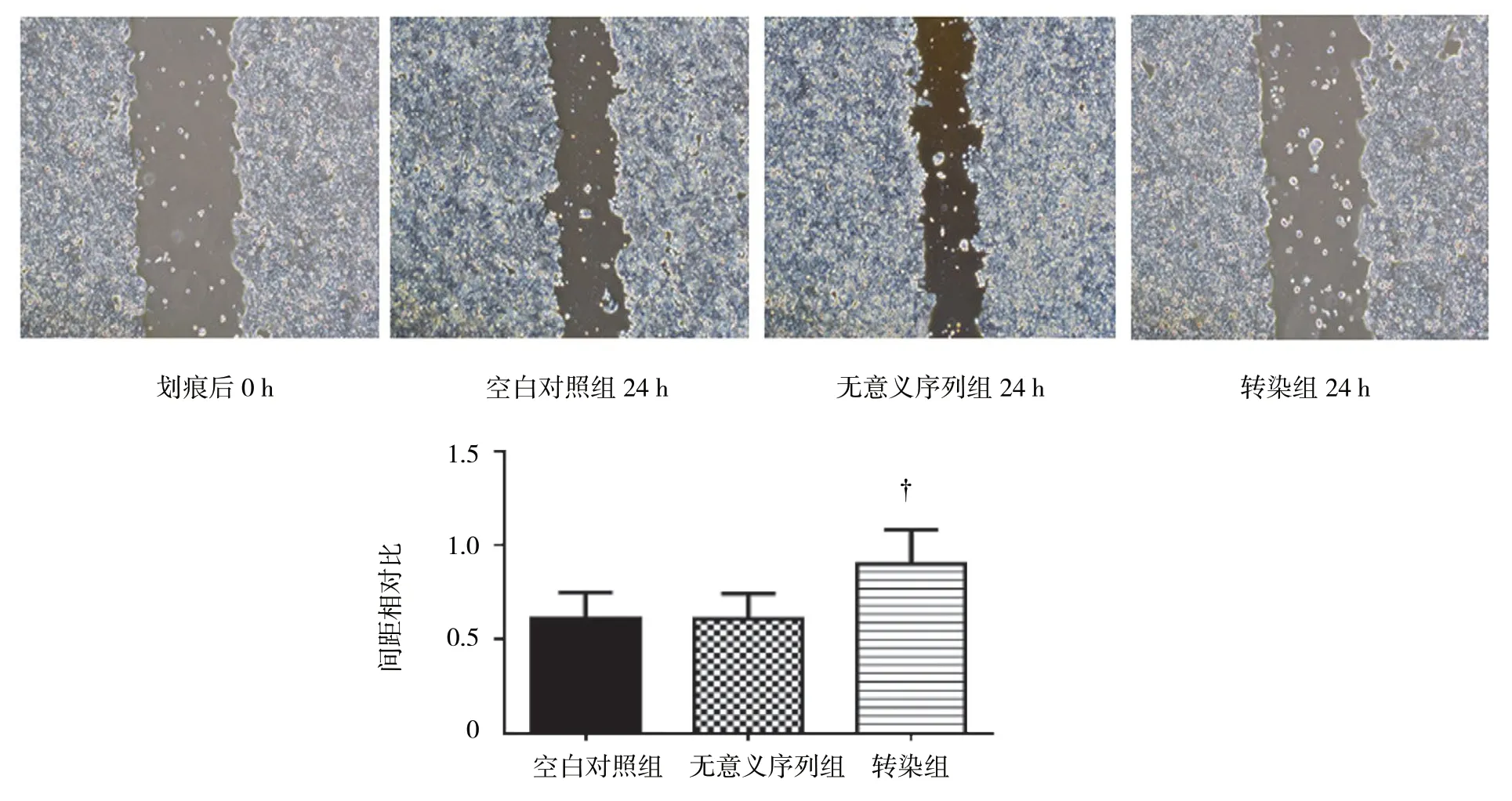
图3 沉默ADAM17 后HT29 人结肠癌细胞迁移能力变化情况 (×100)

图4 沉默ADAM17 后HT29 人结肠癌细胞侵袭能力变化情况 (×100)
2.5 沉默ADAM17 后MMP-9,ERK 表达情况
沉默ADAM17 蛋白表达后,空白对照组、无意义序列组、转染组MMP-9 的表达分别为(0.903± 0.104)、(0.878±0.121)及(0.151±0.102),经方差分析,差异有统计学意义(F=47.172,P=0.000),进一步检测ERK1/2 通路,结果显示,p-ERK1/2 表达同样发生下调,空白对照组、无意义序列组、转染组p-ERK1/2 的表达分别为(0.656±0.141)、(0.647± 0.133)和(0.333±0.102),经方差分析,差异有统计学意义(F=6.130,P=0.035)。沉默ADAM17 后,转染组MMP9 和p-ERK1/2 的表达均低于空白对照组和无意义序列组(P<0.05),空白对照组和无意义序列组的MMP9 和p-ERK1/2 的表达差异无统计学意义(P>0.05)。见图5。
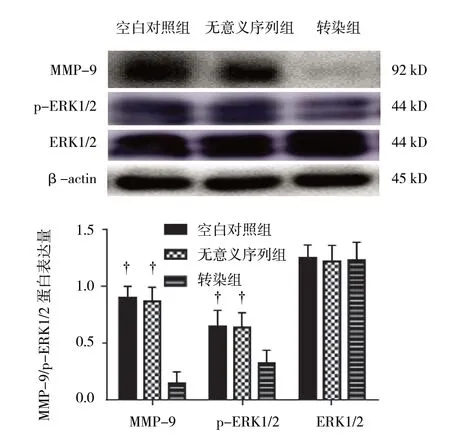
图5 沉默ADAM17 后MMP-9 和ERK1/2 蛋白的表达
3 讨论
结肠癌是一种由遗传、饮食、环境、习惯等多因素共同作用的肠道恶性肿瘤[6],近年来,由于饮食结构的改变,膳食纤维等摄入减少,结肠癌在我国的发病率也呈逐年上升趋势[1]。由于缺乏相关预防保健知识,我国大多数结肠癌患者在发现时已处于疾病中晚期。目前,对结肠癌的治疗依然是以手术切除为主,辅以同步放化疗及靶向治疗和生物治疗。但是人们现在的目光越来越集中在基于特定基因或功能蛋白的靶向治疗上[7]。
ADAM17 是一种具有蛋白水解,活化配体,释放生物活性因子功能的前体蛋白[8]。研究报道指出,ADAM17 在胃癌,乳腺癌等多种恶性肿瘤中呈异常高表达状态[5,9]。同样,也有报道指出,ADAM17 在结肠癌组织中也呈异常高表达状态,并且,这种高表达状态与患者出现肿瘤转移,复发及预后密切相关[10-11]。有研究报道指出,ADAM17 可以通过激活EGFR/MEK/ERK 通路调控细胞生物学行为[12]。
不断发生的远处转移和局部组织侵袭是肿瘤恶性病因的原因之一,也是肿瘤患者治疗失败甚至死亡的原因之一。因此,阻止肿瘤的远处复发转移和局部继续浸润是目前许多肿瘤药物的研究重点。肿瘤细胞的迁移侵袭能力的前提条件是对细胞外基质的降解,MMP-9 被证实在多种恶性肿瘤中呈高表达状态,与患者预后呈负相关[13]。并且MMP-9 的高表达与肿瘤细胞的迁移和侵袭能力呈正相关[14-15]。MMP-9 可以通过降解细胞外基质使细胞穿透[16]。同时,MMP-9 的活化依赖于ERK 信号通路的激活[17]。在本实验中,在沉默ADAM17 的表达后,MMP-9 的表达被下调,说明沉默ADAM17 可以通过下调MMP-9 的表达,从而影响HT29 人结肠癌细胞的迁移侵袭能力。
ERK 是决定细胞命运的关键基因,包括ERK1 和ERK2,在受激活磷酸化后,可以调节细胞的代谢和功能,并产生相应的生物学效应[18]。p-ERK1/2 可以作用于多种细胞内因子最终促使癌基因的表达。各种外界的不同刺激以及不同强度的刺激都可以促使ERK1/2 不同程度的激活,在细胞迁移和黏附中发挥重要作用,从而增强细胞的运动和黏附能力[19],促使细胞在细胞外基质中移动[20-21]。在本实验中,进一步检测ERK 信号通路发现,沉默ADAM17 后,p-ERK1/2的表达被下调,说明沉默ADAM17 可以降低ERK1/2信号通路的激活。
本研究结果显示,ADAM17 能够通过ERK 信号转导通路调控MMP-9 的表达,进而影响细胞的迁移侵袭能力,实现对HT29 人结肠癌细胞增殖迁移侵袭调控的作用,但ERK 通路可能不是其调控肿瘤细胞迁移侵袭的唯一信号通路,其对细胞行为功能的响和具体作用机制需后续实验进一步探究。
