山东省一例山羊伪狂犬病的病原分离鉴定
2019-04-24郑勤琴吴发兴李晓成
郑勤琴,吴发兴,刘 爽,段 纲,李晓成
(1. 云南农业大学,云南昆明 650201;2. 中国动物卫生与流行病学中心,山东青岛 266032)
伪狂犬病(Pseudorabies,PR)是由伪狂犬病毒(Pseudorabies virus,PRV)引起的多种动物共患传染病[1],主要感染猪。自然环境下,牛、绵羊、山羊、猫、犬等家养和野生哺乳动物,甚至部分鸟类都对PRV易感。病猪和鼠是PR最主要的传染源,犬、猫等动物为终末宿主[2]。PRV属双链DNA病毒,是疱疹病毒科α疱疹病毒亚科成员[3]。1902年Aujeszky首先发现该病毒,1934年Sabin、Wrght确认其为疱疹病毒[4-5]。美国、部分欧洲国家已宣布消灭该病。但在全球其他多数养猪国家或地区仍有该病发生[6]。1947年,该病在我国首次发生,目前呈地方性流行,危害我国养猪业,对牛、羊、犬及经济动物养殖亦有威胁[7-8]。
2011年以来,我国多地猪场陆续出现仔猪“腹泻”疫情,部分猪场发病猪还伴有神经症状。经鉴定,致病原主要为猪流行性腹泻病毒和PRV[9]。据报道,犬、羊、水貂,甚至公园饲养的美洲虎也可感染PRV,并且发病,甚至死亡[10]。2017年4月,山东省某羊场的个别山羊出现了依树磨蹭、磨齿、间歇性烦躁不安等异常表现,2~3 d后出现站立不稳、震颤、流涎等神经症状,随后突然死亡,当地实验室诊断为疑似PRV感染。接到样品后,本实验室进行了病原分离鉴定。
1 材料与方法
1.1 材料
1.1.1 组织样品 病死山羊脑、淋巴结等组织样品2份。将样品剪碎,加适量PBS(pH7.4)混匀,经冷冻、剧烈振荡研磨、离心,回收上清液,滤过除菌后置-20 ℃冻存备用。
1.1.2 主要试剂 DMEM液体培养基、胰酶、NBS、青霉素-链霉素溶液和DNA胶回收试剂盒:均购自Gibco;DNAzol:购自Invitrogen;DL 2 000 bp DNA Marker、GC buffer I、dNTPs、Ex Taq® Hot Start Version、6×loading buffer、50×TAE和琼脂糖:均购自宝生物工程(大连)有限公司。
1.1.3 细胞和参考病毒株 Marc145细胞:中国动物卫生与流行病学中心畜病监测室提供;培养基:DMEM溶液加10%新生牛血清、1%青-链霉素(终浓度为100 U),常规方法培养;PRV Min-A株:购自中国兽医药品监察所。
1.1.4 实验动物 健康家兔5只:购自青岛康大生物科技有限公司。
1.1.5 引物及序列比对用参考毒株 所用PRV野毒株检测及主要毒力基因(gE、gC和TK)扩增引物见表1,由上海生工生物工程技术服务有限公司合成,稀释为20 pmol/L备用。用于序列分析的PRV参考毒株包括Bartha、DUL34Pass、LA、Kaplan、SDWF2、Ea、Becker、SuHV-1、Kolchis、Taian、MinA、Fa、TJ、JS-2012、HN1201、SC 1987、HLJ08、BJ-YT、ZJ01 和Hercules,相应毒株的gE、gC和TK基因序列下载自NCBI。

表1 PRV检测及主要毒力基因扩增引物
1.2 方法
1.2.1 兔体接种试验 严格遵照《实验动物管理条例》[11]并参考国家标准《伪狂犬病诊断方法》[12],将5只兔子分成2组,其中攻毒组3只,每只颈部皮下注射1.1.1节冻存的病料预处理上清各2 mL,对照组2只,颈部皮下注射PBS 2 mL,隔离饲养观察。试验结束后,对死亡家兔尸体进行无害化处理,并对试验环境进行彻底消毒。
1.2.2 病毒分离培养 取冻存的病料上清液,接种于长至单层的Marc145细胞,1 h后加入约4 mL含1%血清和1%双抗的DMEM维持液继续培养,并设立一组未接种病料的细胞作为阴性对照,每隔8 h观察细胞病变情况。待接种48~72 h后收获病毒,然后连续盲传5个代次,收集每一代次全部培养物,分别将其命名为SDPD-17第F1、F2、F3、F4、F5代,-80 ℃冻存备用。
1.2.3 检测及基因扩增用核酸提取 取参考毒株 MinA、SDPD-17 F1~F5 代培养物各 250 µL,按DNAzol使用说明书提取全基因组,-20 ℃保存备用。
1.2.4 细胞培养物PCR检测 在冰上配置细胞培养物PRV检测体系,总体系为25 µL,分别包括 2×GC 缓冲液 12.5 µL、dNTPs 2 µL,gE-TF 和gE-TR(20 pmol/L)各 0.5 µL,EX-Taq 热启动聚合酶 0.25 µL、模板 2 µL、DEPC 水 7.25 µL。检测条件是:98 ℃热变性5 min,然后进行35个扩增循环,即 94 ℃ 50 s、62 ℃ 50 s、72 ℃ 1 min,最后72 ℃延伸10 min,结束后取适量产物进行电泳观察。
1.2.5 电镜观察 取SDPD-17分离株F5代培养物(下同)送青岛大学院电镜室进行电镜观察。
1.2.6 病毒效价测定 待Marc145细胞长至单层后,经胰酶消化制作96孔细胞板,取SDPD-17株细胞毒连续进行10倍系列稀释,依次接种细胞板各孔,按Reed-Muench法进行病毒效价测定。
1.2.7 PRV分离株遗传演化分析 取表1中的PRV主要毒力基因gE、gC、TK扩增引物,按照细胞培养物PCR检测体系分别配制3个基因的扩增体系,体系大小均为50 µL,基因扩增条件与PRV野毒检测条件大致相同,gE、gC、TK基因的退火温度分别是62、61、63 ℃。扩增结束后,取适量产物,鉴定是否出现目的条带。如果有目的条带,切胶后按DNA胶回收试剂盒使用说明书回收目的条带,送样测序;收到测序结果后,使用MEGA 6.0软件进行分离株遗传演化分析。
2 结果
2.1 兔体接种试验
兔体接种试验发现,3只家兔在接种病料处理上清后,48 h左右出现奇痒、尖叫和撕咬注射部位等症状,72 h内全部死亡。死亡家兔的注射部位血肉模糊,尸体呈角弓反张样(图1-A),而对照兔无任何临床异常(图1-B)。

图1 兔体接种试验中的兔临床症状
2.2 病毒分离
Marc145细胞接种病料处理上清液后,置37 ℃恒温箱培养,12 h左右细胞出现病变,主要表现为细胞折光性增强,部分细胞出现空泡或呈“包涵体”样(图2),36 h左右细胞脱落,此时收获病毒培养液。从第2代开始,CPE出现的时间提前至接种后8 h,24 h左右便可收获。继续传代到第5个代次,对每个代次的培养物做好标记,低温保存待检。

图2 SDPD-17接种Marc145后的细胞病变(200×)
2.3 病毒鉴定
提取PRV参考毒株和SDPD-17株F1~F5代培养物全基因组,进行PRV野毒PCR鉴定。结果凝胶电泳鉴定均为PRV gE核酸阳性,即所分离毒株为PRV(图3)。
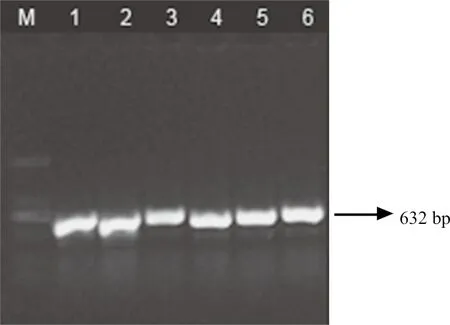
图3 PRV SDPD-17株PCR检测电泳图
2.4 电镜观察
将SDPD-17 F5代细胞毒液4 ℃ 12 000 g离心10 min后,吸取上清液送至青岛大学附属医院电镜室进行负染电镜观察。在电子显微镜下可见,直径约150 nm的病毒粒子。该病毒粒子呈球形,隐约可见四层结构,最外层是典型的脂质双分子层膜形成的囊膜(图4)。
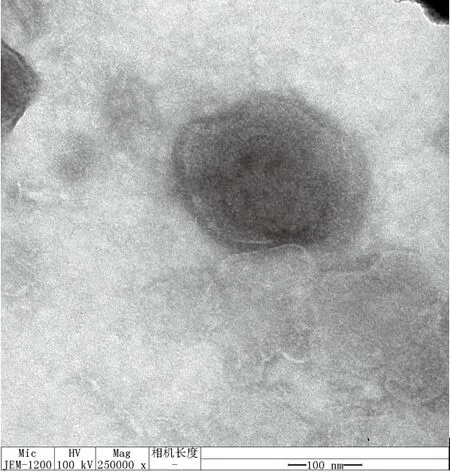
图4 SDPD-17 病毒粒子电镜照片
2.5 病毒含量测定
待SDPD-17 F5代细胞毒接种Marc145细胞3~5 d后,测定该病毒的TCID50值为10-7.50/0.1 mL,即该病毒稀释107.50。接种100 µL,可使50%的细胞发生病变。
2.6 gE、gC、TK基因测序及遗传演化分析
2.6.1 gE、gC、TK基因测序 经扩增、电泳、切胶回收、测序后,获得了SDPD-17毒株gE、gC、TK基因片段,各序列长分别为1 740、1 460、951 bp(图5)。
2.6.2 gE基因遗传演化分析 将19个参考毒株与SDPD-17株的gE基因进行多序列比较,发现分离毒株与Kaplan等5个国外毒株的gE基因和氨基酸序列同源性介于97.7%~98.0%、94.3%~96.0%,与MinA等3个国内毒株gE基因和氨基酸序列同源性介于 98.9%~99.8%、98.3%~100%。应用MEGA6.0软件成功构建gE基因遗传发育进化树(图6),分析发现该分离毒株与当前国内流行的PRV毒株位于同一进化分支,均属于G2基因型的G2.3分支。

图5 PRV SDPD-17株gE、gC、TK基因PCR扩增电泳图
2.6.3 gC基因遗传演化分析 将19个参考毒株与SDPD-17株的gC基因序列进行多序列比较,发现分离毒株与Kaplan等5个国外毒株的gC基因和氨基酸序列同源性介于95.9%~96.2%、93.1%~93.5%,与MinA等3个国内毒株gE基因和氨基酸序列同源性介于96.9%~100%、94.8%~100%。应用MEGA6.0软件,成功构建gC基因遗传发育进化树(图7)。分析发现,该分离毒株与当前国内流行的PRV毒株位于同一进化分支,均属于G2基因型的G2.3,无明显地域和时间差异。
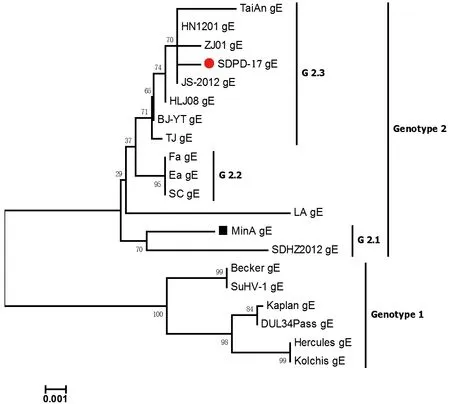
图6 SDPD-17株gE基因构建的遗传发育进化树
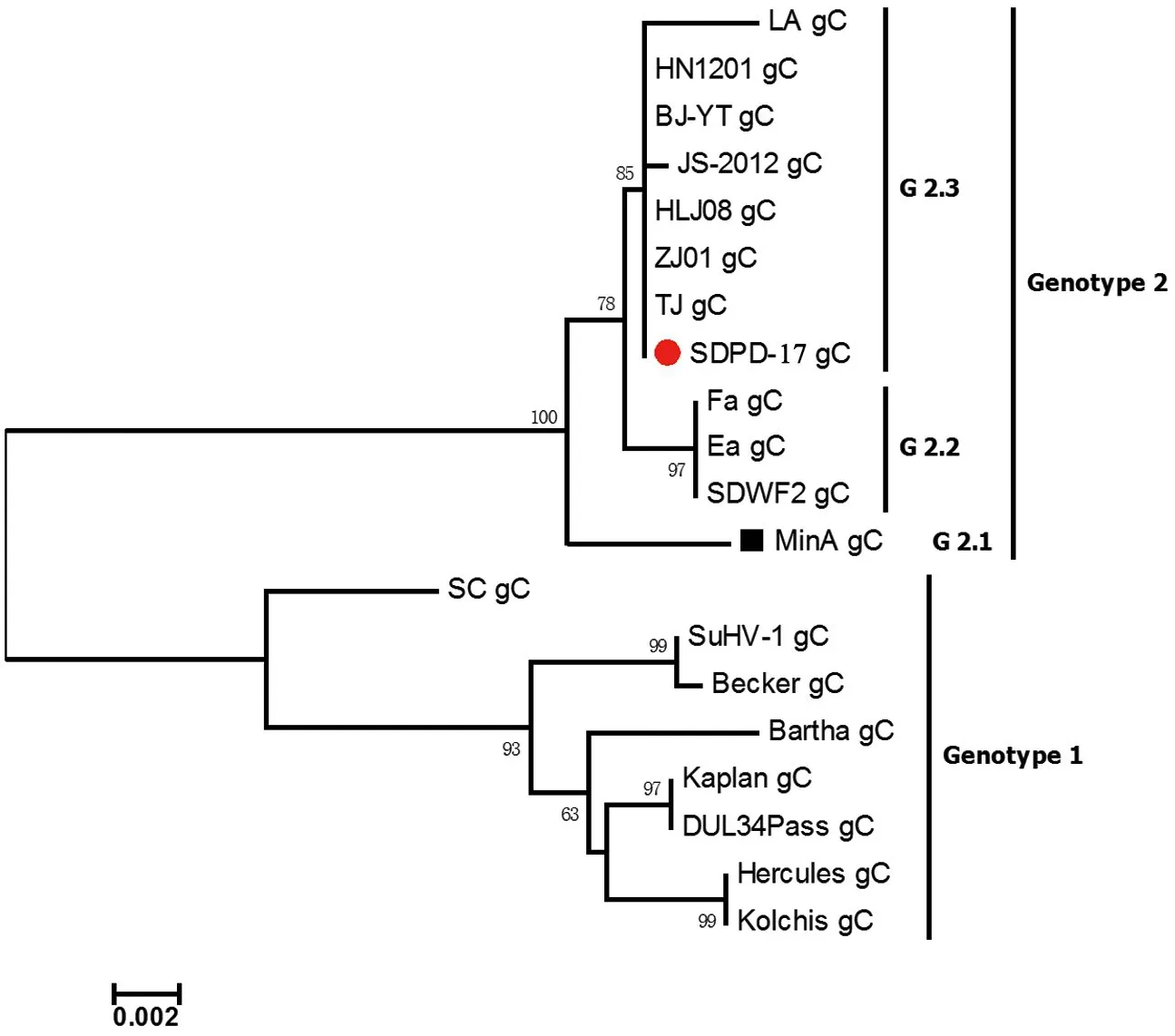
图7 SDPD-17株gC基因的遗传发育进化树
2.6.4 gE、gC、TK基因氨基酸变异分析 将SDPD-17株gE、gC、TK基因序列转换为推导氨基酸序列后,与19个参考毒株的gE、gC、TK基因推导氨基酸序列进行比较,发现相较于国外PRV毒株,该分离毒株和国内参考毒株的gE糖蛋白的主要变化特点为48、497位各插入了1个天冬氨酸(D),另在gE糖蛋白的54、59、63、106、122、149、179、181、215、216、472、474位发生了氨基酸变异。比较gC蛋白推导氨基酸序列,发现相较于国外PRV毒株,该分离毒株和国内参考毒株gC糖蛋白的主要变化特点为64~70位插入了7个氨基酸(AASTPAA),另外gC糖蛋白的 16、25、43、53、55、57、59~61、76、87、90、102、130、142、187、240、243、431、437、449、457、461、467、485~487位发生了氨基酸变异。该分离毒株与参考毒株的TK基因推导氨基酸序列分析发现,该分离毒株与国内毒株TK氨基酸序列除在215位发生1个位点突变外(T→V),其他位点均未改变。
3 讨论
从疑似PRV感染的山羊脑、淋巴结样品中分离到1株PRV,综合兔体接种、病毒分离、系列鉴定及相关基因测序分析,确定分离的病毒属PRV野毒(gE基因不缺失)。直接使用病料处理上清液攻击易感动物家兔,可使其出现奇痒、撕咬注射部位、尖叫等PRV感染所致的经典症状;Marc145细胞接种后可产生变大、变亮、拉网等典型细胞病变特征,gE、gC等基因测序结果也证实细胞分离物为PRV。因此,可以确认PRV是导致山羊发病死亡的主要致病原。该试验结果与郭荣利等[13]、孙海凤等[14]和朱玲云等[15]的研究结果一致。
将国内外PRV毒株gE、gC、TK基因与该分离株SDPD-17进化树、序列同源性以及氨基酸序列进行分析后发现,这株山羊源PRV与近几年来分离到的猪源、犬源PRV的核苷酸序列同源性介于96.5%~100%,在物种和地域上几乎不存在差异。因此,推测该毒株可能由猪体通过媒介(鼠、犬)传染给了山羊[16]。比对gE基因推导氨基酸序列发现,该毒株gE糖蛋白的48、497位各插入了1个D,另在gE糖蛋白的12个氨基酸位点发生点突变。而比对该株与国外毒株gC蛋白发现,在64~70位插入了7个氨基酸(AASTPAA)。Wang等[17]的研究结果亦如此,说明该毒株与我国当前流行的PRV属于同一基因型(G2.3)。
为加强对PRV的控制,各养殖场应避免多种动物混养,优化养殖场生物安全管理制度,做好定期消毒及疫苗免疫工作。同时,在我国猪群PR地方流行,应同时加强对山羊等对PRV敏感动物的PR流行病学调查、监测以及免疫预防工作。
