miR21介导Ang(1-7)对肺成纤维细胞AngⅡ诱导的NLR3炎性体激活的抑制作用
2019-04-24申光富谢召峰罗长琴
申光富 杜 培 余 蕊 谢召峰 罗长琴
肺纤维化是以成纤维细胞增殖及大量细胞外基质聚集并伴炎症损伤、组织结构破坏为特征的一大类肺疾病的终末期改变,严重影响人体呼吸功能[1-2]。尤其是随着特发性肺纤维化发病率和死亡率逐年增加,近年来受到科研工作者越来越多的关注,但是到目前为止其发病机制仍不清楚。研究表明,成纤维细胞是导致肺纤维化病程发生发展的主要细胞,因此研究成纤维细胞的增殖、凋亡及其可能的作用机制对肺纤维化的阻断具有重要意义[3-4]。MiRNA作为一类小分子非编码RNA,能够与靶基因的非编码区域结合,起到抑制甚至降解靶基因mRNA的作用。相关研究表明,miRNA的异常表达与多种疾病的发展密切相关[5-6]。miR21作为miRNA原癌基因的重要成员,在肺纤维细胞中过表达,且与肺成纤维细胞的增殖、迁移等密切相关,但是其具体作用机制仍不明了。血管紧张素参与了肺纤维化的发生、发展过程,AngⅡ、Ang1-7作为肾素-血管紧张素系统(RAS)重要的效应分子[7-9],研究其在肺纤维化病程过程中发挥的作用具有十分重要的意义。鉴于此,本文探讨了miR21在肺成纤维细胞中的表达及对肺成纤维细胞增殖、凋亡的影响,并进一步研究了miR21促进肺纤维化的可能机制。
材料与方法
一、实验动物
健康1月龄SPF 级Wistar大鼠,体重50~80 g,雌雄各半,购自于北京维通利华有限责任公司,室温、12 h︰12 h明暗交替喂养。
二、实验方法
1. 大鼠原代肺成纤维细胞的分离、培养: 腹腔注射3%戊巴比妥钠麻醉大鼠后,在无菌环境下分离肺组织,剪碎处理后进行细胞培养:将PBS反复冲洗过的大鼠肺组织离心5 min,置于DMEM培养基中,培养基中添加15%胎牛血清、10 mmol/L的HEPES缓冲液及100 U/ml的青霉素和链霉素,于37 ℃、0.05 CO2、饱和湿度环境下的细胞培养箱中传代培养,2~3 d更换1次培养液,约4~7 d后可见组织块周围有大量细胞生长。取对数生长期的细胞,用0.25%胰蛋白酶消化后离心弃去上清液,PBS清洗3遍。细胞传代3次后收集细胞,以便后续检测。
2. 大鼠原代肺成纤维细胞鉴定: 鉴定大鼠原代肺成纤维细胞采用甲苯胺蓝染色和Ⅱ型胶原免疫荧光法。细胞爬片完成后,去除培养液,采取4%多聚甲醛将细胞固定30 min,采用PBS反复清洗3次,加入0.25%甲苯胺蓝进行30 min染色,采用PBS反复漂洗3次,然后采4%多聚甲醛中进行15 min固定后,在室温的条件下进行10 min的消化,采用PBS反复漂洗3次,在体积分数为5%的BSA 中进行45 min封闭,然后添加稀释好的一抗( 1︰200 稀释),在4 ℃的条件下培养16 h。采用PBS冲洗细胞3次×5 min,添加稀释好的荧光二抗(山羊抗兔荧光二抗),室温孵育1 h。随后采用PBS反复清洗3次(避光),加入DAPI后在显微镜下进行观察并进行照相记录。
3. 细胞转染: 转染前1 d,在不含青霉素及链霉素的DMEM培养基中接种细胞,细胞汇合度达50%时可进行转染。采用riboFECTTMCP分别转染NC、inhibitor(50 mmol)和mimic(50 mmol):将各组细胞分别接种于6孔细胞培养板中,每孔约含1×104个细胞,培养1 d后,加入2微克相关质粒于400微升无血清DMEM培养基中,将PEI︰DNA=3︰1用200微升无血清高糖培养基稀释,混匀后静置5 min;然后两者混合,震荡15 s;随后将转染复合物滴加到相应孔中,置于37 ℃、5% CO2培养箱中培养。6 h后置换培养基为胎牛血清完全培养基,胎牛血清浓度为10%。空白对照组不做转染处理。
4. CCK8检测miR21对肺成纤维细胞增殖的影响: 将处于对数生长期的大鼠肺成纤维细胞接种于96孔细胞培养板中,每孔约含1×104个细胞。分为空白对照组、miR21NC阴性对照组、miR21 inhibitor组、miR21 mimic组。培养24、48、72 h后,每孔加入20 μl(5 mg/ml)MTT液, 37 ℃孵育箱培养4 h,弃去培养液。每孔加入DMSO 150 μl,震荡培养,采用酶标仪对其光密度OD值( 波长 570 nm)进行检测。
5. 采用流式细胞仪检测miR21对肺成纤维细胞凋亡的影响: 大鼠肺成纤维细胞接种于 24孔细胞培养板中,每孔约含1×104个细胞。分为空白对照组、miR21NC阴性对照组、miR21 inhibitor组、miR21 mimic组。培养24、48、72 h后,消化收集细胞。按照KGA107凯基细胞凋亡检测试剂盒说明书进行操作,采用 PBS对各孔进行清洗,将清洗的 PBS于离心管收集,然后以离心半径8 cm,1 500 r/min离心5 min,去除上清,采用预冷的 PBS 进行重悬,舍去上清,反复操作2次,采取FITC结合液进行重悬,将重悬液移到1.5 ml 离心管中,在避光的条件下添加FITC,30 min 后添加 PI,孵育5 min后用流式细胞仪检测细胞凋亡情况。
6. RT-PCR法检测miR21、Ang(1-7)、AngⅡ基因表达的变化: 各组肺成纤维细胞中分别加入Trizol试剂,常规方法提取RNA,采用逆转录反应体系扩增获得产物cDNA,-20 ℃保存。采用聚合酶链式反应(RT-PCR)方法检测miR21、Ang(1-7)、AngⅡ基因表达水平。PCR扩增条件为:95 ℃预变性3 min,94 ℃变性30 s,60 ℃退火30 s,70 ℃延伸25 s,循环40次,最后72 ℃延伸60 s。取10 μl扩增产物和6μl的DGL-200 Maker同时上样,于2.5%的琼脂糖凝胶电泳分离,紫外凝胶成像系统分析扩增结果并拍照。
7. 蛋白免疫印迹Western blot分析AngⅡ、NLRP3蛋白表达水平变化: 配置10%浓度的SDS-聚丙烯酰胺电泳凝胶,将凝胶置于电泳槽上,并将各组成纤维细胞提取蛋白上样电泳。电泳后转印到PVDF膜上,室温封闭1 h。清洗后分别加入稀释过(1︰1 000)的BAX、p53蛋白抗体,4 ℃过夜,TBST洗3次,每次5 min;随后加入HRP标记的二抗(1︰500),37 ℃作用2 h,TBST洗3次×5 min。设立阴性对照组,以GAPDH单克隆体为一抗,HRP标记的IgG为二抗。
三、统计学方法

结 果
一、大鼠原代肺成纤维细胞的培养及鉴定
显微镜下观察分离培养的大鼠原代肺成纤维细胞呈梭形或星型,胞质透亮,核仁呈椭圆形,细胞链接紧密,边缘光滑。对原代肺成纤维细胞进行PT-PCR检测可知,成纤维细胞高表达其标志性波形蛋白(Vimentin),而该蛋白在正常肺泡细胞中基本不表达,见表1。
二、miR21对肺成纤维细胞增殖的影响
CCK8检测结果显示,正常肺成纤维细胞在各时间点均能正常生长,增殖较为平缓。24 h时miR21各转染组增殖情况与空白对照组进行比较,不具有明显的差异(P>0.05)。在 48、72 h时间点,inhibitor、mimic组与NC对照组进行比较,inhibitor组OD值明显降低,mimic组OD值显著升高,差异具有统计学意义(P<0.05) 。NC组与空白对照组在各时间点OD450 值无明显差异,不具有统计学意义(P>0.05)。即下调miR21表达后肺成纤维细胞增殖受到抑制,上调miR21表达后肺成纤维细胞增殖受到促进,说明miR21具有促进肺成纤维细胞增殖的作用,见表2。

表2 miR21对肺成纤维细胞增殖的影响
三、流式细胞仪分析细胞凋亡
采用流式细胞术检测miR21对肺成纤维细胞凋亡的影响,结果表明,miR21 NC组在各时间段的细胞凋亡率分别为(28.20±5.27)%(24 h)、(35.23±4.32)%(48 h)、(38.34±5.57)%(72 h),与空白对照组无明显差异(P>0.05)。miR21过表达组肺成纤维细胞凋亡率在个时间段均较NC对照组显著降低,miR21抑制组较NC组在各时间段细胞凋亡率均显著提高,差异具有统计学意义(P<0.05)。即miR21具有显著抑制肺成纤维细胞凋亡的作用,见表3。
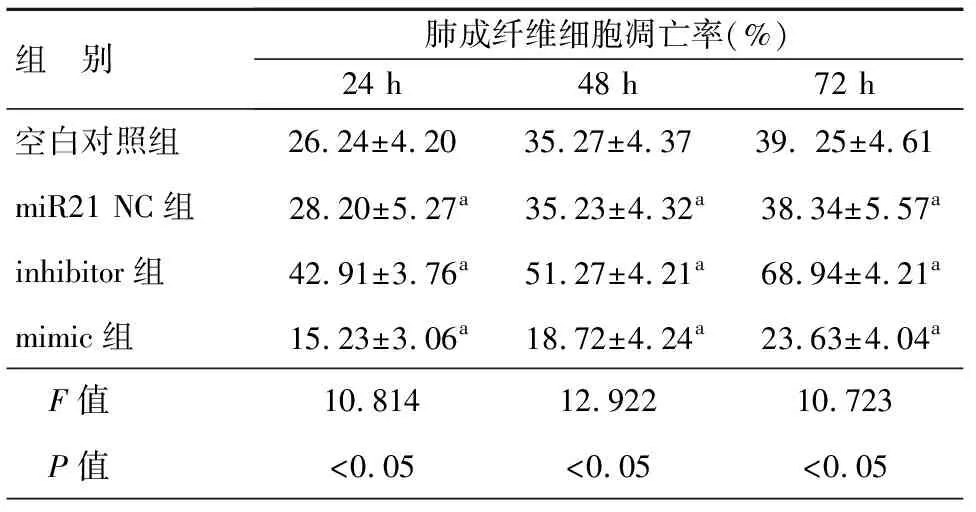
表3 miR21对肺成纤维细胞凋亡的影响
四、miR21对肺成纤维细胞Ang(1-7)、AngⅡ基因表达的变化

表4 PCR过程中引物序列设计
miR21、Ang(1-7)、AngⅡ以及GAPDH引物设计,见表4。miR21、Ang(1-7)、AngⅡ在肺成纤维细胞中的表达,见表5及图1。Real-time PCR基因检测结果可知,与空白对照组相比,细胞转染后,inhibitor组miR21表达水平降低,mimic组miR21表达水平升高,差异具有统计学意义(P<0.05),证明细胞转染成功。与miR21 NC组进行比较,miR21 inhibitor转染后,上调了肺成纤维细胞Ang(1-7)表达,下调了AngⅡ表达;miR21 mimic转染后,下调了Ang(1-7)表达,上调了AngⅡ表达,差异具有显著性(P<0.05),说明miR21具有抑制Ang(1-7),促进AngⅡ表达的效果。

表5 RT-PCR 检测miR21、Ang(1-7)、AngⅡ基因表达情况

图1RT-PCR 检测miR21、Ang(1-7)基因表达情况
五、miR21对肺成纤维细胞对AngⅡ、NLRP3蛋白表达水平变化
miR21对肺成纤维细胞对AngⅡ、NLRP3蛋白表达水平变化的影响见表6及图2。蛋白免疫印迹检测结果可知,与空白对照组相比,miR21 NC组在AngⅡ、NLRP3蛋白表达水平上无显著差别(P>0.05)。inhibitor转染miR21表达受到抑制后,均有下调AngⅡ、NLRP3水平的效果;mimic转染miR过表达后,均有上调了AngⅡ、NLRP3水平的效果,差异具有统计学意义(P<0.05)。结果表明,miR21可通过上调AngⅡ、NLRP3水平促进肺成纤维细胞增殖并抑制其凋亡。

表6 miR21对肺成纤维细胞对AngⅡ、NLRP3蛋白表达水平的影响

图2Western Blot 检测AngⅡ、NLRP3蛋白表达情况
讨 论
肺纤维化是一种严重的、慢性进行的以弥漫性肺泡壁增厚以及大量细胞外基质沉淀为特征的肺疾病,目前尚缺乏有效的治疗措施,其具体的发病机制仍不明确[10-11]。成纤维细胞作为导致肺纤维化病程发生发展的主要细胞,广泛分布于肺间质中,负责维持肺的正常形态并具有修复功能,其对细胞增殖、凋亡及对肺纤维化的预防及治疗具有重要意义[12-14]。
miR21作为一个典型的miRNA原癌基因,在成纤维细胞中较正常肺泡细胞表达上调,可促进成纤维细胞的增殖并抑制细胞凋亡[15-17];血管紧张素Ⅱ(AngⅡ)可促进纤维化细胞因子的分泌,诱导炎症体的激活[18-20]; Ang1-7可拮抗AngⅡ的促增殖及促纤维化的作用;NLRP3炎症体的激活将会进一步导致肺纤维化的发生发展。但是miR21是否通过介导Ang(1-7)调节AngⅡ诱导PNLR3炎症体激活,从而达到抑制或促进肺纤维细胞的增殖尚未见相关报道。
本文中我们以大鼠原代肺成纤维细胞为研究对象,CCK8检测显示,miR21 mimic转染后,肺成纤维细胞增殖显著增高,inhibitor转染后,肺成纤维细胞增殖显著降低,与NC组相比,差异具有统计学意义(P<0.05),且随着时间的延长,细胞的增殖促进或抑制作用更加明显。流式细胞分析显示,与NC组相比,转染后miR21过表达组肺成纤维细胞凋亡率在各时间段均较对照组显著降低显著,miR21抑制组在各时间段细胞凋亡率均显著提高,差异具有统计学意义(P<0.05)。由此提示,miR21具有显著促进肺成纤维细胞增殖、抑制肺成纤维细胞凋亡的作用。RT-PCR基因检测显示,转染miR21 mimic/inhibitor后,miR21的表达显著提高/降低,说明质粒转染成功。miR21 mimic/inhibitor转染后,具有显著下调/上调Ang(1-7)、上调/下调了AngⅡ表达的作用,说明miR21具有显著抑制Ang(1-7),促进AngⅡ表达的效果。蛋白免疫印迹Western Blot分析表明,miR21 mimic/inhibitor转染后,上调/下调了AngⅡ、NLRP3蛋白表达水平,与NC对照组相比,差异具有统计学意义(P<0.05)。结果表明,miR21可介导Ang(1-7)显著上调AngⅡ、NLRP3的表达,从而达到促进肺成纤维细胞增殖、抑制其凋亡的目的。
综上所述,本研究表明miR21具有促进肺成纤维细胞增殖,抑制细胞凋亡的作用,其作用机制可能与miR21介导Ang(1-7)对肺成纤维细胞AngⅡ诱导的NLR3炎性体激活相关。但是其具体的作用机制尚不清楚,还需要进一步的深入研究。就目前研究结果表明,miR21可通过调控Ang(1-7)、AngⅡ、NLRP3表达在肺纤维化进展中发挥重要作用,这对于肺纤维化的诊断及治疗具有十分重要的意义,同时也为肺纤维化的新的治疗手段、抗纤维化药物的研发提供了一定的实验数据和理论支持。
