LHRH类似物在治疗前列腺癌患者中促肾结石形成风险的前瞻性研究
2019-04-22李志广郑清友续奇志周青春陈响秋吴涛
李志广 郑清友 续奇志 周青春 陈响秋 吴涛

【摘要】 目的:探索長期服用黄体生成素释放激素类似物(LHRH-a)对肾结石形成的风险,以及与骨质疏松、代谢综合征副反应之间的相关性。方法:采用前瞻性研究,共纳入40例前列腺癌患者,自纳入日均开始接受LHRH-a持续治疗方案;随访1年后,采集相关临床进行统计学指标分析。结果:在治疗1年后,患者PSA和睾酮水平明显下降(P<0.000 1),股骨颈、全髋关节、腰椎部分骨密度T得分及Z得分均明显下降(P<0.001)。患者血清指标中碱性磷酸酶、甘油三酯、钙、磷、骨钙素、beta-crosslaps、维生素D均升高(P<0.001);iPTH、雌二醇、PSA和睾酮指标均下降(P<0.001)。患者空腹尿及24 h尿中钙/肌酐指标均高于治疗前(P<0.05、<0.001)。24 h尿分析中钙排泄指数、钙排泄分数、肾小管再吸收磷酸盐、柠檬酸盐水平均高于治疗前(P<0.05)。随访结束时检出随访期间形成肾结石患者共12例(30%)。形成结石组患者腰椎骨密度T评分低于未形成结石组,beta-crosslaps水平高于未形成结石组,空腹尿钙/肌酐水平高于未形成结石组,差异均有统计学意义(P<0.05)。进一步,对腰椎骨密度评分、beta-crosslaps水平和空腹尿钙/肌酐水平3个因素进行多因素非条件Logistic回归分析,结果提示只有beta-crosslaps水平与结石出现呈现相关性(P=0.012)。结论:LHRH类似物在治疗前列腺癌的同时对机体骨代谢存在显著影响,将造成肾结石形成;而监测血清beta-crosslaps水平变化将有助于对肾结石的早期发现和干预。
【关键词】 LHRH类似物; 前列腺癌; 骨质疏松; 肾结石; Beta-crosslaps
doi:10.14033/j.cnki.cfmr.2019.25.001 文献标识码 A 文章编号 1674-6805(2019)25-000-04
Prospective Study of LHRH Analogues in Treatment of Renal Calculi in Patients with Prostate Cancer/LI Zhiguang,ZHENG Qingyou,XU Qizhi,et al.//Chinese and Foreign Medical Research,2019,17(25):-4
【Abstract】 Objective:To explore the risk of long-term use of LHRH-a in the formation of kidney stones and the correlation between osteoporosis and metabolic syndrome side effects.Method:A prospective study was conducted in 40 patients with prostate cancer, who began to receive LHRH-a continuous treatment every day, and after one year of follow-up,the relevant clinical indexes were collected for statistical analysis.Result:After 1 year of treatment,the levels of PSA and testosterone were significantly decreased(P<0.000 1),and the scores of T and Z in the neck,total hip and lumbar vertebrae were significantly decreased(P<0.001).Serum indicators of alkaline phosphatase triglyceride calcium phosphatase beta-crosslaps vitamin D increased(P<0.001).The indexes of estradiol, PSA and testosterone decreased in iPTH(P<0.001).The ratio of calcium/creatine in fasting urine and 24 h urine were higher than that before treatment(P<0.05,<0.001).The calcium excretion index,calcium excretion fraction,renal tubule reabsorption of phosphate and citrate in 24 h urine analysis were higher than those before treatment(P<0.05).At the end of the follow-up,12 patients(30%) were found to have kidney stones during the follow-up period.The T score of lumbar vertebrae in the stone formation group was lower than that in the non-stone formation group,the beta-crosslaps level was higher than that in the non-stone formation group, and the fasting urinary calcium/creatine level was higher than that in the non-stone formation group(P<0.05).Furthermore,multivariate unconditional Logistic regression analysis was performed on lumbar bone mineral density score, beta-crosslaps level and fasting urinary calcium/creatine level. The results showed that only beta-crosslaps level was correlated with stone appearance(P=0.012).Conclusion:LHRH analogues have a significant effect on the bone metabolism of the body while treating prostate cancer, which will lead to the formation of kidney stones.Monitoring the changes of serum beta-crosslaps will help early detection and intervention of kidney stones.
【Key words】 LHRH analogue; Prostate cancer; Osteoporosis; Kidney stones; Beta-crosslaps
First-authors address:Southern Medical University Shenzhen Hospital,Shenzhen 518100,China
前列腺癌(prostate cancer,PCa)是老年男性最常见的恶性肿瘤之一,在欧美国家其长期居于男性恶性肿瘤发病率第一位,死亡率的第二位[1]。由于前列腺癌起病隐匿,早期缺乏特异症状,因此很大部分前列腺癌患者就诊时肿瘤已浸润周围组织或出现淋巴结、骨、肺等处的转移,疾病进程已经发展到中晚期,失去了手术或放疗的根治机会,转而采取以内分泌治疗为主的治疗方案[2]。促黄体生成素释放激素类似物(LHRH-a)持续治疗是局限性或转移性的前列腺癌标准的初始治疗方案之一。体外实验证实LHRH-a存在体外垂体作用,并在包括前列腺癌在内的多种肿瘤细胞表面发现特异性LHRH结合位点,因此单用LHRH-a可以阻断雄激素促使雄激素依赖性癌细胞凋亡[3]。然而,研究报道,在长期使用LHRH-a治疗过程中患者存在诸如骨疼痛、排尿困难、性功能下降、皮疹、背痛、关节痛和鼻咽炎等副反应症状,主要原因包括雄激素剥夺与各种代谢副作用(包括骨质疏松症和心血管风险增加)[4-5]。其中,代谢综合征和骨质疏松症是与泌尿系结石(主要是草酸钙和尿酸)形成相关的两个主要的危险因素,且研究表明其存在于越来越多地复发性肾结石患者中[6-7]。故而,本研究推测长期服用LHRH-a治疗的前列腺癌患者并发泌尿系统结石的风险明显升高。本研究以服用LHRH-a治疗的前列腺癌患者为研究对象,探索长期服用LHRH-a对肾结石形成的风险,以及与骨质疏松、代谢综合征副反应之间的相关性,具体如下。
1 资料与方法
1.1 一般资料
本前瞻性研究中共纳入40例前列腺癌患者,所有患者均在2016年12月-2017年12月于笔者所在医院泌尿外科就诊临床诊断为前列腺癌,并适合服用LHRH类似物治疗。纳入标准:经医院病理科确诊为前列腺癌诊断,并进行Gleason评分;适合LHRH类似物进行雄激素阻断治疗,且服用药物预期满1年及以上。排除标准:发生骨转移患者;未签署知情同意书的患者;已接受钙和维生素D治疗,和/或接受类固醇皮质激素治疗的患者。撤出标准:患者病情加重,需更换治疗方法;患者出现严重药物相关不良反应而需停止服用该药物[8]。纳入患者平均年龄(70.16±5.75)岁,其中纳入时无骨外转移或淋巴结受累29例,有局部淋巴结转移8例,无骨转移3例。
1.2 方法
40例患者自纳入日均开始接受黄体生成素释放激素类似物(LHRH-a)持续治疗方案,具体方案为:醋酸戈舍瑞林缓释植入剂(诺雷得,阿斯利康公司,3.6 mg/支)皮下注射,3.6 mg/次,每4周为1个疗程。另外,所有患者在接受LHRH-a治疗过程中,均予以饮食补充摄入1 000~1 200 mg/d的钙量,同时增加富含维生素D的食物摄入。
1.3 观察指标
40例患者自接受药物治疗起开始1年随访,对患者接受药物治疗前及治疗1年后以下变量分别进行检测。包括:(1)髋关节和腰椎骨密度测量(T评分,Z评分)、计算机轴向断层扫描(CAT)、骨显像;(2)血生化指标:葡萄糖、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、甘油三酯;(3)胰岛素抵抗指数(HOMA指数);(4)肾功能指标:肌酐、尿酸;(5)血电解质与激素水平:碱性磷酸酶、钠、钾、氯化物、钙、磷、iPTH、骨钙素、维生素、beta-crosslaps、睾酮、胰岛素、C肽、雌二醇、孕酮和PSA;(6)空腹尿生化(尿pH、钙/肌酐、尿酸、柠檬酸盐、草酸盐)和24 h尿生化(尿量、钠、钾、氯化物、钙、钙/肌酐、肾小管再吸收磷酸盐、柠檬酸盐、草酸盐);(7)代谢综合征诊断标准(符合以下3项及以上):血糖>100 mg/dl;甘油三酯>150 mg/dl;HDL胆固醇<40 mg/dl;BP>130/85 mm Hg;腹围>102 cm。
1.4 统计学处理
统计学分析采用SPSS 17.0软件进行,其中计量资料以(x±s)表示,数据符合正态分布,则两组间均数比较采用T-Test检验;不符合正态分布,则采用Mann–Whitney U test检验;计数资料以率(%)表示,采用字2检验。多因素分析采用非条件Logistic回归分析,模型筛选采用Forward:LR法。P<0.05为差异有统计学意义。
2 结果
2.1 40例患者治疗前后骨密度及血清指标变化比较
治疗前患者代谢综合征发生率为30%(12/40),治疗1年后为45%(18/40),发生率较治疗前上升,但差异无统计学意义(P>0.05),考虑样本量限制;在治療1年后,患者PSA和睾酮水平明显下降(P<0.000 1),股骨颈、全髋关节、腰椎部分骨密度T得分及Z得分均明显下降(P<0.001)。此外,在接受LHRH-a治疗1年后,患者血清指标中碱性磷酸酶、甘油三酯、钙、磷、骨钙素、beta-crosslaps、维生素D均升高(P<0.001);iPTH、雌二醇、PSA和睾酮指标均下降(P<0.001),见表1。
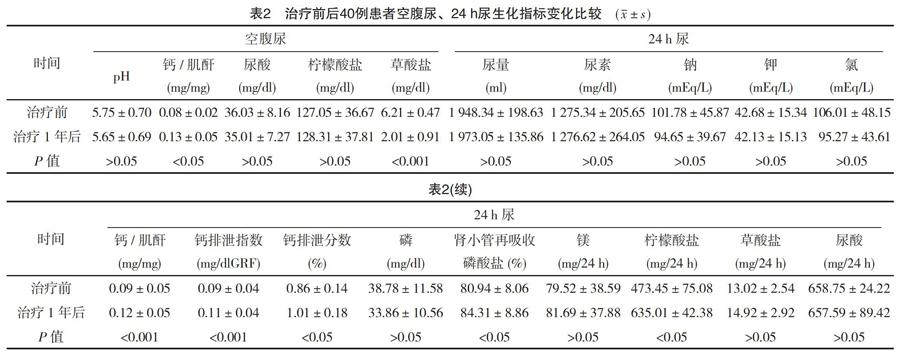
2.2 治疗前后空腹尿、24 h尿生化指标变化比较
治疗1年后,患者空腹尿及24 h尿中钙/肌酐指标均高于治疗前(P<0.05、<0.001)。此外,24 h尿分析中钙排泄指数、钙排泄分数、肾小管再吸收磷酸盐、柠檬酸盐水平均高于治疗前(P<0.05),见表2。
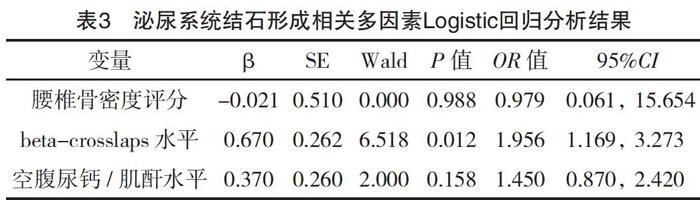
2.3 泌尿系统结石形成相关因素分析
在40例患者中,随访结束时检出随访期间形成肾结石患者共12例(30%)。筛选出40例患者在接受治疗前后骨密度指标、血清指标、空腹尿及24 h尿生化各指标中差异有统计学意义的研究变量,采用Mann–Whitney U test检验,分析形成肾结石的12例患者与其他28例未出现结石的患者之间相关指标在研究结束时平均值的差异情况,结果表明形成结石组患者腰椎骨密度评分(T-score)为-1.73±1.01,低于未形成结石组的-0.70±1.14,差异有统计学意义(P<0.01);beta-crosslaps水平为(0.55±0.16)ng/ml,高于未形成结石组的(0.34±0.12)ng/ml,
差异有统计学意义(P<0.01);空腹尿钙/肌酐水平为(0.16±0.05)mg/mg,高于未形成结石组的(0.11±0.03)mg/mg,差异有统计学意义(P<0.05)。进一步,对腰椎骨密度评分、beta-crosslaps水平和空腹尿钙/肌酐水平3个因素进行多因素非条件Logistic回归分析,结果提示只有beta-crosslaps水平与结石出现呈现相关性(P=0.012),见表3。
3 讨论
LHRH类似物在前列腺癌患者治疗中可引起雄激素缺乏,这是导致骨质疏松症的主要原因,而骨质疏松症是一种与肾钙结石形成密切相关的疾病[9]。因此,监测前列腺癌患者接受LHRH-a治疗过程中骨质疏松发生发展情况,将有利于早期发现和防治泌尿系统结石[10]。beta-crosslaps属于胶原蛋白降解的产物,是检测肾结石形成和骨质丢失最常用生物标志物的标记之一[11]。在本研究中,患者在接受LHRH-a治疗1年后,血清beta-crosslaps指标明显上升,其中形成结石的患者的空腹尿钙/肌酐水平显著高于未形成结石的患者。
此外,在接受LHRH-a治疗后,患者血清钙、磷、碱性磷酸酶,骨钙素和25-羟基维生素D均呈现上升,伴随iPTH水平下降。由此可见,LHRH-a治疗对患者的钙磷代谢和骨代谢存在显著的干扰,这将导致主要集中在腰椎和臀部的骨密度损失[12]。在本研究中,治疗后患者24 h尿钙、钙排泄指数、钙排泄分数、肾小管再吸收磷酸盐水平均显著上升,反应机体骨吸收的增加,这同样也会加重骨质疏松并增加肾结石形成的风险。
因此,本研究表明LHRH类似物在治疗前列腺癌的同时对机体骨代谢存在显著影响,这将造成肾结石形成。而检测血清beta-crosslaps水平变化将有助于肾结石的早期发现和干预。
参考文献
[1]陈道宝,杨红健.药物去势在绝经前乳腺癌内分泌治疗中的应用[J].中国肿瘤,2015,24(5):413-420.
[2]程耿,汪涛,刘绪堃,等.血清睾酮值及SDS评分在前列腺癌内分泌治疗的临床应用[J].航空航天医学杂志,2013,24(10):1185-1187.
[3]杜丽娜.促黄体生成激素释放激素(LHRH)类似物及其制剂的研究进展[A].//中国药学会.2006第六届中国药学会学术年会论文集[C].中国药学会:中国药学会学术会务部,2006:10.
[4]李建栋,史福艳,董雅娟,等.GnRH类似物(LHRH-A3)注射方案对奶牛超排效果的影响[J].中国奶牛,2006,1(6):30-31.
[5]吴广谋,张国利,岳玉环,等.LHRH-PE40对LOVO细胞的靶向杀伤作用[J].中国生物制品学杂志,2006,19(4):349-351.
[6]方弟安,耿照玉,陶勇,等.外源性激素LHRH-A3对皖西白鹅繁殖性能和生殖激素变化的影响[J].安徽农业科学,2005,33(1):92-93.
[7]蔡瑞芬,潘芹芹,潘勇,等.LHRH融合蛋白对雄性大鼠生殖功能的影响[J].中华男科学,2004,10(6):426-428.
[8]管睿,崔英.LHRH类似物在卵巢癌治疗中的应用[J].国外医学.妇幼保健分册,2003,14(6):413-416.
[9]孙文鑫,陈凤生,王德芬.促性腺激素释放激素类似物Nafarelin刺激试验的临床应用[J].临床儿科杂志,2002,20(9):528-530.
[10]张更.LHRH及其受体对前列腺癌的作用研究进展[J].国外医学.泌尿系统分册,2002,22(1):48-51.
[11]杨勇,顾方六.植入释放LHRH类似物治疗转移性前列腺癌的疗效观察[J].中华泌尿外科杂志,2000,21(7):57.
[12]王黎,林浩然.年龄对促黄体素释放激素類似物(LHRH-A)刺激的和多巴胺能药物抑制的鲤鱼促性腺激素(GtH)分泌的影响[J].水生生物学报,1997,42(3):286-289.
(收稿日期:2019-07-10) (本文编辑:马竹君)
