优化化学实验提高课堂效率
2019-04-22陈佳
陈佳

摘要:目前初中化学课本中的实验,大多都已给出较详尽的实验步骤,教师在课堂上能快速演示,学生在教师的指导下也能自主完成。但仍有小部分实验受实验条件及上课时长的限制,无法实现课堂上的演示及学生探究活动。文章以课本探究活动“探究过氧化氢分解的催化剂”为例,提供了几种改进课本该实验的方法,以实现该实验在课堂演示及学生分组实验探究的可行性和高效性。
关键词:催化剂;实验改进;高效;节约
文章编号:1008-0546(2019)02-0080-03 中图分类号:G633.8 文献标识码:B
一、问题的提出
2017年11月,笔者有幸参加了桂林市教科所组织的初中化学优质课比赛,赛题为“制取氧气”。在备课过程中,笔者发现,课本在设计“探究二氧化锰为过氧化氢分解的催化剂”的实验步骤上,存在着一些不足。
本市所使用的科粤版教材中,“探究二氧化锰为过氧化氢分解的催化剂”的实验步骤原文如下:
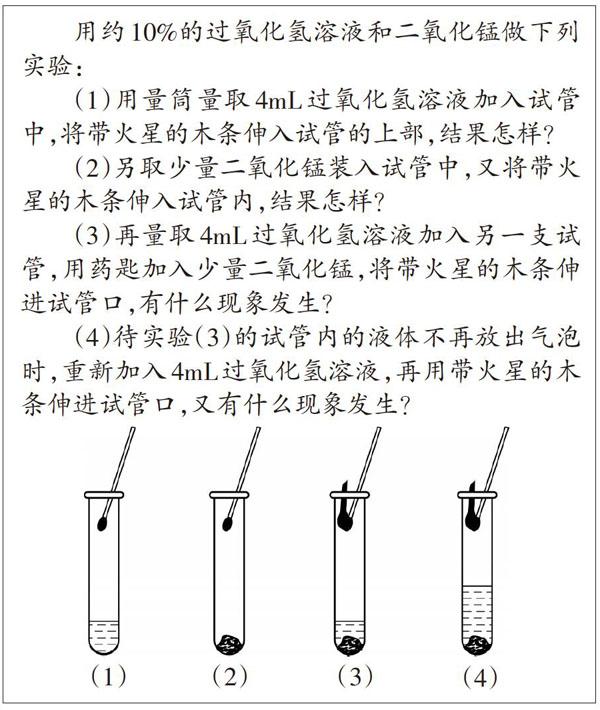
用约10%的过氧化氢溶液和二氧化锰做下列实验:
(1)用量筒量取4mL过氧化氢溶液加入试管中,将带火星的木条伸入试管的上部,结果怎样?
(2)另取少量二氧化锰装入试管中,又将带火星的木条伸入试管内,结果怎样?
(3)再量取4mL过氧化氢溶液加入另一支试管,用药匙加入少量二氧化锰,将带火星的木条伸进试管口,有什么现象发生?
(4)待实验(3)的试管内的液体不再放出气泡时,重新加入4mL过氧化氢溶液,再用带火星的木条伸进试管口,又有什么现象发生?
从催化剂的定义可知,要得出“二氧化锰为过氧化氢分解的催化剂”的结论,需要验证三个方面:①二氧化锰能改变过氧化氢分解的速率;②在化学反应前后,二氧化锰的化学性质不变;③在化学反应前后,二氧化锰的质量不变。如果按照上述观察活动进行实验,仅能得出“二氧化锰能改变过氧化氢分解的速率”及“在化学反应前后,二氧化锰的化学性质未变”的结论。而对于“反应前后二氧化锰的质量是否发生改变”,课本未给出详细的实验步骤,而是一笔带过,以结论的形式,直接告诉学生“若在实验前准确称出二氧化锰的质量,实验后将二氧化锰回收、干燥、再称量,会发现它的质量没有改变。”这样简略的设计,显然大大削弱了学生对于催化剂这一探究过程的理解,不利于发展学生科学实验探究的能力及严谨求实的科学品质。
二、问题的分析
《義务教育化学课程标准》川中提到“书中所列举的活动不要求全盘照搬,在教材编写或教学时可依据实际情况选择应用,也可以增补更合适的探究活动。”尽管如此,但大部分教师仍选择让学生通过阅读课本的方法,直接得出“在化学反应前后,二氧化锰的质量不变”的结论,或直接播放视频让学生观看。教师、学生都不亲自动手完成本实验,原因如下:
1.将二氧化锰与过氧化氢分离操作困难[2]且耗时较长
实验室的二氧化锰均为粉末状,将其加入过氧化氢溶液前的质量比较容易称量。但将其加入过氧化氢溶液后,若要对其进行称量,则需要先将其用滤纸过滤,然后干燥。在过滤过程中,由于二氧化锰粉末与滤纸孔径相当,二氧化锰会将滤纸空隙堵住,而大大减慢过滤速度。
2.无法快速将二氧化锰进行干燥
要将二氧化锰进行干燥,就必须连同滤纸一起烘干,此操作需要低温、恒温进行,对干燥仪器的要求较高,不仅操作困难,而且耗时较长。
综上所述,此实验耗时长、操作繁,无论是教师演示还是学生实验,都无法在一节课堂上快速完成。所以课本也并未给出具体的实验方案,以期教学者和学生们设计出更优化、更高效的实验方案。
三、实验的改进
为了能实现在课堂上快速探究“在化学反应前后,二氧化锰的质量不变”的实验,针对上述在实践过程中出现的问题,笔者查阅了大量书籍资料及文献,发现了不少能“快速将二氧化锰与过氧化氢溶液分离并干燥”的方法,并一一尝试,分析优缺点,整理总结如下:
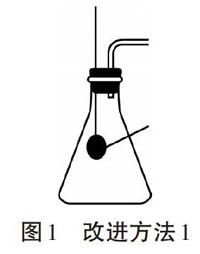
改进方法一:(如图所示)将二氧化锰用细孔材料包裹,并悬挂于反应容器上方,需要反应时将其推人过氧化氢溶液中,不需反应时则将其向上拉离液面,以此实现将二氧化锰与过氧化氢溶液快速分离。
根据此原理,笔者尝试了以下几种细孔材料:
1.纱布或茶叶包或制衣布料:笔者几经寻找并尝试实验,发现找到的纱布、茶叶包、制衣布料的孔径均大于二氧化锰孔径。将二氧化锰包裹后放入过氧化氢溶液,均有大量二氧化锰从空隙中漏出。
2.滤纸或口纸:笔者尝试将滤纸和口纸均剪成长条状,并折叠成“红包样式”,并用订书机封口(未用胶水是因为胶水遇水会失去粘性)。实验过程中发现,虽然二氧化锰漏不出去,但双氧水进入材料的速度很慢,进入后过氧化氢分解产生氧气,氧气将滤纸袋胀开,滤纸袋上浮至双氧水液面,袋内的双氧水被挤出袋外,导致反应逐渐停止;并且有较多二氧化锰粉末从订书机洞口跑出,导致二氧化锰无法被完全收集。若将口纸和滤纸围成兜状,结果仍然相似。
【结果分析】上述方法中,纱布、茶叶包、制衣布料孔径太大,无法将二氧化锰全部收集;滤纸、口纸口径合适,但由于孔径太小,使反应速率变得很慢,无法快速产生氧气进行课堂实验。
改进方法二:更换催化剂。将二氧化锰换成块状、易于过滤的催化剂。
(1)土豆块或土豆片或红砖块:笔者尝试取新鲜的土豆,分别将其切成块状、条状、片状三种形状,各为1克,加入5%的过氧化氢溶液,观察30秒,发现土豆表面均有气泡产生,但是都非常少。同样实验,取红砖块1克加入5%的过氧化氢溶液中,几乎看不到红砖块表面有气泡产生。原因:能催化过氧化氢分解的是土豆中的过氧化氢酶、红砖块中的氧化铁,而土豆中含有的过氧化氢酶含量较低,红砖中氧化铁的含量也较低,均不足以使过氧化氢迅速产生氧气。
(2)猪肝[3]:笔者从菜市买来一块100g的猪肝,切下一小块,绑上细线,用精确度到0.01g的电子天平进行称量。放入过氧化氢溶液中,看到有大量气泡产生,30秒后取出,用清水洗净,滤纸吸干,再称量,质量与反应前一致。整个实验过程不超过两分钟。
【结果分析】此方法具有以下優点:
1.猪肝为块状,反应前后的质量易于称量,且无需进行过滤、烘干等繁琐的操作,课堂教师演示或学生探究实验都十分快捷、方便。
2.用猪肝探究过氧化氢分解所需的催化剂,需要的过氧化氢的浓度仅为3%,甚至更低,且现象非常明显,大大节约了过氧化氢溶液的用量。
3.猪肝的催化能力很强,用其反复实验多遍后,仍可使用,实验完毕后,将其洗净、擦干,重新置于冰箱内保存,数天后取出使用,催化效果仍然非常好。若置于冰冻层,保存使用时间可达到更久。
注意事项:1.用猪肝做催化剂时,宜选用浓度较稀的3%的过氧化氢溶液。猪肝内含有丰富的过氧化氢酶,能快速地催化过氧化氢的分解,若在小试管中进行此实验,用5%的过氧化氢溶液,一加入猪肝,会看到有大量氧气迅速产生,且产生很多白色小气泡,气泡10秒后便能涌出试管,可见反应速率相当快。此时需要改用较稀的过氧化氢溶液,以医用3%的过氧化氢溶液的浓度为最佳,既能快速产生氧气,供学生用带火星的小木条进行检验,又不会出现气泡快速逸出的现象。当然在试管液面上方仍浮有许多小气泡,这些气泡中包裹有氧气,用带火星的小木条接触,也可看到木条复燃,学生们乐此不疲。
缺点:能让学生快速通过实验得出催化剂的定义,但只能得出猪肝是过氧化氢分解的催化剂,二氧化锰在催化过氧化氢分解反应前后质量是否改变的问题仍未解决。
改进方法三:把粉末状二氧化锰制成块状
能用作过氧化氢分解的催化剂的物质种类有很多[4],如:金属氧化物(二氧化锰、氧化锌、氧化铁、氧化铜、氧化铝等),盐类(氯化铁、氯化钠、氯化钾、氯化钙、硫酸铜、硫酸锰等),其中催化效果最好的仍是二氧化锰。由于大颗粒状的二氧化锰很难采购到,笔者只能自己尝试将二氧化锰制成块状了。
方法1:在二氧化锰粉末中加入水泥制成球状:“将水泥和二氧化锰粉末按照质量为1:4”的比例混合均匀,加入适量水搅拌呈糊状,然后用手(戴上一次性手套)捏成黄豆粒大小的颗粒,阴干24小时以上,用水冲掉表面的粉末,再晾干备用。
优缺点分析:(1)水泥的作用是将二氧化锰聚成块状,方便称量反应前后催化剂的质量。但水泥本身对过氧化氢也具有催化作用,对探究二氧化锰是过氧化氢分解的催化剂实验有干扰,所以不宜使用。(2)水泥材料主要用于建筑行业,较难寻找。
方法2:在二氧化锰粉末中加入“502”强力胶制成片状:取一块玻璃片,用药匙取两大勺二氧化锰于玻璃片上,堆成小山状,在上面滴人“502”,并另取二氧化锰将其覆盖,由于“502”遇到空气中水蒸气会迅速凝结,所以不到一分钟,片状的二氧化锰便制好了。为排除“502”对过氧化氢分解的干扰,笔者尝试向过氧化氢溶液中加入一片制好的“502”,未看见有气泡产生。
【结果分析】方法2的优点:
1.将二氧化锰在“502”的粘合下制成片状,便于将二氧化锰与过氧化氢快速分离并干燥。整个探究过程操作简单、快捷,适合在课堂上教师进行演示或学生进行分组探究实验。
2.片状二氧化锰的制作方法简便,材料容易购买。“502”为强力胶,能牢牢将二氧化锰粘合在其表面。将片状二氧化锰反复多次投入双氧水中,均不会有二氧化锰粉末脱落,既节约了二氧化锰的用量,又便于将二氧化锰进行回收,与“绿色化学”的环保理念相符。
教学建议:
1.进行过滤操作时,可设计如下实验:将课本实验(4)反应后的溶液倒入废弃的牙签盒盖中。由于牙签盒盖上的孔隙较大(片状二氧化锰无法通过),有利于滤液流出,便能快速将二氧化锰与滤液分离(如图2所示)。
2.干燥时,直接用干燥的滤纸吸干片状二氧化锰表面的水分即可(如图2所示)。
3.“502”不能催化过氧化氢的分解,不会对“探究二氧化锰是过氧化氢分解的催化剂”的实验产生干扰。但在探究过程中,应引导学生设计实验,排除“502”对该实验的干扰,以培养学生严谨的科学精神和实事求是的态度。
四、实验反思
培养学生的科学素养是化学课程改革的根本目标,积极主动地开展科学探究,是有效落实这一目标的关键。在化学教学中,教师应积极思考,勇于创新,多为学生创设动手探究的条件,让学生亲历探究过程,体验探究乐趣,培养学生的探究意识和探究能力,提高课堂效率。
参考文献
[1]中华人民共和国教育部制订.义务教育化学课程标准(2011年版)[M].北京:北京师范大学出版社,2012:1
[2]李焱.二氧化锰催化分解过氧化氢的探究性实验设计[J].化学教与学,2013(9):88,90
[3]刘静.浅谈化学探究实验能力的高效培养——以“催化剂”为例[J].化学教与学,2015(4):22-23
[4]宗雨琳,王宇飞.过氧化氢催化分解实验催化剂种类的探究[J].北学教与学,2016(6):96-97
