MRS联合VBM对首发抑郁症患者海马代谢和结构的研究
2019-04-21李宗鸿胡晓王晓王纯胡君李成林肖朝勇刘献伟
李宗鸿 胡晓 王晓 王纯 胡君 李成林 肖朝勇 刘献伟
【摘要】 目的:运用多体素三维磁共振波谱(3D-1H-MRS)和基于体素的形态测量(voxel based morphometry,VBM)方法分析首发抑郁症患者双侧海马代谢物改变和结构体积变化特点,评价海马1H-MRS及体积变化在首发抑郁患者早期诊断的应用价值。方法:测量40例首发抑郁患者和20例健康者双侧海马体积及肌酸(Cr)、N-乙酰天门冬氨酸(NAA)、胆碱(Cho)峰下面积,计算出NAA/Cr、Cho/Cr比值,并进行统计学分析。结果:首发抑郁组右侧海马NAA/ Cr、Cho/Cr及Cho值低于对照组,差异均有统计学意义(P<0.05);两组其余代谢指标比较差异无统计学意义(P>0.05);首发抑郁组双侧海马体积与健康组比较差异无统计学意义(P>0.05)。结论:多体素3D-1H-MRS可为临床医生早期诊断首发抑郁提供参考。
【关键词】 首发抑郁症 磁共振波谱 形态测量法 海马
doi:10.14033/j.cnki.cfmr.2019.28.026 文献标识码 B 文章编号 1674-6805(2019)28-00-03
Metabolism and Structure of Hippocampus in First-episode Depressive Patients by MRS Combined with VBM/LI Zonghong, HU Xiao, WANG Xiao, WANG Chun, HU Jun, LI Chenglin, XIAO Chaoyong, LIU Xianwei. //Chinese and Foreign Medical Research, 2019, 17(28): -65
[Abstract] Objective: To analyze the metabolic characteristics and the structure changes of hippocampus by 3D multivoxel proton magnetic resonance spectroscopy (3D-1H-MRS) and voxel based morphometry (VBM) in first-episode depression. To evaluate the value of 1H-MRS and volume changes in hippocampus in early diagnosis of first-episode depression. Method: A total of 40 depressive patients and 20 normal controls were assessed in this study. NAA、Cr and Cho peak area were detected in different areas, the volume of hippocampus, and NAA/Cr, Cho/Cr ratio were calculated and analyzed statistically. Result: The first-episode depressive group had significantly lower Cho value, NAA/Cr and Cho/Cr ratio in right hippocampus than health group, the differences were statistically significant (P<0.05). No significant differences were found in other metabolic values between the two groups (P>0.05). There were no significant differences in the volume of hippocampus between the first-episode depressive group and the health group (P>0.05). Conclusion: Multivoxel 3D-1H-MRS can provide reference for clinicians to early diagnosis of depression.
[Key words] First-episode depressive Magnetic resonance spectroscopy Voxel based morphometry Hippocampus
First-authors address: Nanjing Brain Hospital of Nanjing Medical University, Nanjing 210029, China
抑郁症(major depression,MD)以情感低落、思维迟缓及言语动作减少、迟缓为典型症状,其发病机制仍未完全阐明[1-3]。海马对学习、记忆和情绪等脑高级功能活动有重要影响,许多神经和精神疾病都会出现海马代谢和体积的改变[4-5]。然而对于首发MD患者海马代谢功能和结构的研究尚存在不一致的结论。笔者联合MRS和VBM方法对首发MD患者海马代谢功能和结构改变进行研究,以便为抑郁症的临床诊断提供参考,并为此疾病的病因学探讨提供线索,现报告如下。
1 资料与方法
1.1 一般資料
选取40例2011年-2014年在笔者所在医院就诊的首发抑郁障碍(major depressive disorder,MDD)首发MD患者为首发抑郁组,符合CCMD-3抑郁发作和DSM-IV首发抑郁症诊断标准,24项汉密尔顿抑郁量表(Hamilton rating scale for depression,HAMD)≥35分,均为右利手,排除神经系统和其他精神障碍性疾病、严重躯体疾病、药物和/或酒精依赖及MRI检查有禁忌者。健康组20例为正常对照,排除有精神疾病史或一级亲属中有严重精神疾病史,排除神经系统和其他全身器质性疾病。所有受试者检查前均被告知检査目的和方法,并由患者签署知情同意书。本研究纳入首发抑郁组男21例,女19例;年龄21~49岁,平均(32.5±9.1)岁;教育程度(16.0±1.3)年;HAMD评分(24.4±5.9)分。健康组20例,男11例,女9例;年龄25~50岁,平均(37.0±9.2)岁;教育程度(15.0±2.8)年;HAMD评分为(2.5±0.7)分。两组受试者性別、年龄和教育程度比较,差异无统计学意义(P>0.05)。
1.2 方法
MR機系Siemens公司Verio 3.0T超导型磁共振扫描仪。所有受试者均进行3D结构MRI和3D-1H-MRS检查。
3D结构MRI使用三维梯度回波成像序列(three-dimentional gradient-echo sequence)进行图像采集,TR/TE=1 900 ms/2.48 ms;FOV=256 mm×256 mm,Matrix=256×246,层厚1 mm,共176层。
3D-1H-MRS采用CSI序列,以矢状面3D-T1WI及重建横轴位、冠状位图像作为MRS的定位图像,获取点解析波谱分析的二维1H-MRS,TR 1 700 ms,TE 135 ms,视野范围为80 mm×80 mm,层厚15 mm,翻转角90°,带宽1 200 Hz,体素大小为10 mm×10 mm×15 mm,体素内匀场、水抑制均由扫描程序自动完成。扫描完成后由机器自动完成信号平均,基线矫正,相位循环,获得图像使用机器自带软件包Syngo VE 4.0进行后处理。测量N-乙酰天门冬氨酸(NAA)、胆碱(Cho)、肌酸(Cr)波峰下面积并计算NAA/Cr、Cho/Cr的比值。
采用MATLAB工作平台下SPM8软件的VBM8工具包,处理高分辨率的MRI结构图,对图像进行配准校正、分割、空间标准化、平滑。以海马区作为ROI提取海马体积。
1.3 观察指标
(1)3D-1H-MRS检测各代谢指标变化。海马区组织代谢产物指标包括NAA、Cho、NAA/Cr及Cho/Cr。(2)基于体素的形态测量。比较两组海马体积。
1.4 统计学处理
本研究数据采用SPSS 17.0统计学软件进行分析和处理,计量资料以(x±s)表示,采用t检验,计数资料以率(%)表示,采用字2检验,P<0.05为差异有统计学意义。
2 结果
2.1 3D-1H-MRS检测各代谢指标变化
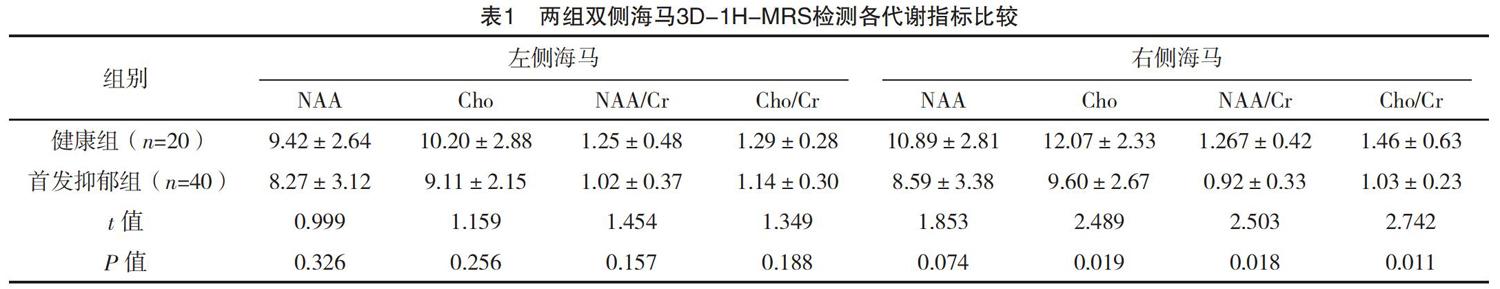
首发抑郁组右侧海马区NAA/Cr、Cho/Cr及Cho值低于健康组,差异均有统计学意义(P<0.05);两组其余代谢指标比较,差异均无统计学意义(P>0.05),见表1。
2.2 基于体素的形态测量
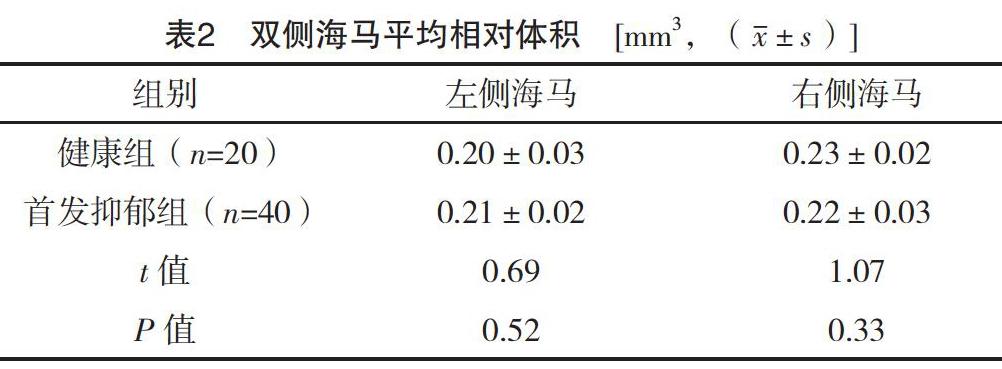
首发抑郁组双侧海马体积与健康组比较,差异均无统计学意义(P>0.05),见表2。
3 讨论
在利用磁共振波谱(magnetic resonance spectroscopy,MRS)技术对首发MD患者双侧海马的研究中发现,首发抑郁组右侧海马区NAA/Cr、Cho/Cr及Cho值低于健康组(P<0.05),两组其余指标比较差异无统计学意义(P>0.05)。在利用基于体素的形态测量首发抑郁组双侧海马体积较健康组无明显差异(P>0.05)。
Cr是总肌酸中的甲基组,是能量代谢的物质。由于在同一个体不同代谢条件下,脑内的Cr总量是恒定的,因此在波谱研究中常把它作为其他代谢物的参照物。NAA是公认的神经元内标志物,其值降低是神经元凋亡、神经元活性降低或功能损害的代表。在体测量NAA含量的多少可直接反映神经元密度及功能状况,NAA或NAA/Cr降低提示神经元或轴突丧失和/或神经功能紊乱,与先前研究结果相同的是文献[5-7]。本组首发抑郁患者右侧海马区NAA/Cr较正常对照患者低,笔者考虑在MD患者疾病早期,患者海马神经元活性和功能就随病情发展失代偿而致神经元功能降低,而经过治疗抑郁情绪好转的MD患者其海马NAA/Cr增高[8-9],则进一步证实MD患者海马区功能异常与情绪调控障碍的密切关系。
Cho主要存在于细胞膜上,反映细胞膜的合成及代谢变化[10]。胆碱既是与记忆、情绪密切相关的神经递质乙酰胆碱的前体,也是神经细胞膜7种基本磷脂(磷脂酰胆碱和鞘磷脂)的组成部分,而磷脂酰胆碱是参与细胞内信号转导的第7信使(二酯酰甘油)的重要来源[11]。先前一项研究发现Cho及Cho/Cr值在二者间没有差异[12],而本研究发现首发MD患者右侧海马较健康者Cho及Cho/Cr值均低,同时另一项研究则发现,相比于初次发作的MD患者,复发及病程长的MD患者,其双侧海马Cho及Cho/Cr值则显著增高[13]。笔者考虑,动态观察双侧海马Cho及Cho/Cr值的改变可能更有助于提示病情的加重及较长的病程,从早期出现降低到后期增高甚至增高更加显著,提示了MD患者神经细胞损害的程度,也反映了MD患者病情的加重。
MD患者海马体积的萎缩是目前大部分研究较为一致的发现[14],然而MD患者海马体积却能被许多因素影响,比如MD患者起病年龄、发病次数及病程等[15-16]。本研究在对比两组间海马体积时未发现明显差异,另一项对首次发病的MD患者海马结构的研究中也未观察到海马结构的异常[17],与笔者结论一致,考虑首次发病的MD患者尚未出现海马体积的改变可能和其起病年龄轻、病程短有关,另一方面也提示MRS所观察到的海马代谢功能的改变早于CT或MRI观察到的脑内形态学变化。
目前抑郁症的临床诊断主要依据患者及家属叙述的临床表现及症状,辅以相应的标准化评定量表、神经心理学测试,同时排除其他器质性病变,再进行鉴别诊断,最后得出诊断结论,缺乏客观参考指标。通过MRS技术能较为及时、灵活、准确地反映海马神经元活性及功能的改变,而联合VBM技术对于MD患者海马结构的改变也可提供一些参考,对于探讨MD患者的脑改变,为进一步阐明抑郁症的发病机制和建立抑郁症诊断的影像学可量化的客观指标提供思路,多体素3D-1H-MRS可为临床医生早期诊断首发抑郁提供参考。
参考文献
[1] Rottenberg J.Emotions in Depression:What Do We Really Know.[J]Annu Rev Clin Psychol,2017,13:241-263..
[2]朱程,徐乐平,孙剑,等.高频或低频重复经颅磁刺激治疗对抑郁障碍患者局部脑内代谢物质的影响[J].临床精神医学杂志,2017,27(1):28-31.
[3]史丹丹,陈莉,罗天友,等.重性抑郁患者电休克治疗前后脑默认网络的静息态功能磁共振研究[J].中国医学影像学杂志,2016,24(10):721-724,728.
[4] Kim YK,Won E.The influence of stress on neuroinflammation and alterations in brain structure and function in major depressive disorder[J].Behav Brain Res,2017,329:6-11.
[5] Jia Y,Zhong S,Wang Y,et al.The correlation between biochemical abnormalities in frontal white matter,hippocampus and serum thyroid hormone levels in first-episode patients with major depressive disorder[J].J Affect Disord,2015,180:162-169.
[6] Blasi G,Bertolino A,Brudaglio F,et al.Hippocampal neurochemical pathology in patients at first episode of affective psychosis:a proton magnetic resonance spectroscopic imaging study[J].Psychiatry Res,2004,131(2):95-105.
[7] Zhong S,Wang Y,Zhao G,et al.Similarities of biochemical abnormalities between major depressive disorder and bipolar depression:a proton magnetic resonance spectroscopy study[J].J Affect Disord,2014,168:380-386.
[8] Schmaal L,Veltman D J,Van Erp T G,et al.Subcortical brain alterations in major depressive disorder:findings from the ENIGMA Major Depressive Disorder working group[J].Mol Psychiatry,2016,21(6):806-12.
[9] Wang Y,Jia Y,Chen X,et al.Hippocampal N-acetylaspartate and morning cortisol levels in drug-naive,first-episode patients with major depressive disorder:effects of treatment[J].J Psychopharmacol,2012,26(11):1463-1470.
[10]许云,刘文,梅刚,等.老年期抑郁症患者海马磁共振质子波谱研究[J].临床精神医学杂志,2009,19(4):227-229.
[11] Mielke J G,Ahuja T K,Comas T,et al.Choline-mediated depression of hippocampal synaptic transmission[J].Nutr Neurosci,2011,14(5):186-194.
[12] Husarova V,Bittsansky M,Ondrejka I,et al.Hippocampal neurometabolite changes in depression treatment:A1H magnetic resonance spectroscopy study[J].Psychiatry Res,2012,201(3):206-213.
[13] De Diego-Adeli?o J,Portella M J,Gómez-Ansón B,et al.Hippocampal abnormalities of glutamate/glutamine,N-acetylaspartate and choline in patients with depression are related to past illness burden[J].J Psychiatry Neurosci,2013,38(2):107-116.
[14] Arnone D,McIntosh A M,Ebmeier K P,et al.Magnetic resonance imaging studies in unipolar depression:systematic review and meta-regression analyses[J].Eur Neuropsychopharmacol,2012,22(1):1-16.
[15] Videbech P,Ravnkilde B.Hippocampal volume and depression:a meta-analysis of MRI studies[J].Am J Psychiatry,2004,161(11):1957-1966.
[16] Frodl T,O'Keane V.How does the brain deal with cumulative stress?A review with focus on developmental stress,HPA axis function and hippocampal structure in humans[J].Neurobiol Dis,2013,52:24-37.
[17] Shen Z,Cheng Y,Yang S,et al.Changes of grey matter volume in first-episode drug-naive adult major depressive disorder patients with different age-onset[J].Neuroimage Clin,2016,12:492-498.
(收稿日期:2019-08-26) (本文編辑:郎序莹)
