不同功能基团对氧化石墨烯生物相容性影响的研究*
2019-04-20王丽丽黄庆利
王丽丽,黄庆利
(1. 徐州医科大学临床医学系,徐州 221004;2. 徐州医科大学基础医学院,徐州 221004)
1 引 言
石墨烯(graphene)作为一种sp2杂化的新型二维碳纳米材料[1-2],由于其独特的物理和化学性质,原料易得,价格低廉,被普遍应用于生物传感器、化学储能、环境保护等众多领域[2-3]。石墨烯的氧化产物氧化石墨烯(graphene oxide,GO),相比之下具有较高的比表面积,丰富的含氧活性官能团(如-OH,-COOH)等特点,近年来越来越多的被作为基因和抗癌药物载体[4-9]。然而,氧化石墨烯存在动物和细胞毒性、在生理溶液中易聚集难分散等不足[2,6],很多课题组已对其进行表面修饰以改善石墨烯复合材料的生物相容性及控制其体内循环运行[7,10-11]。
本研究分别以3-氨丙基三乙氧基硅烷(APS)、氨基-β-环糊精(β-CDs)、牛血清白蛋白(bovine serum albumin,BSA)作为修饰剂[12-13],通过水热法[14-15]合成了3种不同修饰分子的石墨烯材料。然后通过透射电子显微镜(TEM)、红外光谱(FIIR)、表面电势(Zeta)等手段对其结构和功能进行表征,并且通过 CCK-8 实验对其体外细胞相容性进行了探究。试验结果表明,不同功能基团修饰的石墨烯材料对Hela细胞和MDA-MB-231细胞具有不同的生物相容性。其中GO-APS生物相容性较差,GO-BSA生物相容性最好,该研究为后续进一步功能化修饰及其成为理想的药物载体打下基础。
2 实验部分
2.1 实验材料与仪器
2.1.1实验材料与试剂 石墨烯分散液(2 mg/mL,南京先丰纳米科技有限公司);3-氨丙基三乙氧基硅烷(APS,上海阿拉丁生化科技股份有限公司);全氨基-脱氧β-环糊精(β-CDs,山东滨州智源生物科技有限公司);牛血清白蛋白(BSA,BIOSHARP生物公司);DMEM培养基(江苏凯基生物技术股份公司);PBS缓冲液(江苏凯基生物技术股份公司);胰酶细胞消化液(微科曼得生物工程有限公司);CCK-8试剂盒(微科曼得生物工程有限公司)。
2.1.2实验仪器 JA2003N电子天平(上海精密科学仪器有限公司);磁力搅拌器(江苏天由有限公司);电热恒温鼓风干燥箱(上海精宏实验设备有限公司);透射电子显微镜(美国FEI公司);Zeta电位仪(美国PSS公司);三气培养箱(香港力康生物医疗科技控股有限公司);生物安全柜(香港力康生物医疗科技控股有限公司);台式低速离心机(德国艾本德股份有限公司);多功能微孔板检测仪(基因有限公司)。
2.1.3细胞系 MDA-MB-231乳腺癌细胞、Hela细胞,培养于含有10%胎牛血清(FBS)、1%青霉素/链霉素和90% DMEM培养基中,放置在37 ℃,CO2浓度为 5%的细胞培养箱中,1~2 d更换培养基。
2.2 功能化氧化石墨烯材料GO-APS、GO-CDs和GO-BSA的制备
取15 mL 2 g/L GO水溶液加入30 mL去离子水,超声0.5~1 h使其分散至均匀。随后取标号为①②③的三个反应釜,分别向每个釜加入15 mL GO分散液。在磁力搅拌下,分别向①号釜加入0.2 mL APS,向②号釜加入50 mg β-CD,向③号釜加入100 mg BSA,常温下搅拌30 min,进行活化反应。接着,将装有反应液的反应釜放入电热鼓风干燥箱中反应,100℃,反应6 h后停止,使其自然冷却至室温。
产物用超纯水和乙醇分别离心洗涤3次,加超纯水稀释,配制得到浓度均为400 μg/mL的三种改性氧化石墨烯复合材料,4℃放置备用。
2.3 材料的表征与测试
2.3.1透射电子显微镜(TEM)测试 将样本GO、GO-APS、GO-CDs和GO-BSA配置成低浓度溶液,分别滴在铜网上,自然晾干后,用透射电子显微镜对其进行拍摄,以观察修饰前后氧化石墨烯的整体形貌变化。
2.3.2电势分析(Zeta)测试 将GO、GO-APS、GO-CDs和GO-BSA固体利用NaBr压片,利用红外光谱仪进行测试。
2.4 材料的体外细胞毒性实验
(1)将培养良好的Hela细胞和MDA-MB-231细胞(3~5×105个)经过消化并离心处理后,加入含10%胎牛血清和1%双抗(青霉素/链霉素)的新鲜DMEM培养液中。按每孔100 μL(5~8×103的细胞密度)细胞悬液将其分散在96孔板中(最外围一圈孔板不使用),随后放入培养箱中培养24 h。
(2)待细胞贴壁生长后,吸掉原培养液,用PBS清洗3次后,接着每孔加入100 μL含不同浓度的GO,GO-APS,GO-CDs和GO-BSA的新鲜培养液。这四种材料均有4个不同浓度,分别为20、40、80和160 μg/mL,每种材料和细胞继续培养相同时间,均为24 h。
(3)吸掉原培养液,用PBS清洗3次后,每孔加入 10 μL CCK-8溶液和90 μL DMEM培养液,每种材料和细胞继续培养相同时间,均为1 h。用酶标仪检测各个孔在450 nm处吸光值(A)。
(4)实验均以不加任何材料处理的细胞作对照组,每组数据来自5个平行样本。
细胞存活率=(OD实验组- OD空白)/(OD对照组-OD空白)×100%
OD实验组为材料处理细胞后,在96孔板中利用酶标仪上所得吸光值, OD空白为未加细胞,只有培养液和CCK溶液的吸光值(修饰后的GO对450 nm处吸光值无影响),OD对照组为不加任何材料、只有细胞和培养液的吸光值。且OD值均用均数±标准差表示。
2.5 统计学处理
本实验结果使用SPSS 20.0统计软件进行统计分析,组间比较采用单因素方差分析(OneWayANOVA),以P<0.05表示差异有统计学意义。用Origin 8.5软件作图。
3 结果和讨论
3.1 GO、GO-APS、GO-CDs和GO-BSA的透射电镜结果
不同修饰分子修饰的GO形貌上会发生一定变化。为了研究3种修饰分子在GO表面的修饰情况,我们利用透射电子显微镜对样品进行了表征[16]。图1是未修饰的GO和不同分子修饰的GO的透射电子显微镜照片,从图1A中我们发现,未修饰的GO为透明的薄片状结构,有明显褶皱存在。当APS修饰后,其整体结构不变,但透明度略有降低,这主要是APS分子量较小导致其表面变化不明显,见图1B。BSA修饰后,见图1C,GO明显变得基本不透明,有一层糊状物质覆盖在GO表面,这主要是BSA作为蛋白其可以通过静电吸附等作用结合在GO表面。而当环糊精CD修饰后,由于我们所用环糊精表面含有氨基使其能够连接到GO表面,见图1D,在GO表面我们也发现CD覆盖。
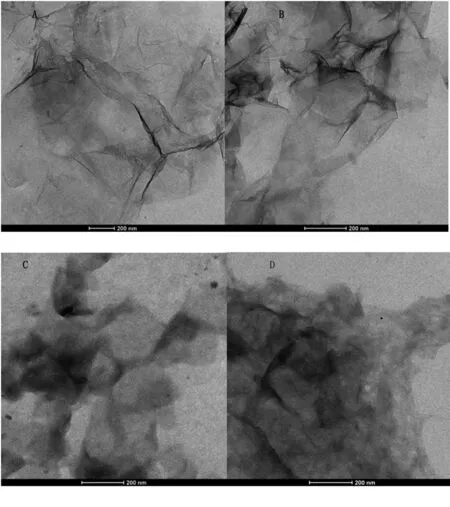
A.氧化石墨烯;B.乙氧基硅烷修饰氧化石墨烯;C.牛血清蛋白修饰氧化石墨烯;D.环糊精修饰氧化石墨烯
图1GO和GO-APS、GO-CDs和GO-BSA透射电镜图
Fig1TransmissionelectronmicrographsofGOandGO-APS,GO-CDsandGO-BSA
3.2 GO、GO-APS、GO-CDs和GO-BSA的红外光谱结果
红外光谱可以用来检测材料微观结构的变化及存在的界面相互作用[16]。GO、 GO-APS、GO-CDs和 GO-BSA的红外光谱见图2。图中1633 cm-1和1380 cm-1处为芳基羧酸中-COOH的特征吸收峰。当APS修饰后,其峰位位移到1508 cm-1和1269 cm-1处,主要是APS修饰后,GO化学环境发生改变从而导致其特征峰位移。同样的道理,当CD和BSA修饰后,其峰位置也明显发生改变,说明CD和BSA成功修饰[17],这与前面透射电子显微镜的结果相一致。
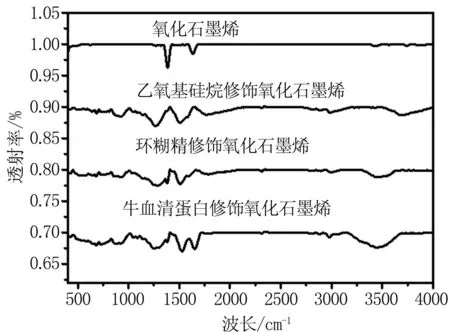
图2 GO和GO-APS、GO-CDs和GO-BSA红外光谱图
3.3 GO、GO-APS、GO-CDs和GO-BSA的Zeta电位结果
为了进一步研究各种修饰剂的修饰情况,我们通过Zeta电位仪测试各个样品的Zeta电位,见图3。结果表明GO的Zeta电位为负值。但当修饰了环糊精后其电位变成了正值,而修饰APS和BSA后,其Zeta电位为负值,虽然依然为负值,但其数值明显较纯GO的Zeta电位更低,这和这些修饰分子本身的特性有关。通过Zeta电位研究,进一步证明了3种分子成功修饰到了GO表面,我们可以根据后续工作的需要选择不同的修饰分子。
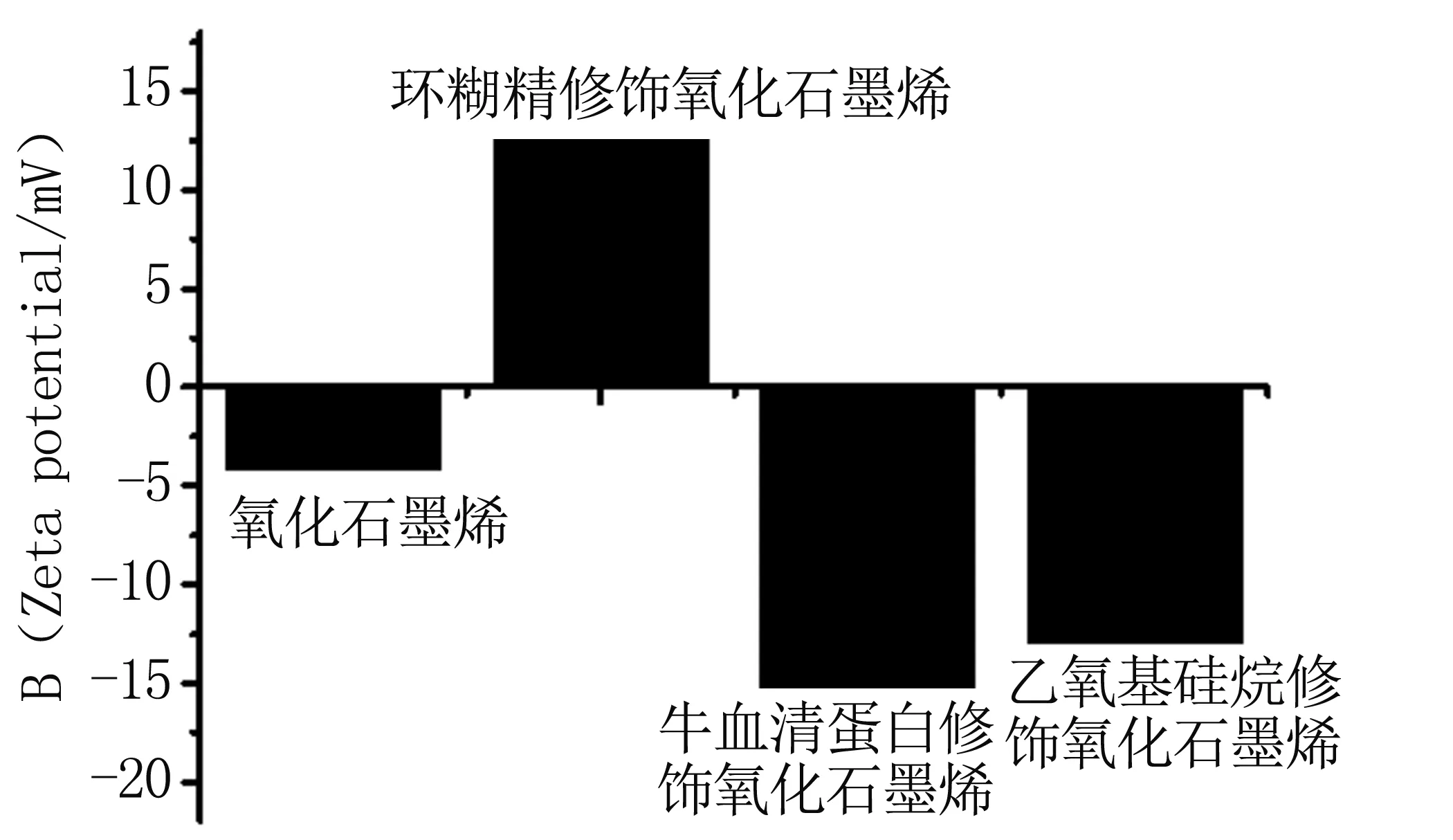
图3 GO和GO-APS、GO-CDs和GO-BSA的Zeta电位图
3.4 GO、GO-APS、GO-CDs和GO-BSA的体外细胞相容性
生物安全性是纳米材料作为药物载体的重要条件之一,因此我们对合成材料GO、GO-APS、GO-CDs和GO-BSA进行体外细胞毒性检测,CCK-8结果见图4。从图中大体走向趋势可以看出,细胞毒性具有一定的浓度依赖性[18-22],随着四种材料液浓度的增加,细胞的存活率都有一定程度的下降,细胞毒性增加,而且结果均为GO-BSA细胞毒性< GO-CDs细胞毒性< GO-APS细胞毒性。
根据细胞毒性分级指标划归,在MDA-MB-231细胞的试验(图4a)中,GO不但对细胞无毒性作用,甚至有微弱促进细胞生长的效果;GO-APS在浓度达40 μg/mL时,已经具有微弱的细胞毒性;GO-CDs在浓度达80 ug/mL时,具有轻微的细胞毒性;然而GO-BSA即使在最高浓度 160 μg /mL 条件下,仍无明显的细胞毒性,存活率在85%以上。在Hela细胞的试验(图4b)中,APS修饰的GO甚至比GO具有更高的细胞抑制率,β-CD和BSA修饰后的GO,细胞毒性有明显减小。各组差异均有统计学意义(P<0.05)。综上所述,纳米石墨烯的细胞毒性和细胞种类有一定关系[20-22], GO-APS即使在低浓度(20 μg /mL)对Hela细胞都有明显毒性,而GO-CDs和GO-BSA在100 μg /mL以内,基本对两种细胞均无毒性。因此,GO-CDs和GO-BSA可以作为药物载体的优先选择。
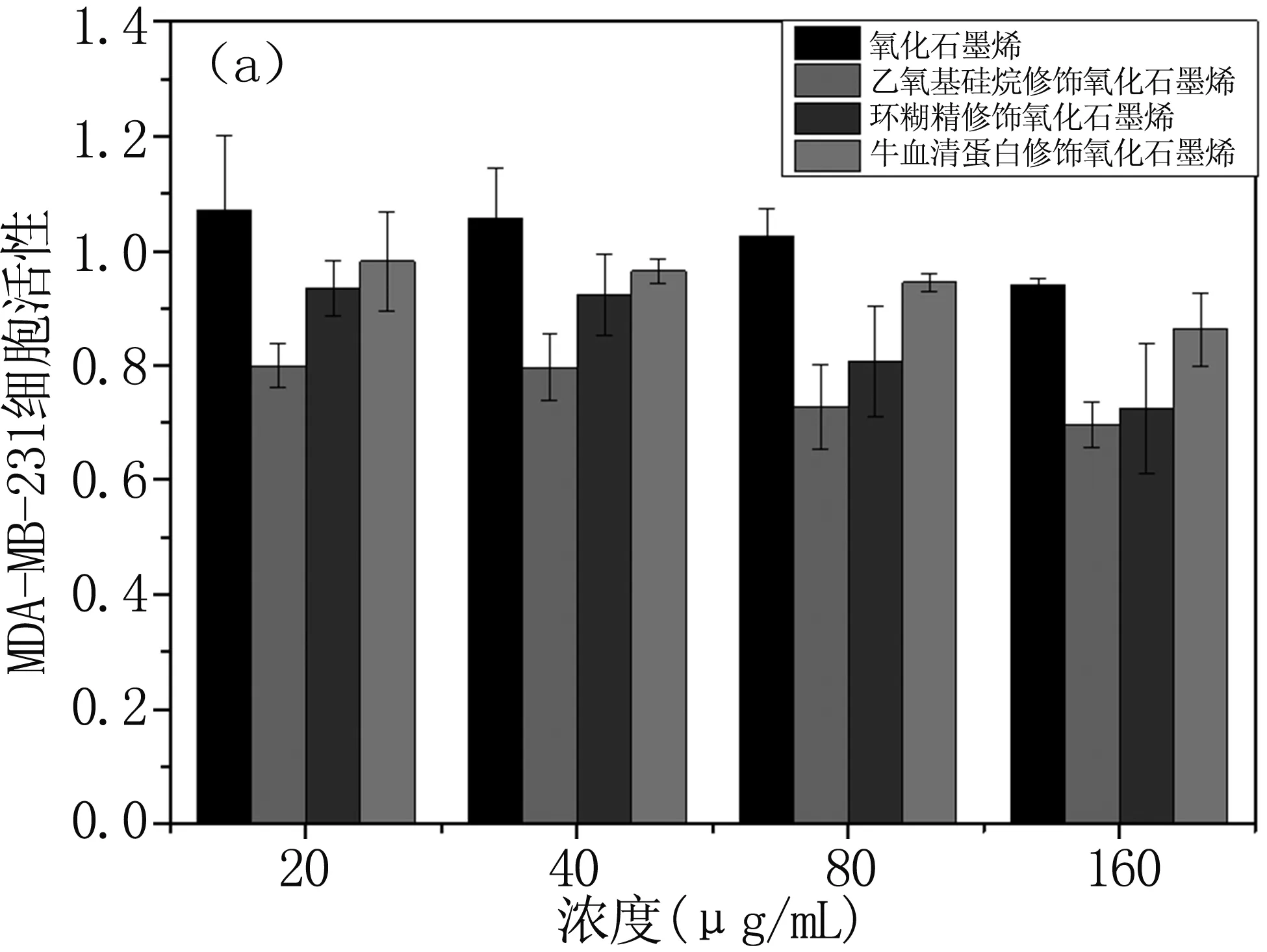
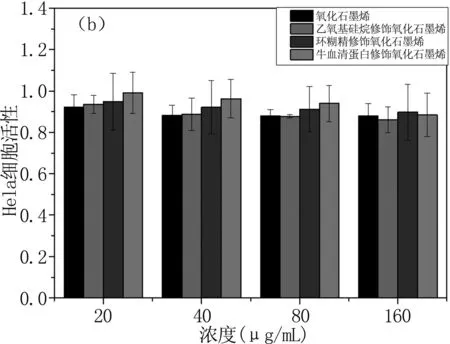
图4 GO和GO-APS、GO-CDs和GO-BSA的细胞相容性结果
Fig4CellularcompatibilityresultsofGOandGO-APS,GO-CDs,andGO-BSA
4 结论
我们首先采用水热法一步合成了官能化修饰的氧化石墨复合纳米材料。通过透射电子显微镜、红外光谱和zeta电位表征,这些分子被成功修饰到GO表面。同时我们还研究了这些修饰后的GO的细胞相容性,结果发现不同修饰材料具有不同的生物相容性。其中CD和BSA修饰的GO基本无生物毒性。这将为进一步拓宽石墨烯功能化复合纳米材在医药领域的应用奠定了一定基础。
