上转换介孔二氧化硅多功能肝癌诊疗纳米复合体系的构建*
2019-04-20杨涵陈星濛高俊潇武晓丽常津
杨涵,陈星濛,高俊潇,武晓丽,常津
(天津大学,天津 300072 )
1 引 言
肝细胞癌(HCC)占原发性肝癌的75%~85%,居癌症死亡率第四位,严重威胁人类健康[1-2]。临床肝癌治疗方法包括如下:肝部分切除术(PHx),该方法多适用于早期肝癌患者的治疗,且复发率较高[3];化疗,其应用受限于化疗药物对机体的副作用和病灶部位浓度低[4]。而作为肝癌治疗的唯一分子靶向药物索拉菲尼(sorafenib,S),也由于其多次给药,造成多种器官不同程度退化或增生等副作用。鉴于此,迫切需要新的、更有效的肝癌治疗方法[5]。
光热治疗(PTT)由于其针对性高,对正常部位附带损伤少,近年来已广泛应用于肿瘤治疗,并取得了较好疗效[6-8]。在光热治疗中,近红外(NIR)光通过纳米材料被转换成局部热能,诱导癌细胞的凋亡或坏死[9-10]。吲哚箐绿(ICG)是FDA批准的唯一近红外波长区域试剂[11],它可通过将吸收的光能转化产生热量、有毒化学物质和单线态氧ROS,造成肿瘤组织的坏死和凋亡[12]。
介孔二氧化硅以其介孔结构可控、比表面积高、生物相容性好等特性,被广泛应用于抗肿瘤治疗[13-15]。此外,上转换纳米颗粒(UCNP)吸收NIR光之后发生电子的跃迁[16],可实现高灵敏度高信噪比的荧光成像,这一特性也减少了传统荧光纳米颗粒成像需要用紫外光激发所造成的损伤[17],增加了安全性。
本研究利用负载ICG和S的上转换包二氧化硅纳米颗粒,用于肝癌治疗。该复合纳米系统同时集成了荧光成像,免疫调节药物和光热治疗等功能。我们首先对(ICG +S)@ UCNPmSiO2纳米颗粒的理化特征进行系统评估,随后检测了两种物质的负载率,药物释放效率及ICG的光热效力。最后,利用HepG2细胞系在体外检测该纳米颗粒的生物安全性,及其被肿瘤细胞吞噬作用,最终探究其肿瘤杀伤效率,为该纳米颗粒用于肝癌的治疗提供了良好的理论依据。
2 材料和方法
2.1 实验试剂
材料:吲哚箐绿 (ICG, 美国药典(USP)参考标准),正硅酸乙酯 (TEOS, ≥99%), 十六烷基三甲基溴化铵 (CTAB, ≥99%), 氯化钠 (NaCl,≥99.0%), 氢氧化钠(NaOH, ≥98%),六水合氯化铒(III) (ErCl3·6H2O, 99.99%), 氯化镱(III)六水合物 (YbCl3·6H2O, 99.99%), 钆(III)氯六水合物 (GdCl3·6H2O), 油酸(90%), 十八烯(90%), 氟化铵(NH4F, 99.99%), 二甲基亚砜 (DMSO, 99.99%),均购于Sigma-Aldrich.
2.2 实验方法
2.2.1上转换纳米颗粒(UCNP)的制备 NaYF4:Yb,Er上转换颗粒如下合成:将0.625 g NaOH,12 mL水,6 mL乙醇,24 mg GdCl3·6H2O,100 mg YbCl3·6H2O,12 mg ErCl3·6H2O,6 mL油酸和15 mL十八烯(ODE)在50 mL烧杯中混合。将溶液加热至40℃,加入0.7 g NH4F并搅拌30 min。随后将溶液在180℃下转移至反应釜中12 h。溶液自然冷却后,用乙醇离心沉淀,环己烷洗涤3次。 最后,将上转换颗粒重悬于2 mL环己烷中[18]。
2.2.2载药介孔二氧化硅上转换纳米颗粒(S+ICG)@UCNPmSiO2的制备 将2.2.1制备的上转换纳米颗粒2 mL,与7 mL乙醇,0.09 g CTAB和70 μL NaOH溶液(2 M)共同溶解于18 mL水中,加热至80℃搅拌30 min。迅速加入350 μL TEOS,在80℃下混合1 h后结束反应,离心分离并使用乙醇纯化。将产物分散于20 mL乙醇中,加入NaCl 0.65 g,70℃搅拌6 h后离心,并用ddH2O纯化两次。将介孔二氧化硅上转换纳米颗粒转移至4 mL离心管中,在室温下离心并分散于4 mL乙醇中。
将5 mg ICG加入5 mL UCNPmSiO2水溶液中。将S溶解于DMSO中,浓度为3 mg / mL。在室温下搅拌24 h后,离心并用水洗涤3次。最后,将产物重新悬浮于4 L水中以供下一步使用。
2.2.3(S+ICG)@UCNPmSiO2纳米颗粒表征及药物缓释检测 利用zetasizer nano系列(Malvern仪器)在室温下收集有效粒度分布和Zeta电位; 利用JEOL TEM 2010F透射电子显微镜上以明场模式在200 kV的操作电压下,获取该纳米颗粒的形貌图片。使用荧光分光光度计(AVANTES Co.Ltd AvaSpec-ULS2048-USB2(1501085U1))对纳米颗粒的荧光发射光谱进行表征,使用UV-2450PC Shimadzu紫外-可见光分光光度计对纳米颗粒的吸收光谱进行表征。
通过紫外-可见光分光光度计检测0~0.1 mg/mL范围内不同浓度S和ICG溶液,根据其吸收峰值做标准曲线。随后检测测试(S+ICG)@UCNPmSiO2纳米颗粒中S和ICG吸收峰,计算S和ICG的载药量。
将(S+ICG)@UCNPmSiO2纳米颗粒溶于不同pH条件,室温下震荡缓释。不同的时间点收取相同体积的溶液,离心取上清,并测定上清中缓释药物峰值,计算药物释放量并绘制药物缓释曲线。
2.2.4(S+ICG)@UCNPmSiO2纳米颗粒光热效率表征 将不同组别样品置于石英比色器中进行体外ICG光热效率检测。用1.6 W/cm2激光照射样品10 min,同时用红外热成像相机(Ti27, Fluke, USA)每30 s记录一次温度变化,并绘制温度曲线。
2.2.5(S+ICG)@UCNPmSiO2纳米颗粒安全性、内吞效率及杀伤性检测 采用甲基噻唑啉四唑(MTT)为基础体外实验方法,对ICG、S和(S+ICG)@UCNP mSiO2纳米颗粒生物安全性进行研究。HepG2细胞以1×104个细胞/孔的密度接种于96孔板中孵育24 h。添加ICG、S和(S+ICG)@UCNP mSiO2纳米颗于完全培养基中37℃孵育24 h。每孔加入20 μL MTT溶液,继续孵育4 h后加入DMSO溶解甲臜。每孔吸光度由微平板阅读器(型号680,Biorad)检测。与未处理的细胞(100%存活率)相比计算存活率。
选取适宜浓度的纳米颗粒并检测HepG2细胞中对其内吞情况,利用荧光显微镜检测其内吞效率。PBS洗涤细胞,多聚甲醛固定(4%),DAPI(4′,6-二氨基-2-苯基吲哚)染色,最后用倒置Olympus荧光显微镜(IX-51)观察细胞摄取情况。
选取适宜浓度的ICG、S、UCNP mSiO2以及(S+ICG)@ UCNP mSiO2纳米颗粒,同一时间激光照射后,用PBS冲洗细胞并染色。光热处理的细胞毒性由钙黄绿素/碘化丙啶染色,根据结果分析纳米颗粒细胞杀伤功能。
3 实验结果
3.1 (ICG+S)@UCNP m SiO2纳米颗粒表征
(ICG+S)@UCNPmSiO2纳米颗粒合成后,我们首先利用透射电子显微镜(TEM)探究其详细形态特征。合成的UCNPmSiO2(见图1A)和(ICG + S)@ UCNPmSiO2(见图1B)均具有良好的单分散性和清晰的轮廓。动态光散射(DLS)测量结果显示,UCNP,UCNPmSiO2,(ICG + S)@ UCNPmSiO2纳米颗粒的流体动力学直径分别约为41、148和149 nm(见图1C)。负载ICG和S后,动态光散射粒径大小显示无明显差异。此外,我们还测定了该纳米颗粒中各物质特征峰。ICG在约600~800 nm出现两个连续峰谱,最大值为781 nm,S的紫外吸收峰峰值则出现在265 nm,而mSiO2颗粒在紫外无吸收峰(见图1D)。在(ICG+S)@UCNP mSiO2纳米颗粒的紫外吸收峰谱中,我们检测到其在600~800 nm和265 nm具有ICG和S的特征吸收峰,从而证实ICG和S已成功负载到UCNP mSiO2纳米颗粒。我们同时检测了(ICG+S)@ UCNPmSiO2的荧光光谱。在980 nm光激发下,(ICG+S)@ UCNPmSiO2在525 nm和655 nm附近产生独特的发射波峰(见图1E),与UCNP的发射波峰一致。
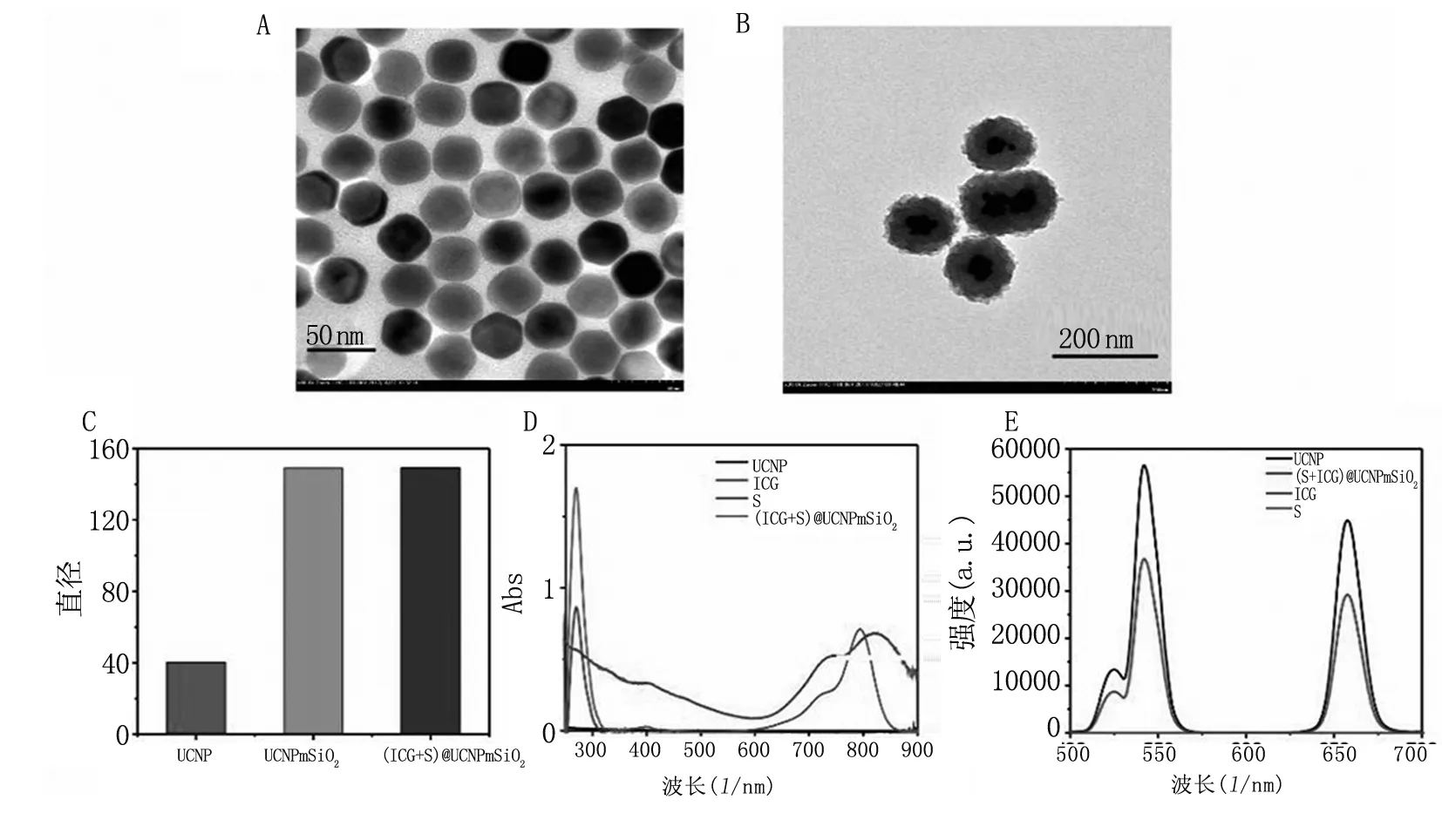
图1AUCNP纳米颗粒的TEM图像;B. (ICG+S)@UCNPmSiO2纳米颗粒的TEM图像;C.不同纳米颗粒粒径;D.ICG、S、UCNPmSiO2和(ICG+S)@UCNPmSiO2的紫外-可见吸收光谱;E.UCNPmSiO2,ICG@UCNPmSiO2,S@UCNPmSiO2,(ICG+S) @UCNPmSiO2的荧光光谱
Fig1ATEMimagesofUCNPnanoparticles;B.TEMimagesof(ICG+S)@UCNPmSiO2nanoparticles;C.Particlesizeofdifferentgroupsaftereachmodification;D.TheUV-visabsorptionspectrumforICG,Sorafenib,UCNPand(ICG+S)@UCNPmSiO2;E.ThefluorescencespectrometerofUCNPmSiO2,ICG@UCNPmSiO2,S@UCNPmSiO2and(ICG+S)@UCNPmSiO2underUVlightexposure
3.2 (ICG+S)@ UCNP mSiO2纳米颗粒中ICG和S的负载及缓释
我们利用紫外-可见(UV-vis)光谱检测了(ICG+S)@ UCNP mSiO2纳米颗粒负载两种药物的效率。见图2A,S和ICG的负载率分别达8.03%和10.21%。此外,通过在pH=7.4和pH=5.5两种条件下的药物释放实验,我们发现两种物质均随时间升高,释放比例升高。在接近体内外周水平的pH=7.4时,96hICG和S释放量分别达到35%和10%,而在接近肿瘤细胞内部的pH=5.5情况下,ICG和S的释放量显著增加至41%和15%,见图2B。
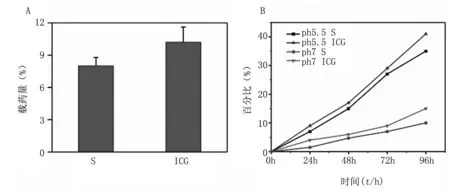
图2A.(ICG+S)@UCNPmSiO2纳米粒中S和ICG的载药率;B.pH=7.4和pH=5.5时ICG和S的药物释放量
Fig2A.Thedrugloadingratesofthetwodrugsin(ICG+S)@UCNPmSiO2nanoparticles;B.drugreleaseofICGandSby(ICG+S)@UCNPmSiO2nanoparticlesinpH=7.4andpH=5.5,respectively
3.3 (ICG+S)@ UCNP mSiO2纳米颗粒的光热性能表征
由于肿瘤细胞的热敏感性,即43℃的温度可损伤肿瘤细胞。因此,我们拟利用ICG的光热效应实现肝癌肿瘤细胞杀伤,并检测了不同组别(PBS对照,ICG和(ICG+S)@ UCNP mSiO2)的光热效应。见图3A,808 nm近红外激光激发后,PBS仅从26.8℃升高至约27.6℃,温度未发生明显的变化;ICG溶液的温度随照射时间持续迅速升高;而(ICG+S)@UCNPmSiO2纳米颗粒溶液,在10 min内温度从28.2℃增加至50.8℃,见图3A,其光热性能较为温和,可在杀死肿瘤细胞的同时,避免ICG组温度迅速升高的不可控性。根据上述三组温度变化,绘制温度变化曲线,见图3B。

图3不同时间点PBS、ICG、(ICG+S)@UCNPmSiO2的光热图像及其温度变化曲线
Fig3PhotothermalimagesofPBS,ICG, (ICG+S)@UCNPmSiO2indifferenttimepointsandtheirtemperatureprofiles
3.4 (ICG+S)@ UCNP mSiO2纳米颗粒生物安全性,细胞摄取及杀伤功能研究
利用HepG2细胞系,通过MTT测定纳米颗粒的生物安全性。见图4,随着纳米颗粒浓度降低,细胞存活率升高。当浓度为300 mg/L时,四个样品组的存活率均高于70%,表明该浓度以下,(ICG+S)@ UCNP mSiO2纳米颗粒具有较好的生物安全性。
利用倒置荧光显微镜观察HepG2细胞对(ICG+S)@ UCNPmSiO2的摄取。将纳米颗粒与HepG2细胞孵育4 h后,检测该颗粒被内吞的效果。图5A显示细胞在明场照射下的形态,红色荧光显示ICG的定位,见图5B;绿色荧光显示UCNP的定位,见图5C;蓝色荧光显示DAPI标记的HepG2细胞核,见图5D。图5E为荧光图片的总merge图,(ICG+S)@ UCNPmSiO2被HepG2细胞成功内吞。
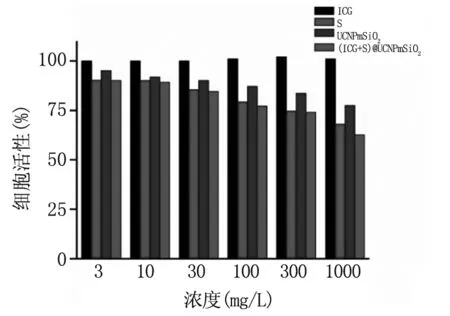
图4用ICG、S、UCNPmSiO2和(ICG+S)@UCNPmSiO2纳米颗粒处理HepG2细胞48h后的细胞存活率
Fig4RelativeviabilitiesofHepG2cellsaftertreatmentwithICG,S,UCNPmSiO2and(ICG+S)@UCNPmSiO2nanoparticlesfor48h
在培养基中加入不同浓度(S+ICG)@ UCNP mSiO2纳米颗粒,ICG,S和UCNP mSiO2。其中,ICG和(S+ICG)@ UCNP mSiO2纳米颗粒组进行808 nm激光照射,计算细胞凋亡率。见图6,与对照组相比,UCNPmSiO2组没有细胞杀伤效果,S组杀伤HepG2细胞效果显著增加(P<0.01)。而在激光照射条件下,ICG由于其激光照射产生的光热效应显示出优异的细胞杀伤效果。 (ICG+S)@UCNPmSiO2纳米颗粒同单一的细胞免疫治疗与光热治疗相比,治疗效果显著增强。

图5 (ICG+S)@UCNPmSiO2纳米颗粒被HepG2细胞内吞的荧光图像
Fig5Fluorescenceimagesof(ICG+S) @UCNPmSiO2nanoparticlesendocytosedbyHepG2cells
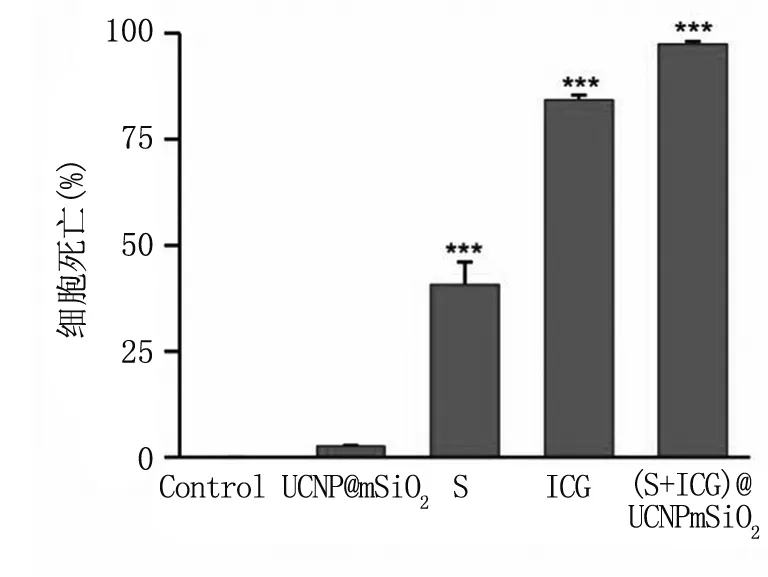
图6用ICG、S、UCNPmSiO2和(ICG+S)@UCNPmSiO2纳米颗粒对HepG2细胞并进行激光照射后的细胞凋亡
Fig6PercentageofapoptosiscellsaftertreatmentofHepG2cellswithICG,S,UCNPmSiO2and(ICG+S)@UCNPmSiO2nanoparticlesandlaserirradiation
4 结论
我们成功地制备吲哚菁绿(ICG)和索拉菲尼(S)共载的上转换介孔二氧化硅纳米颗粒((ICG + S)@UCNPmSiO2)。将UCNP的荧光成像作用,ICG的热效应及S的分子靶向治疗作用有机结合于介孔二氧化硅纳米颗粒中,形成肝癌诊疗一体化纳米复合体系。在本研究中,该体系表现出优异的荧光稳定性和灵敏的温度响应。此外,(ICG+S)@ UCNPmSiO2具有良好的生物安全性和肿瘤杀伤效果,是一种具有潜力的肿瘤诊疗一体化体系。
