纳米Fe2O3/TiO2复合材料用于吸附与氧化除As(Ⅲ)
2019-04-20赵红艳石中亮
赵红艳, 陈 爽, 石中亮
(沈阳化工大学 应用化学学院, 辽宁 沈阳 110142)
砷是一种广泛存在于土壤和水体中的有毒物质,其对人体危害巨大,且存在一系列副作用,严重破坏生态系统的正常发展[1-2].因此,去除水体中砷污染成了各国学者广泛关注的焦点.目前,去除水体中砷的方法有沉淀法、电凝聚法、膜处理法、离子交换法、生物法、氧化法和吸附法等[3].吸附法由于其简单易行、处理量大、去除效率高等特点深受广大学者的追捧[4-5].
比表面积的大小是评价一种吸附剂的重要标准.纳米材料因其比表面积大,表面活性官能团丰富等优点在众多吸附剂中脱颖而出.武荣成等[6]制备的磁性吸附材料CuFe2O4方法简单且能够循环使用,对As(Ⅴ)的吸附能力比对As(Ⅲ)更强.而As(Ⅲ)的毒性远大于As(Ⅴ)且更难去除.王强等[7]研究了赤铁矿(α-Fe2O3)对三价砷离子的吸附和氧化特征,表明赤铁矿对As(Ⅲ)有很好的氧化作用,且随温度升高其氧化率增大,但该种吸附剂寿命短,不利于重复使用,且容易造成二次污染.有研究表明二氧化钛在氧化和吸附砷方面能力优越[8],且对As(Ⅲ) 和As(Ⅴ)均有良好的吸附效果[9-11].通过调节溶液的酸碱度可以使吸附在TiO2表面的砷完全解析下来,实现吸附剂循环再生使用[12-13].改变形态、负载[14]或掺杂铁、铈、氮等[15-16]离子能够增加其比表面积,增强对紫外及可见光的吸收,从而大大提高二氧化钛的氧化和吸附性能[17-23].因此,制备出比表面积大、氧化和吸附能力强的Fe2O3/TiO2复合材料对水体中砷的去除有重要作用.
1 实验部分
1.1 铁醇盐的制备
铁醇盐按照Chen等[9]使用的方法进行制备.反应在三口烧瓶中进行,将1.1 g(4.08 mmol) FeCl3· 6H2O、2.2 g(36.6 mmol) 尿素和6 g(18.6 mmol) 四丁基溴化铵(TBAB) 溶解在180 mL乙二醇中,得到红色溶液.180 ℃下磁力搅拌50 min,得到黄绿色固体.冷却至室温,用乙醇和水清洗数次,收集固体,在80 ℃下恒温干燥即得到铁醇盐.
1.2 纳米Fe2O3/TiO2复合材料的制备
称取一定量的铁醇盐,加入20 mL无水乙醇,搅拌30 min,将其慢慢滴加到120 mL、60 ℃的蒸馏水中,维持一段时间得到溶液A;量取20 mL钛酸丁酯溶于30 mL无水乙醇中,得到溶液B;在60 ℃水浴条件下,将溶液B慢慢滴加到溶液A中,控制滴加速度不大于30 D/min,得到白色悬浊液,继续搅拌2 h,陈化12 h.沉淀经蒸馏水乙醇清洗数次后80 ℃真空干燥6 h.将固体分别在300 ℃、400 ℃、500 ℃、600 ℃、700 ℃下煅烧4 h.采用同样的方法制备纯的TiO2样品,并在400 ℃热处理4 h.
1.3 光催化剂的结构表征
采用RigakuD/MAX-2550 PC型X射线衍射仪(XRD)分析材料的晶相结构,用JEOL JEC-1600扫描电镜(SEM)表征催化剂的微观形态,用岛津UV-2550型紫外-可见(UV-Vis) 漫反射光谱仪测定材料对光的吸收.
1.4 除砷方法
氧化及吸附砷实验在XPA-3光化学反应仪中进行,光源为500 W的紫外灯.砷溶液质量浓度为10 mg/L,吸附剂质量浓度为0.5 g/L.研究不同条件对去除砷的影响.(1)pH对吸附和氧化的影响,pH为2~10,氧化实验在达到吸附平衡后进行;(2)吸附动力学,反应时间为5~200 min;(3)吸附等温线,吸附等温线实验在20 ℃下进行,砷质量浓度为0.5~100 mg/L,黑暗条件下磁力搅拌10 h.实验中砷溶液浓度采用SK-2003AZ型原子荧光光谱仪进行测量.
2 实验结果与讨论
2.1 扫描电镜
纳米Fe2O3/TiO2复合材料的扫描电子显微镜图片如图1所示.

从图1中可以看出:与其他样品相比400 ℃煅烧的样品分散性好,颗粒完整且空隙均匀;随着温度升高样品团聚现象逐渐严重,空隙变得不均匀,分散性逐渐降低;温度达到700 ℃时其颗粒坍塌变形且相互黏连,孔道结构不清晰,块状结构明显.可见温度过高容易使样品发生团聚,造成晶粒增大,比表面积减小.同时,过高的煅烧温度会使二氧化钛的晶相向金红石型转变.有文献表明[24]二氧化钛在煅烧温度为600 ℃时,开始从锐钛矿向金红石相发生转变,温度升高到800 ℃时其晶相已全部转变为金红石型.说明温度对其表面的形貌结构和晶型影响较大,对于孔径和粒径的控制有很大作用.
2.2 X射线衍射
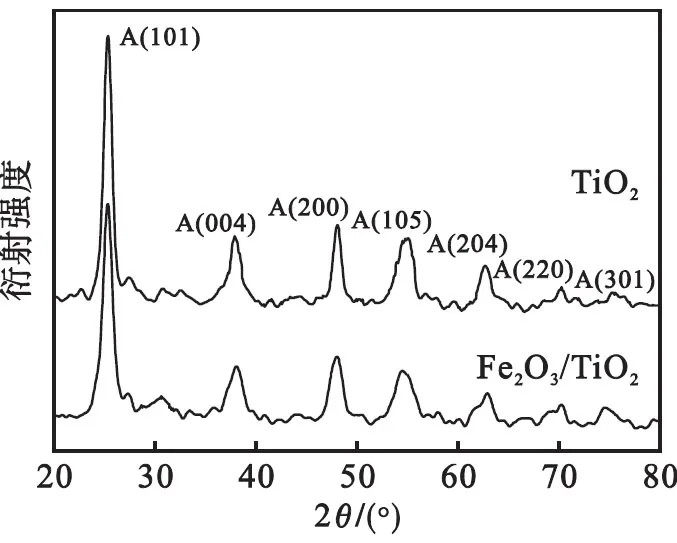
图2为实验制备的纯二氧化钛和纳米Fe2O3/TiO2复合材料在400 ℃煅烧的XRD射线衍射图.XRD图显示:纳米Fe2O3/TiO2复合材料和未添加铁醇盐的样品均在2θ为25.35°、37.90°、48.05°、54.50°、62.70°、70.25°、74.65°等处出现衍射峰,其分别对应了(101)、(004)、(200)、(105)、(204)、(220)、(301),为锐钛矿结构TiO2衍射峰,说明该温度下煅烧的样品为单一锐钛矿相.与未添加铁醇盐的样品相比,Fe2O3/TiO2复合材料的衍射峰半峰宽明显变宽.根据Scherrer公式,半峰宽变宽说明其晶粒减小.因此,氧化铁的加入抑制了二氧化钛晶粒的生长.图中没有出现铁氧化物的特征峰,其原因可能是Fe3+(0.064 nm) 与Ti4+(0.061 nm) 的半径相似,Fe3+进入了TiO2晶格,或者是铁氧化物没有完全形成晶体,而是大部分以无定形态存在且呈高度分散状态[25];也可能是由于铁氧化物含量过低,故没有其XRD信息[26].
2.3 紫外可见漫反射
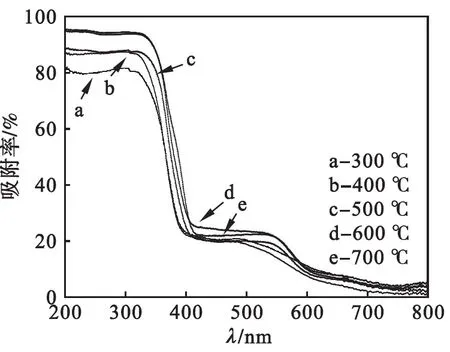
不同温度下煅烧的Fe2O3/TiO2样品的紫外可见漫反射图谱如图3所示.从图3中可以清楚地看出:随着煅烧温度的升高,样品在紫外波长范围内的吸收逐渐增加;紫外漫反射曲线逐渐红移,这说明其对可见光的吸收逐渐提高;600 ℃下煅烧的样品对紫外和可见光的吸收最佳;继续升高温度其曲线有蓝移的趋势,这说明适当升高煅烧温度可能会减小其带隙宽度,从而提高Fe2O3/TiO2复合材料对光的吸收;500~600 nm之间有一个明显的吸收峰,可能是由于铁的加入使Fe2O3/TiO2复合材料中出现Ti—O—Fe结构或者Ti3+在TiO2的价带和导带间形成氧空穴,从而提高了其对可见光的吸收所致.
2.4 氧化及吸附性能
2.4.1 pH影响
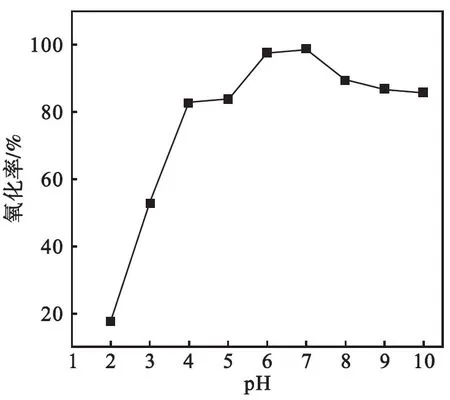
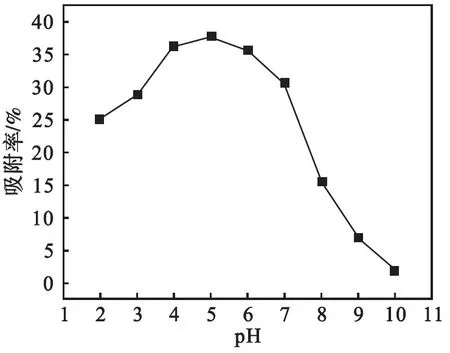
pH在2~10范围内样品的氧化与吸附曲线如图4、图5所示.反应时间60 min.从图4、图5可以看出:增大pH有利于提高样品对As(Ⅲ)的氧化率,pH在4~10范围内样品氧化能力较强;pH在3~7范围内有较好的吸附能力,继续增大溶液pH其吸附率明显下降.
有文献表明[27],亚砷酸在水中的解离为:
(1)
(2)
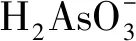
2.4.2 氧化与吸附动力学
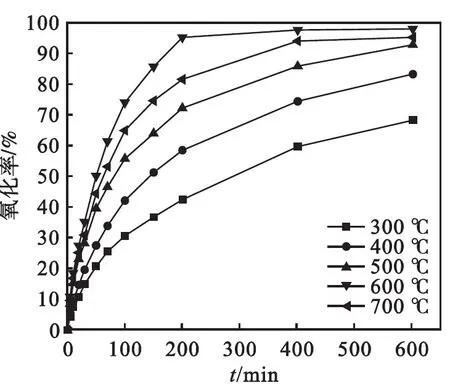
图6为不同煅烧温度下制备的纳米Fe2O3/TiO2复合材料的氧化动力学曲线.实验结果表明:600 ℃煅烧的样品对As(Ⅲ) 的氧化能力最强.说明适量升高煅烧温度能使催化剂的结晶度更好,从而降低光生电子和空穴的复合速率.紫外可见漫反射光谱也表明 600 ℃ 煅烧的样品对光的吸收最佳.
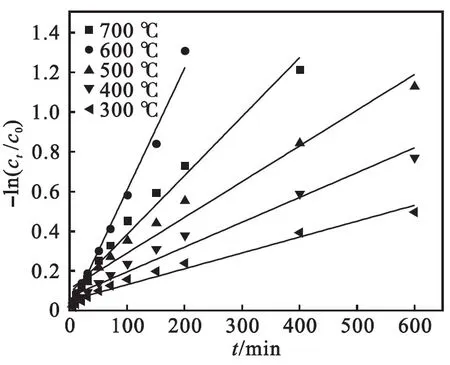
用动力学模型对图6中的数据进行拟合,发现不同温度煅烧的Fe2O3/TiO2复合材料对As(Ⅲ)的氧化过程符合准一级动力学方程.具体拟合过程如下:
R=-dct/dt=kct
(3)
式中R为反应速率,t为反应时间,ct为t时刻As(Ⅲ)浓度,k为反应的表观动力学常数.将上式积分得:
ln(ct/c0)=-kt
(4)
拟合结果见表1和图7.

表1 不同煅烧温度下Fe2O3/TiO2复合材料氧化As(Ⅲ)的动力学线性回归拟合
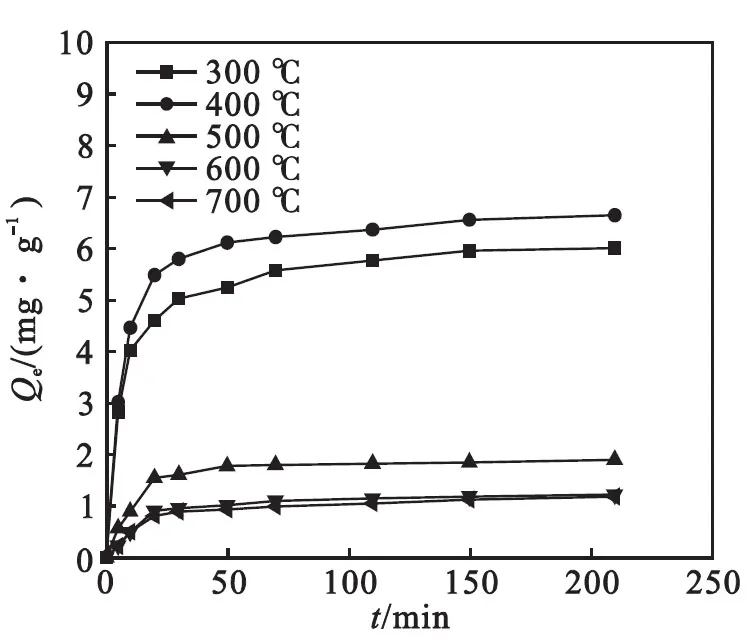
图8为不同煅烧温度下制备的Fe2O3/TiO2复合材料的吸附动力学曲线.从图8中可以看出:吸附过程在开始阶段速度很快,随着时间的推移逐渐变慢,到1 h基本达到平衡.
用动力学模型对其数据进行拟合,发现不同温度煅烧的Fe2O3/TiO2复合材料对As(Ⅲ)的吸附过程均符合准二级动力学标准,得到拟合相关系数均在0.99以上.拟合过程如下:
dqt/dt=k(qe-qt)2
(5)
两边同时积分整理得:
(6)
其中:qe和qt分别为吸附平衡时和任意时刻的吸附量(mg/g) ,k为二级吸附速率常数[g/(mg · h)],t代表平衡时间(h).以t/qt对t作直线可得qe和k,拟合曲线见图9,结果见表2.由表2和图9可知:5种不同样品的拟合数据与实验测得的平衡吸附量基本一致,分别为6.172 8、6.784 3、1.968 1、1.309 1、1.257 2,拟合系数接近1.说明Fe2O3/TiO2复合材料与As(Ⅲ)之间的化学作用是限制吸附的关键步骤[29].
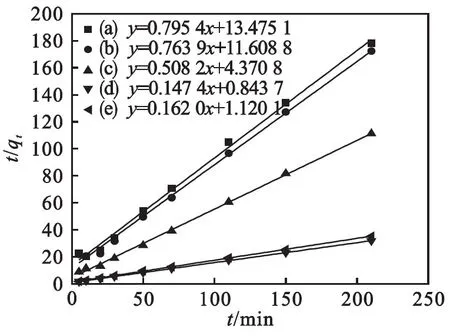
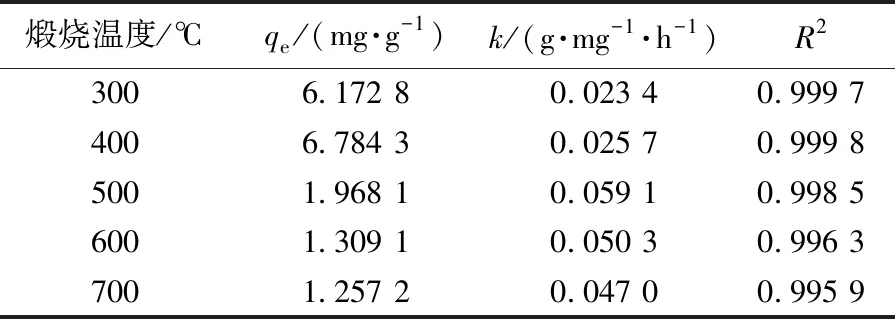
表2 不同煅烧温度下Fe2O3/TiO2复合材料吸附 As(Ⅲ) 的动力学线性回归拟合
2.4.3 吸附等温线
不同样品在20 ℃、pH为7对As(Ⅲ)吸附等温线如图10所示.
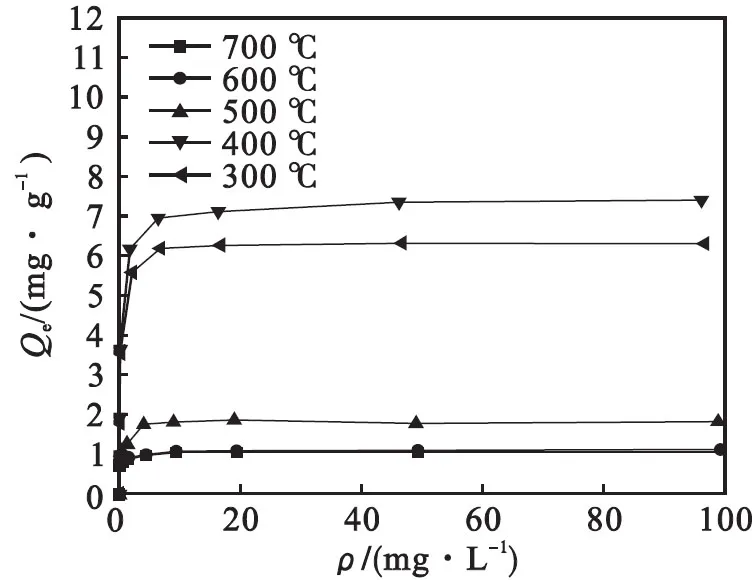
将吸附等温线分别用Langmuir方程和Freundlich方程进行拟合.
(1) 吸附等温线用Langmuir方程模拟:
Qe=bQmaxρe/(1+bρe)
(7)
改写成
(8)
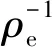
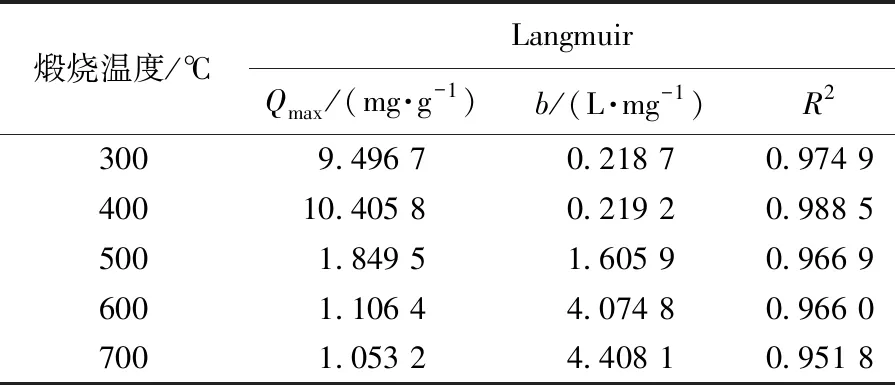
表3 不同煅烧温度下Fe2O3/TiO2复合材料吸附As(Ⅲ)的Langmuir方程参数
(2) 吸附等温线用Freundlich方程模拟:
lgQe=lgKF+nflgρe
(9)
式中,KF为Freundlich吸附系数(mg/g),nf为吸附常数.以lgQe对lgρe作直线可得KF和nf,结果见表4.拟合结果显示:用Langmuir模型拟合的相关系数R2均高于Freundlich模型,说明Langmuir吸附等温方程更适合描述Fe2O3/TiO2复合材料对As(Ⅲ)吸附过程,即这种吸附过程更加倾向于单分子层吸附,单分子层吸附更加有利于光催化氧化反应的进行.
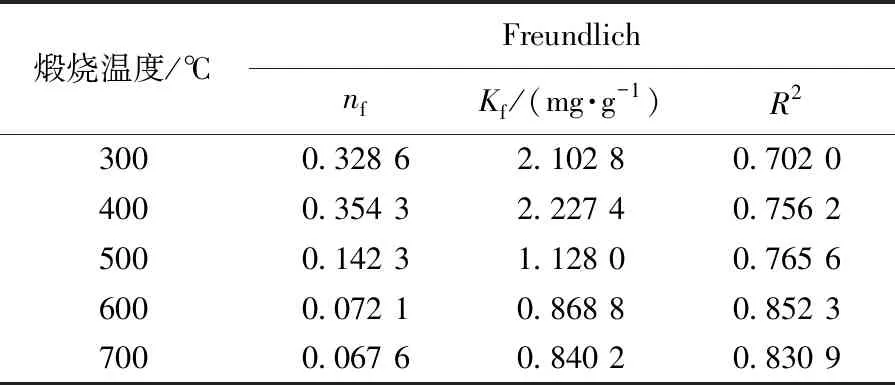
表4 不同煅烧温度下Fe2O3/TiO2复合材料吸附As(Ⅲ)的Freundlich方程参数
3 结 论
以酞酸丁酯和自制的铁醇盐为原料制备出一系列纳米Fe2O3/TiO2复合材料,且该物质在吸附和氧化As(Ⅲ)方面具有优良的性能.铁元素的加入显著抑制了样品晶粒的生长、聚集,提高了晶粒的分散性.热处理温度对样品性能影响较大,温度过低时催化剂结晶度差,达不到活化目的,温度过高会造成催化剂颗粒团聚.pH在4~10 范围内样品有较强的氧化性,在3~7范围内有较好的吸附效果.动力学实验表明其氧化过程符合准一级反应方程,且600 ℃煅烧的样品对As(Ⅲ)的氧化能力最强.吸附过程符合准二级动力学标准,Langmuir模型能够很好地描述其等温吸附过程,400 ℃煅烧的样品对As(Ⅲ)的吸附性能最佳.这种新材料在水体除砷方面表现出巨大潜能,具有实际应用价值.
