日本鳗鲡抗菌蛋白BPI基因的克隆、鉴定与表达
2019-04-19段明珠黄文树
王 佩,段明珠,黄 贝,熊 静,梁 英,黄文树,2,3
(1.集美大学水产学院,福建 厦门 361021;2.鳗鲡现代产业技术教育部工程研究中心,福建 厦门 361021;3.福建省海洋生物资源开发利用协同创新中心,福建 厦门 361005)
0 引言
抗菌肽(antimicrobial peptides)又称宿主防御肽,是生物体天然免疫系统的重要成分,广泛存在于无脊椎动物和脊椎动物中,是一类广谱抗微生物活性的多肽[1-3]。杀菌/渗透性增强蛋白(Bactericidal/permeability increasing protein,BPI) 是一类重要的抗菌肽,是Weiss等[4]1975年从兔子中性粒细胞中首次分离出来的,是一种可迅速杀死大肠杆菌(Escherichiacoli)的多肽。1977年,Weiss等[5]从人类的中性粒细胞中也分离得到了该抗菌肽,其 Isoelectric Point(pI)值为9.8,分子质量为58~60 ku,当pH值达到7.0时,其杀菌和增强渗透性活性均最大,可杀死革兰氏阴性菌,如大肠杆菌和沙门氏菌(Salmonellaspp.),因此,命名为杀菌/渗透性增强蛋白。哺乳动物BPI是一类胞外蛋白质[6],其N端富含精氨酸和赖氨酸,以及两个位置保守的半胱氨酸。精氨酸和赖氨酸均为阳离子氨基酸,可与含有带负电荷的LPS结合,从而杀菌,或结合/中和内毒素[7]。其C端和N端中间有脯氨酸富集中心连接,该区域可促进BPI 分子与LPS 结合,并介导BPI-LPS 复合物向特定宿主细胞转运[8-9]。BPI被学者称为未来的“超级抗生素”[10]。
除BPI外,哺乳动物的脂多糖结合蛋白(lipopolysaccharide binding protein,LBP)也可识别LPS,二者均属于脂质转移和脂多糖结合蛋白家族成员[11]。人类的LBP和BPI序列相似性高达45%,其晶体结构相似[12-13]。LBP是一种胞浆蛋白质,与细菌脂多糖特别是类脂A高度亲和[14]。在LPS刺激的炎症反应中LBP表达量增多,且可调节LPS颗粒使其与吞噬细胞表面的CD14结合[14]。
在哺乳动物中BPI和LBP的基因序列和功能明显不同,但是,在硬骨鱼类中目前尚无法明确区分BPI和LBP[15-16], 因此,常以BPI/LBP表示。迄今为止,已在多种硬骨鱼中克隆和鉴定了BPI/LBP基因,如虹鳟(Onchorhynchusmykiss)[17]、锦鲤(Cyprinuscarpio)[18]、大西洋鳕(Gadusmorhua)[19]、牙鲆(Paralichthysolivaceus)[20]、香鱼(Plecoglossusaltivelisaltivelis)[15]、大黄鱼(Pseudosciaenacrocea)[21]、条石鲷(Oplegnathusfasciatus)[22]、草鱼(Ctenopharyngodonidellus)[16]和团头鲂(Megalobramaamblycephala)[23]等。与哺乳动物BPI基因主要在中性粒细胞和各种黏膜上皮细胞中表达不同,鱼类BPI/LBP基因的组织表达模式较多样。如鲤科鱼类:草鱼BPI在鳃中表达量最高,其次是头肾和中肾[16];锦鲤BPI基因在肝脏和脾脏中表达量最高[18];团头鲂BPI/LBP基因在肾脏中表达量最高[23]。又如石鲷科鱼类:条石鲷BPI-1在脾脏和肝脏中表达量最高,BPI-2在肾脏中表达量最高[22]。此外,外源刺激物刺激后,鱼类BPI转录表达变化规律也不同。如受LPS刺激3 h后,锦鲤肝脏和头肾中的BPI均微弱上调[18],而受LPS刺激2 h后,团头鲂脾脏中BPI/LBP上调达到最高值[23]。
日本鳗鲡(Anguillajaponica)是我国重要的养殖鱼类[24]。然而,细菌性疾病一直困扰着鳗鲡养殖业发展。迄今为止,关于鳗鲡的抗细菌免疫应答的研究较为缺乏。BPI是重要的抗细菌免疫因子,是鱼类天然免疫系统的重要组成部分,目前未见鳗鲡属BPI的相关研究。基于此,本研究运用SMARTerTMRACE技术,从日本鳗鲡中克隆、鉴定BPI基因序列,并进一步利用Real-time PCR技术,研究在正常养殖和人工免疫物刺激下,BPI基因在日本鳗鲡体内表达量变化的规律,以期为阐析鳗鲡BPI/LBP基因的分类、命名及其结构功能等提供参考。
1 材料与方法
1.1 实验材料及处理
日本鳗鲡((203±53)g),购于福建省集美大学水产养殖基地。于水温(28±2)℃暂养1周后,采集日本鳗鲡血液、鳃、心脏、肝脏、胃、肠、脾脏、头肾、中肾、鳔、性腺和皮肤等组织/器官用于试验。
免疫刺激试验: 腹腔注射,设PBS对照组、LPS刺激组(0.01 mg/g,Sigma)、Poly I:C刺激组(0.01 mg/g,Sigma)、迟缓爱德华氏菌刺激组(2×105cfu/g),在注射后8 h、16 h、24 h和72 h采样。每组每个时间点随机取鳗鲡8尾。
1.2 BPI基因cDNA序列的克隆
将约100 mg日本鳗鲡肝脏组织用Trizol®Rreagent试剂盒提取其总RNA,具体操作参考相关研究[25]。用琼脂糖凝胶电泳法和分光光度法(NanoDrop2000,美国Thermo)检测所提取总RNA的完整性和纯度,即RNA 的28 S和18 S条带清晰且D260/D280为1.8~2.0时,方可用于下一步实验。随后,总RNA经RNase-free DNase I(New England Biolabs Inc,美国)处理,反转录(SMARTerTMRACE cDNA Amplification Kit,Clontech,美国)获得第一链模板。
通过分析已制备的日本鳗鲡肝脏和肾脏cDNA文库,获得BPI基因的EST序列,设计引物(见表1),进行巢式PCR扩增,获得BPI基因的5′和3′末端cDNA序列,进一步设计引物,再经PCR扩增,验证其全长cDNA序列。
1.3 BPI基因组序列的扩增
取日本鳗鲡的肌肉,参照MiniBEST Universal Genomic DNA Extraction Kit Ver.4.0试剂盒(TaKaRa,日本)说明书,提取日本鳗鲡基因组DNA。根据已经获得的基因全长cDNA 序列设计特异性引物(见表1),扩增BPI的基因组DNA。
1.4 Real-time PCR
取4 μg健康日本鳗鲡组织的总RNA,经DNA酶处理及反转录(GoScripTMReverse Transcription System,Promega,美国)用以制备Real-time PCR模板,用RNAase free water稀释一定倍数后保存、备用。
以β-actin为内参基因,在 LightCycler 480 II实时定量PCR仪上进行实时检测与分析。qPCR反应体系如下:2× LightCycler 480 SYBR Green I Master Mix 10.0 μL,稀释后的cDNA模板4.0 μL,正、反向引物 (10 μmol·L-1)各0.5 μL,PCR-Grade water 5.0 μL。反应条件:95 ℃变性20 s,58 ℃退火20 s,72 ℃延伸25 s,40个循环。荧光信号采集温度为81℃。反应结束后分析产物的溶解曲线,判断其特异性。以β-actin作为内参基因,梯度稀释已知拷贝数的AJBPI和β-actin质粒样品及组织/器官样品分别进行PCR扩增,绘制标准曲线进而计算各基因的扩增效率。
1.5 生物信息学分析
利用NCBI网站中的Blast进行序列比对(http://blast.ncbi.nlm.nih.gov/Blast.cgi);通过ExPASy的翻译工具获得BPI的氨基酸序列(http://web.expasy.org/translate/),再用ExPASy预测BPI氨基酸的分子量和pI值(http://web.expasy.org/compute_pi/);用SignalP 4.1 Server程序分析信号肽(http://www.cbs.dtu.dk/services/SignalP/);用Pfam程序分析BPI的结构域(http://pfam.xfam.org/);利用DNAman软件进行氨基酸序列的多重比对;应用MEAG5.0软件,采用邻位相接法(NJ法)构建系统发育树。
1.6 数据统计分析
用Excel和Spss18.0软件进行数据计算,用单因素变量方差分析法 (ANOVA)分析LPS、Poly I:C和E.tarda刺激后样品间的表达量差异,利用 Dunnettt-Test (2-sided) 进行多重比对。所有数据均用平均值±标准误差 (SEM) 的方式表示,P<0.05表示差异显著,P<0.01表示差异极显著。利用GraphPad.Prism.v5.0软件进行作图。

表1 引物序列
说明:直下划线部分位于前一个外显子,加粗波浪线的部分位于后一个外显子
Notes:Nucleotides sequence underlined is located in the former exon,that with wavy line is located in the latter exon
2 结果
2.1 日本鳗鲡AJBPI基因序列分析
从日本鳗鲡的肝脏和肾脏cDNA文库中筛选到两条BPI的EST序列,通过RACE、PCR克隆和序列拼接,获得日本鳗鲡两条BPI的cDNA序列,分别命名为AJBPI-1和AJBPI-2。AJBPI-1 cDNA全长1617 bp,包括5′UTR 207 bp,开放阅读框(ORF) 1278 bp(编码425个氨基酸残基),3′UTR 132 bp(见图1),预测其前体肽分子质量为46.26 ku,pI值为8.58。AJBPI-2 cDNA全长1911 bp,包括5′UTR 93 bp,开放阅读框(ORF)1422 bp(编码473个氨基酸残基),3′UTR 396 bp(见图2),预测其前体肽分子质量为51.74 ku,pI值为10.11。通过Phyre2对抗菌肽AJBPI-1和AJBPI-2二级结构预测,结果表明二者主要由β-折叠构成,其含量分别高达53%和48%,该结构有利于AJBPI抗菌肽构象的稳定;其次为α-螺旋,其含量分别为21%和26%。通过SWISS-MODEL预测,发现抗菌肽AJBPI-1和AJBPI-2的三级结构相似,即它们均有“桶状结构单元”,该桶状结构单元由N-和C-末端氨基酸残基中心的β-折叠连接(见图3)。
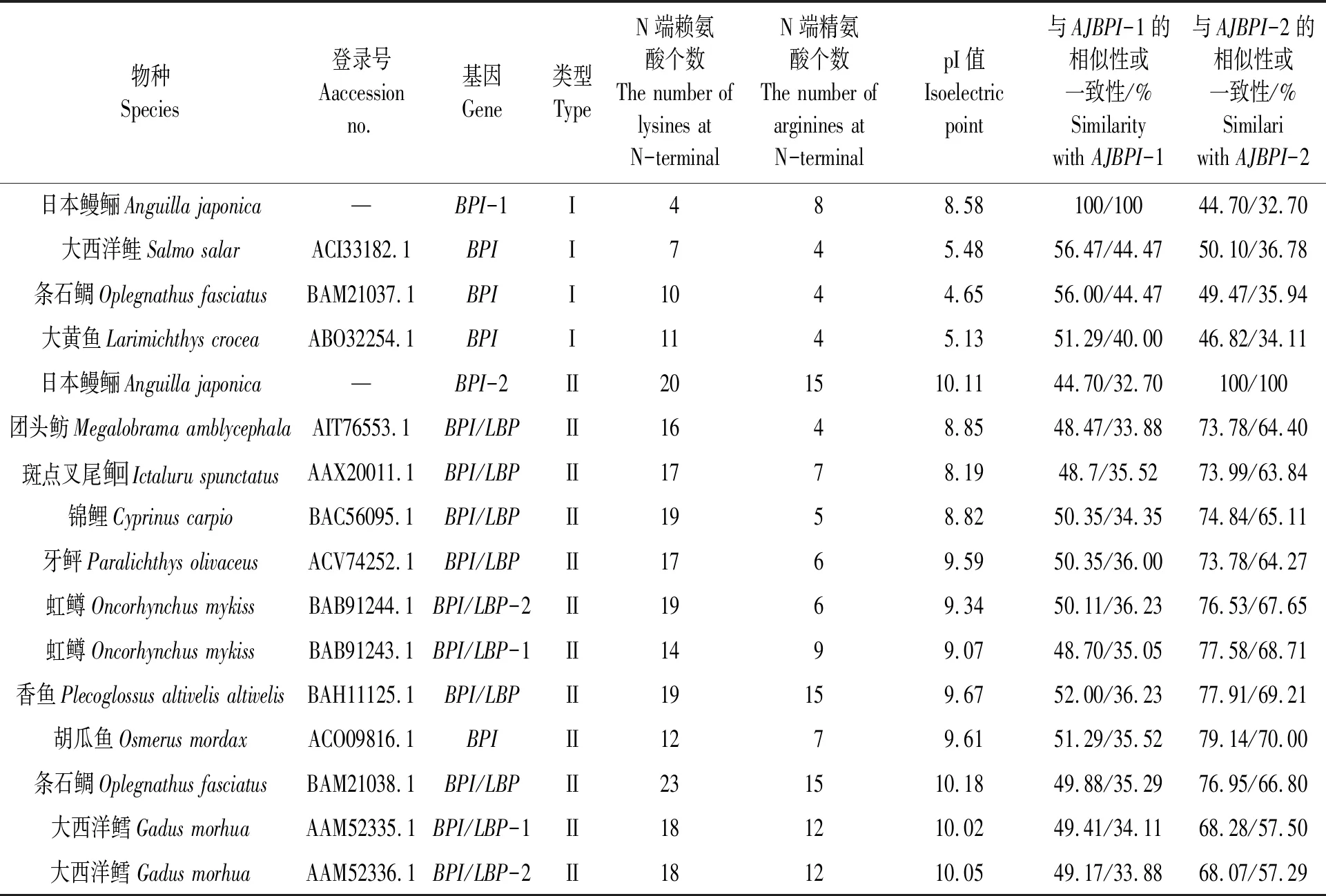
通过对两种AJBPI的N端氨基酸残基分析可知,AJBPI-1含精氨酸和赖氨酸数量分别为4和8,少于AJBPI-2(12和35)(见图1、2和表 2)。


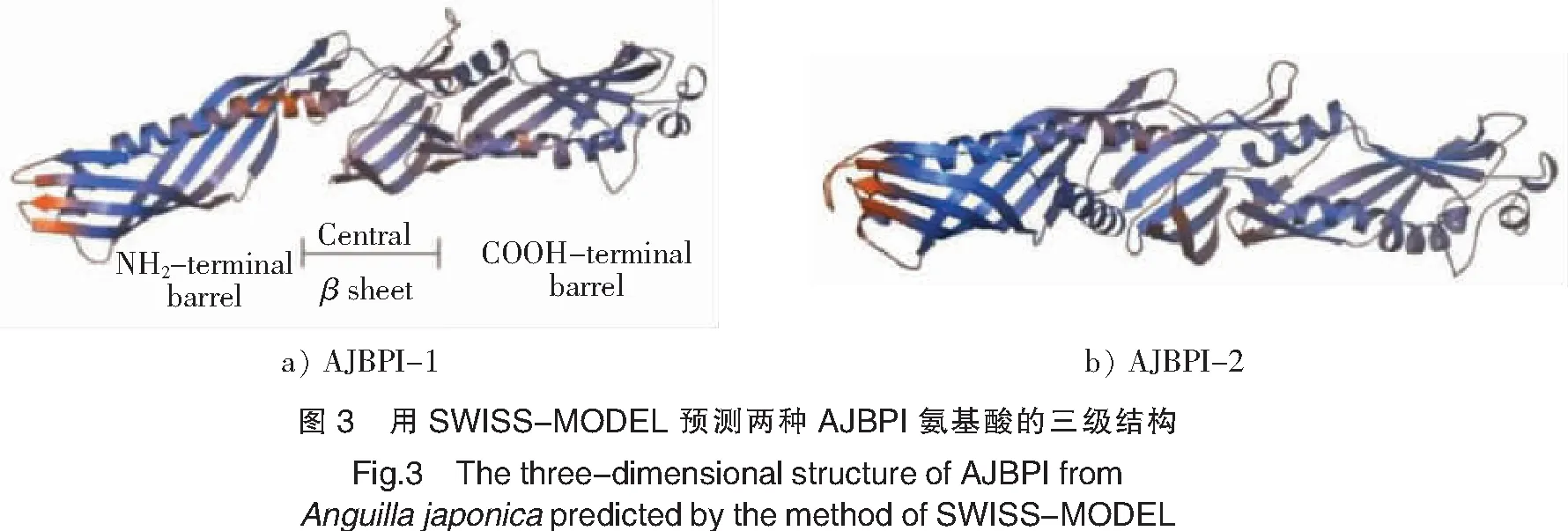
表2 鱼类BPI的序列信息
物种Species登录号Aaccessionno.基因Gene类型TypeN端赖氨酸个数The number oflysines atN-terminalN端精氨酸个数The number ofarginines atN-terminalpI值Isoelectricpoint与AJBPI-1的相似性或一致性/%Similaritywith AJBPI-1与AJBPI-2的相似性或一致性/%Similariwith AJBPI-2日本鳗鲡Anguilla japonica—BPI-1I488.58100/10044.70/32.70大西洋鲑Salmo salarACI33182.1BPII745.4856.47/44.4750.10/36.78条石鲷Oplegnathus fasciatusBAM21037.1BPII1044.6556.00/44.4749.47/35.94大黄鱼Larimichthys croceaABO32254.1BPII1145.1351.29/40.0046.82/34.11日本鳗鲡Anguilla japonica—BPI-2II201510.1144.70/32.70100/100团头鲂Megalobrama amblycephalaAIT76553.1BPI/LBPII1648.8548.47/33.8873.78/64.40斑点叉尾Ictaluru spunctatusAAX20011.1BPI/LBPII1778.1948.7/35.5273.99/63.84锦鲤Cyprinus carpioBAC56095.1BPI/LBPII1958.8250.35/34.3574.84/65.11牙鲆Paralichthys olivaceusACV74252.1BPI/LBPII1769.5950.35/36.0073.78/64.27虹鳟Oncorhynchus mykissBAB91244.1BPI/LBP-2II1969.3450.11/36.2376.53/67.65虹鳟Oncorhynchus mykissBAB91243.1BPI/LBP-1II1499.0748.70/35.0577.58/68.71香鱼Plecoglossus altivelis altivelisBAH11125.1BPI/LBPII19159.6752.00/36.2377.91/69.21胡瓜鱼Osmerus mordaxACO09816.1BPIII1279.6151.29/35.5279.14/70.00条石鲷Oplegnathus fasciatusBAM21038.1BPI/LBPII231510.1849.88/35.2976.95/66.80大西洋鳕Gadus morhuaAAM52335.1BPI/LBP-1II181210.0249.41/34.1168.28/57.50大西洋鳕 Gadus morhuaAAM52336.1BPI/LBP-2II181210.0549.17/33.8868.07/57.29
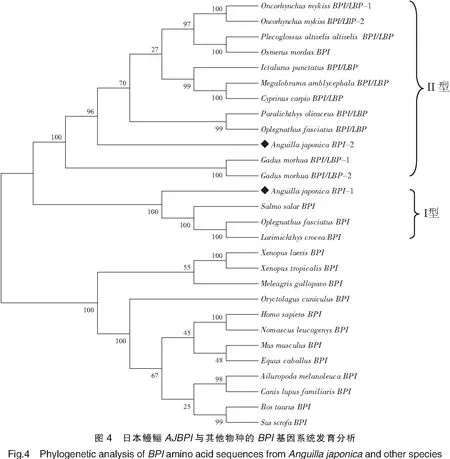
从两栖类、硬骨鱼类及哺乳动物中选取代表种的BPI序列(GenBank登录号见表3),进行多重比对,结果显示:所有物种BPI都具有保守的LPS结合结构域和一对位置固定的二硫键,以及脯氨酸富集中心结构域。序列相似性比对结果显示,AJBPI-1序列与大西洋鲑相似性最高(56.47%),其次为条石鲷(56.0%);AJBPI-2序列与胡瓜鱼相似性最高(79.14%),其次为香鱼(77.91% )(见表2)。利用MEAG4.0软件构建NJ系统进化树(Jones Taylor Thornton model,JTT模型),系统进化树的拓扑结构显示:哺乳动物聚为一大支,硬骨鱼类聚为另一大支。其中硬骨鱼类又分为两小支:AJBPI-1与大西洋鲑、条石鲷和大黄鱼的阴离子BPI基因聚为一支;AJBPI-2与虹鳟等阳离子BPI基因聚为一支(见图4)。
表3 其他物种的登录号
2.2 AJBPI-1和AJBPI-2基因在不同组织中的分布
利用Real-time方法分析AJBPI-1和AJBPI-2在正常鳗鲡不同组织中的表达规律。结果显示:二者在日本鳗鲡肝脏、肠、皮肤、心脏、血液、胃、头肾、中肾、脾脏、鳃等组织/器官表达中均有转录表达,尤其是在肝脏、中肾、脾脏、头肾、皮肤、血液中表达量较高。AJBPI-1在肝脏中转录表达量最高,是β-actin的0.075倍;而AJBPI-2,在头肾和中肾中表达量较高,是β-actin的0.44倍。中肾、头肾和血液中的AJBPI-2极显著高于AJBPI-1(P<0.001),而肝脏中的AJBPI-1却极显著高于AJBPI-2(P<0.01)(见图5)。

2.3 免疫刺激后AJBPI-1和AJBPI-2的基因表达变化
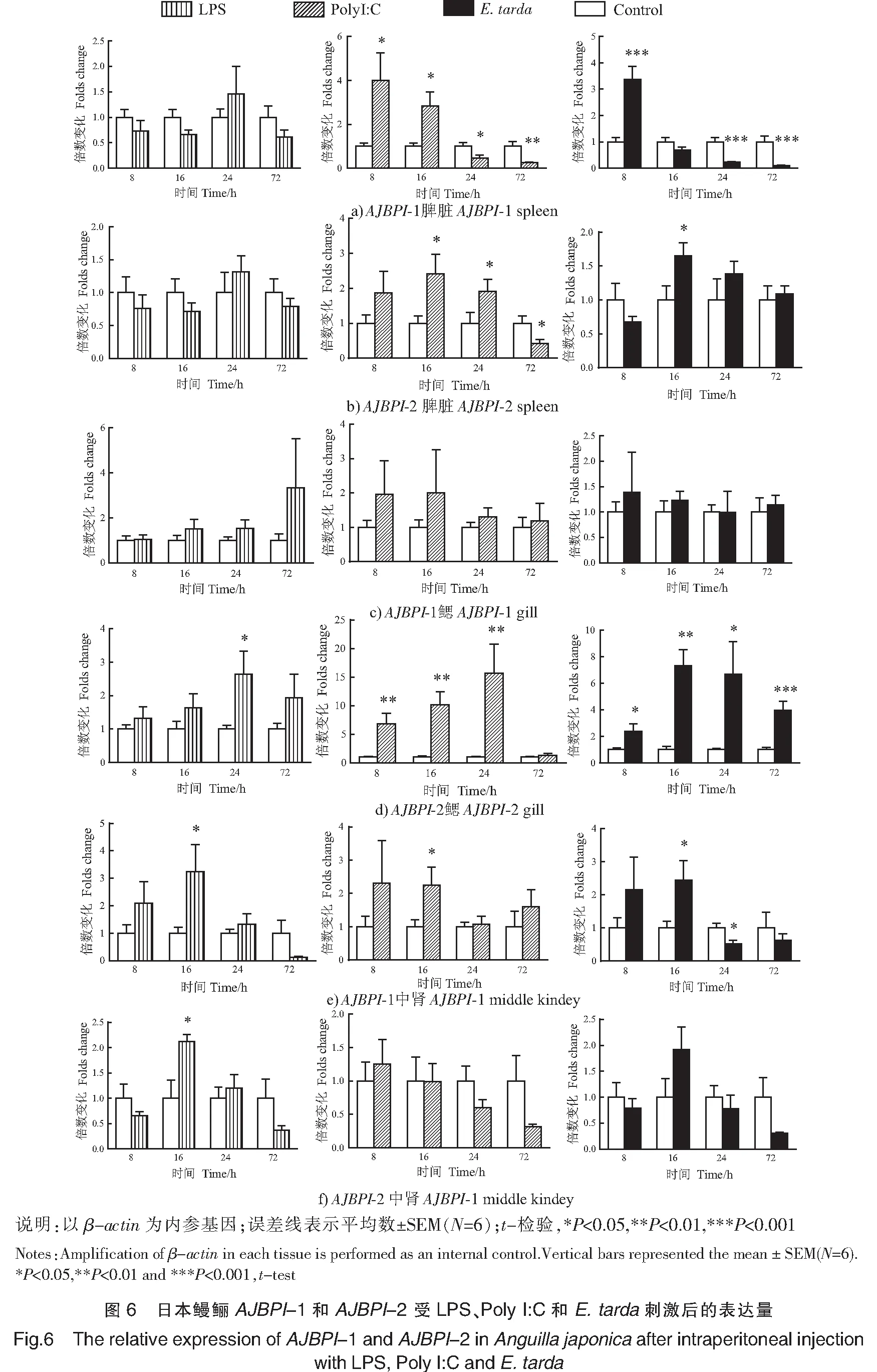
为了研究不同刺激物刺激后对AJBPI-1和AJBPI-2基因表达情况的影响,本实验用LPS、Poly I:C和E.tarda分别刺激日本鳗鲡。结果显示:
脾脏中,经Poly I:C和E.tarda刺激后,AJBPI-1的表达量均迅速达到最高值,分别为PBS对照的4.0倍和3.3倍,刺激后16 h,AJBPI-2的表达量均显著上调(P<0.05),分别为PBS对照组的2.3倍和1.7倍。经LPS刺激后,AJBPI-1和AJBPI-2的表达水平无显著变化(P>0.05)(见图6)。
鳃中,经LPS、Poly I:C和E.tarda刺激后,AJBPI-2的表达量均有上调。其中,LPS和Poly I:C刺激后24 h,AJBPI-2表达量最高,分别为PBS对照组的2.5倍和17.0倍;E.tarda刺激后18 h,AJBPI-2表达量最高,为PBS对照组的7.0倍。而该三种刺激物刺激后,AJBPI-1的表达量均无显著变化(P>0.05)(见图6)。
中肾中,经LPS和Poly I:C刺激后16 h,AJBPI-1和AJBPI-2的表达量均显著上调(P<0.05)。其中,LPS刺激后,AJBPI-1和AJBPI-2分别为PBS对照组的3.0倍和2.0倍;而Poly I:C刺激后,AJBPI-1 和AJBPI-2均为PBS对照组的2.2倍。然而,E.tarda刺激后,中肾中AJBPI-2的表达量无显著变化(P>0.05)(见图6)。
3 讨论
BPI是一类含有LPS结合结构域和脯氨酸富集区的阳离子抗菌肽。它通过LPS结合结构域与革兰氏阴性菌的脂多糖发生结合[26],从而发挥抗菌作用。

鱼类I型BPI主要在中性粒细胞和上皮细胞中表达。如条石鲷BPI-1基因在肝脏、脾脏中高表达[22],大黄鱼BPI基因在肝脏、头肾、心脏中高表达[21]。本研究的AJBPI-1在所检测的各个组织中均有表达,且在肝脏、头肾和脾脏中高表达。这表明日本鳗鲡BPI-1基因的组织分布与上述鱼类BPI基因的组织分布相似。异源性抗原物质如LPS、病毒和细菌刺激可显著诱导鱼类BPI基因的表达。如E.tarda和真鲷虹彩病毒(red sea bream iridovirus,RSIV)诱导后,条石鲷BPI-1基因在头肾中表达量显著上调[22]。受溶藻弧菌(Vibrioalginolyticus)和诺卡氏菌(Nocardiaseriolae)刺激后,大黄鱼头肾、脾脏、肠道、肾脏、鳃和肌肉中BPI基因的表达量显著上调[21]。本研究发现,用LPS、Poly I:C和E.tarda分别刺激日本鳗鲡中肾、脾脏和鳃时,中肾中AJBPI-1的表达量均有显著上调;在Poly I:C和E.tarda刺激下脾脏中AJBPI-1的表达量具有显著性变化,而鳃中AJBPI-1的表达量均无显著变化。根据以上结果可知,BPI-1主要在脾脏、肾脏等造血器官中高表达。


综上所述,本研究从日本鳗鲡中克隆、鉴定了两类AJBPI基因。AJBPI在所检测的组织中均有不同程度的表达,用LPS、Poly I:C和E.tarda分别刺激时日本鳗鲡中的肾、鳃和脾脏中的AJBPI均有不同响应。该研究结果显示AJBPI可能参与日本鳗鲡的抗细菌和抗病毒免疫,而且它将为鱼类的BPI/LBP基因的命名、分类及其功能分析等提供一定的理论依据。
