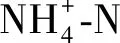四溴双酚A对土壤无机氮转化的影响及其微生物学机理初探
2019-04-18张博伟王海静宋茂勇谢慧君
张博伟,王海静,宋茂勇,谢慧君,*,张 建
(1.山东大学 环境研究院,山东 济南 250100; 2.山东大学 环境科学与工程学院,山东 济南 250100; 3.中国科学院 生态环境研究中心,北京 100085)
四溴双酚A(TBBPA)是一种溴系阻燃剂,广泛应用于印刷电路板、电子产品、塑料、纺织等工业产品中[1]。随着TBBPA的广泛应用,目前它已经成为全球范围内的新兴污染物之一。TBBPA在环境中可以长期存在,并能长距离迁移[2],在不同环境中均有检出[3-4]。由于它和甲状腺激素具有相似的化学结构,很容易与甲状腺激素运载蛋白结合,因此也被视作一种潜在的内分泌干扰物[5],一旦随生物链进入人体,会造成人体正常代谢活动的紊乱。TBBPA具有亲脂性和疏水性,一旦进入环境,最终会积聚到土壤中。Xu等[6]检测到北京农田土壤中TBBPA浓度为0~5.6 μg·kg-1,电子废物回收地区土壤中TBBPA浓度高达26~104 μg·kg-1;研究人员在以色列的一个污染场地的表层土壤中,检测到TBBPA的最高浓度达450 mg·kg-1[7]。
土壤微生物是土壤的重要组成部分,在土壤物质循环中发挥重要作用[8]。氮元素是土壤中重要的养分元素之一[9]。土壤生态系统主要依靠氮转化,如硝化、反硝化、厌氧氨氧化,来维持土壤生产力和土壤微生物活性。土壤中的微生物硝化、反硝化、厌氧氨氧化过程,主要以微生物酶的活性决定反应的转化速率[10]。有研究表明,As、Be、Br、Cd、Cr、Pb、Hg等重金属,对土壤硝化均有不同程度的抑制作用[11]。当有机污染物菲的浓度达到250 mg·kg-1时同样也能抑制土壤硝化作用[10]。虽然土壤微生物在厌氧或者好氧条件下对TBBPA均有一定的降解作用[12-13],但当TBBPA进入土壤后,是否会对土壤中无机氮循环相关的微生物群落结构和功能造成一定影响,从而影响土壤物质循环,尤其是无机氮循环,在本研究范围内检索还未见报道。

1 材料与方法
1.1 土壤样品采集和微生物分析
实验土壤选取山东省济南市百花公园(117.07°E,36.68°N)的表层土壤(0—20 cm),设置3个5 m×10 m的样方,用直径7 cm的螺旋钻随机取10份样品,将取得的样品充分混合,去除土壤中的植物残渣、树枝残骸和大块石头。处理好的土壤样品置于阴凉处风干后过10目筛(2 mm)。将过筛土壤样品的含水率调节为土壤干重的40%,放在托盘中用保鲜膜包好,放进28 °C恒温培养箱中避光孵化7 d,以增强土壤中微生物的活性。测得土样pH值为8.0,总氮(TN)含量为169 mg·kg-1,总碳(TC)含量为2.43 g·kg-1,阳离子交换量(CEC)为21.03 cmol·kg-1。
实验共设置4个TBBPA浓度(4、10、20、40 mg·kg-1)的污染土壤作为实验组,以不添加TBBPA的土壤样品作为空白组。配制实验组土壤时,首先将TBBPA溶解到甲醇中,配制不同浓度的TBBPA母液,然后按其所需添加量加入土壤中,搅拌均匀后在通风橱放置30 min,以保证甲醇溶剂挥发完全[14]。所有实验组和空白组均添加相同体积的甲醇。将溶剂挥发后的土壤分成30份,每份200 g,加入500 mL的锥形瓶中。
为了更好地了解不同氧气环境下TBBPA对土壤无机氮循环微生物的影响,将每个TBBPA浓度处理平均分为厌氧组和好氧组。好氧组分别命名为A-4、A-10、A-20、A-40,厌氧组分别命名为AN-4、AN-10、AN-20和AN-40。此外,好氧组和厌氧组各设一个空白对照,分别命名为A-CK和AN-CK。好氧组使用棉花塞封口,厌氧组通入氮气后用橡胶塞封口。将30个锥形瓶置于恒温培养箱中,28 °C条件下培养45 d。
1.2 土壤样品中铵态氮、亚硝态氮和硝态氮的测定

1.3 土壤样品DNA提取及高通量测序
取培养45 d后干燥的土壤0.3 g,使用PowerSoil®DNA Isolation kit DNA(MOBIO)试剂盒提取土壤中微生物的DNA。DNA的纯度和浓度利用Nanodrops ND-1000 紫外分光光度计检测,合格的DNA样品保存在-20 ℃冰箱内。采用Illumina高通量测序检测TBBPA对无机氮循环相关微生物群落结构的影响。每个样品做3个平行。选择F338和R806引物,对微生物的16S rRNA基因中V3~V4段进行扩增,并利用Illumina MiSeq测序仪器对16S rRNA基因的扩增子进行250 bp的末端测序,测序后的数据处理方法如Kang等[15]所述。
1.4 数据分析
对不同处理下的土壤无机氮含量数据采用SPSS 17.0软件进行单因素方差分析,对有显著差异(P<0.05)的处理做最小显著差异性检验。利用Origin 9.1软件绘图。
高通量数据经过筛选后,使用PICRUSt标准化16S rRNA的拷贝数,并根据KEGG通路数据库预测微生物群组的功能[16],然后筛选出与氮转化相关的功能基因,包括参与硝化、反硝化、厌氧氨氧化过程的功能基因。
2 结果与分析
2.1 不同浓度TBBPA对于土壤无机氮循环的影响

表1好氧和厌氧条件下不同浓度TBBPA对土壤无机氮的影响
Table1Effect of different concentrations of TBBPA on inorganic nitrogen in aerobic or anaerobic conditions
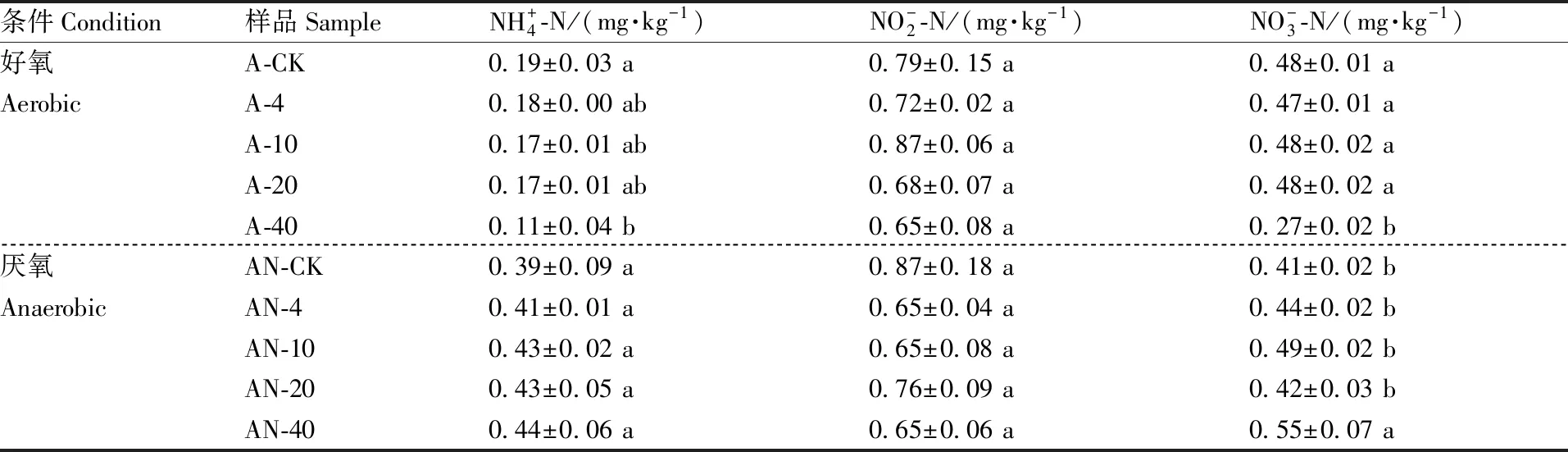
条件Condition样品SampleNH+4-N/(mg·kg-1)NO-2-N/(mg·kg-1)NO-3-N/(mg·kg-1)好氧A-CK0.19±0.03 a0.79±0.15 a0.48±0.01 aAerobicA-40.18±0.00 ab 0.72±0.02 a0.47±0.01 aA-100.17±0.01 ab0.87±0.06 a0.48±0.02 aA-200.17±0.01 ab0.68±0.07 a0.48±0.02 aA-400.11±0.04 b0.65±0.08 a0.27±0.02 b厌氧AN-CK0.39±0.09 a0.87±0.18 a0.41±0.02 bAnaerobicAN-40.41±0.01 a0.65±0.04 a0.44±0.02 bAN-100.43±0.02 a0.65±0.08 a0.49±0.02 bAN-200.43±0.05 a0.76±0.09 a0.42±0.03 bAN-400.44±0.06 a0.65±0.06 a0.55±0.07 a
同列数据后无相同小写字母的表示差异显著(P<0.05)。
Values within a column followed by different lowercase letters indicated significant difference atP<0.05.
2.2 40 mg·kg-1 TBBPA对土壤微生物群落结构的影响
微生物硝化、反硝化、厌氧氨氧化是土壤中无机氮循环最重要的转化过程,这些过程主要受土壤微生物相关代谢活动的调控[17]。如2.1节结果所示,在本实验条件下,只有当TBBPA浓度为40 mg·kg-1时才对土壤无机氮循环有显著影响,因此仅在该浓度下分别针对好氧和厌氧条件下无机氮循环相关微生物的丰度进行分析,结果如表2所示。总的来说,不同处理条件下的土壤群落结构相似,在所有测试样品中,变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)是丰度最高的5大门类。区别在于,在40 mg·kg-1TBBPA处理下,无论好氧还是厌氧条件,变形菌门的丰度都增大,而绿弯菌门和放线菌门的丰度都降低。
表2不同条件下土壤微生物群落结构门水平的组成
Table2Taxonomic classification of soil microorganism on different conditions at phylum level %

类别PhylumA-CKA-40AN-CKAN-40酸杆菌门Acidobacteria19.0317.8012.4115.60放线菌门Actinobacteria8.726.709.608.04装甲菌门Armatimonadetes0.750.310.420.31拟杆菌门Bacteroidetes4.836.369.6810.54绿弯菌门Chloroflexi6.873.4713.508.07硬壁菌门Firmicutes0.911.394.755.03芽单胞菌门Gemmatimonadetes1.672.001.491.35硝化螺旋菌门Nitrospirae0.691.050.510.79浮霉菌门Planctomycetes0.600.450.460.39变形菌门Proteobacteria29.4141.0129.9635.74其他Others25.2018.3116.1813.03
表3不同条件下土壤硝化细菌在属水平的群落组成
Table3Taxonomic classification of soil nitrobacteria on different conditions at genus level %
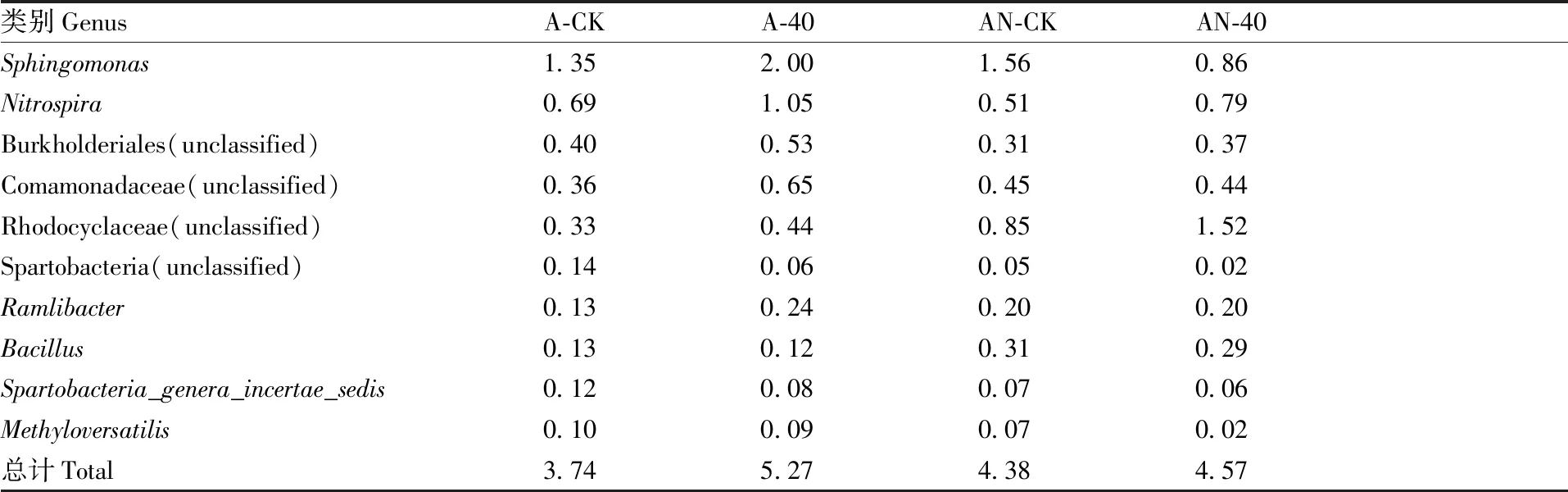
类别GenusA-CKA-40AN-CKAN-40Sphingomonas1.352.001.560.86Nitrospira0.691.050.510.79Burkholderiales(unclassified)0.400.530.310.37Comamonadaceae(unclassified)0.360.650.450.44Rhodocyclaceae(unclassified)0.330.440.851.52Spartobacteria(unclassified)0.140.060.050.02Ramlibacter0.130.240.200.20Bacillus0.130.120.310.29Spartobacteria_genera_incertae_sedis0.120.080.070.06Methyloversatilis0.100.090.070.02总计Total3.745.274.384.57
表4不同条件下土壤反硝化细菌在属水平的群落组成
Table4Taxonomic classification of soil denitrobacteria on different conditions at genus level %

类别GenusA-controlA-40AN-controlAN-40Chitinophagaceae(unclassified)0.791.27 1.08 0.77Rhodocyclaceae(unclassified)0.33 0.44 2.12 1.52Sphingobacteriales(unclassified)0.31 0.11 0.09 0.08Arthrobacter0.28 0.14 0.28 0.32Flavisolibacter0.27 0.68 0.62 1.09Terrimonas0.19 0.32 0.24 0.20Hyphomicrobium0.17 0.18 0.11 0.21Parasegetibacter0.13 0.18 0.17 0.26Bacillus0.13 0.12 0.31 0.29Methyloversatilis0.10 0.09 0.07 0.02总计Total2.743.535.094.76
2.3 40 mg·kg-1 TBBPA对无机氮循环的影响机制
近年来,根据高通量测序结果来推测微生物功能得到了广泛应用[20]。为了更好地说明40 mg·kg-1TBBPA对无机氮转化途径的影响,利用PICRUSt软件预估了无机氮转化过程中的基因变化。图1展示了对照组(A-CK、AN-CK)和40 mg·kg-1TBBPA处理条件下厌氧和好氧组内所有有显著性差异(P<0.05)的无机氮转化相关基因。好氧条件下,A-CK和A-40组有6个氮相关基因都显示出了显著差异。TBBPA暴露使得其中2种功能基因,即亚硝酸盐还原酶K00368(nirK)和硝酸盐还原酶K00370(narG)的表达被诱导,另外4个基因,即参与硝酸盐还原的K00360(nasB)、K00371(narH)和K02567(napA)及氧化亚氮还原酶K00376(nosZ)的表达受到抑制。厌氧条件下,硝酸盐还原酶K00360(nasB)的表达同好氧条件下一样受到抑制,而亚硝氮还原酶K00363(nirD)和一氧化氮还原酶K04561(norB)的表达则受到诱导。

图1 好氧(a)和厌氧(b)条件下40 mg·kg-1 TBBPA对土壤无机氮循环相关基因的作用Fig.1 Effect of 40 mg·kg-1 TBBPA on functional genes related to inorganic nitrogen transformation in aerobic (a) or anaerobic (b) conditions
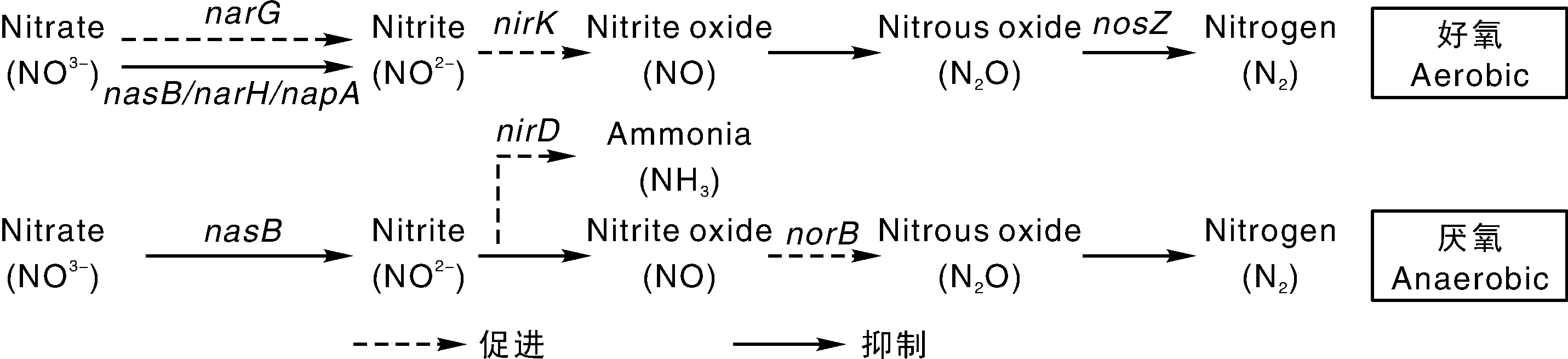
图2 TBBPA对土壤无机氮循环途径的可能影响Fig.2 Possible effect of TBBPA on soil inorganic nitrogen transformation pathway
3 结论