猪源沙门氏菌聚合酶螺旋反应方法的建立与应用
2019-04-17胡瑞鸿从秋实李艳飞
胡瑞鸿,从秋实,李艳飞
(东北农业大学 动物医学学院,黑龙江 哈尔滨150030)
沙门氏菌是一类能够导致人畜共患疾病的食源性致病菌,其菌属血清型繁多且抗原复杂,可以在人和动物的肠道内寄生生存,对人和畜禽健康带来很大的危害,常给发展中国家的畜牧业造成严重的经济损失。近年来,随着我国畜牧业的迅速发展,猪的养殖数量越来越多,许多地区猪的养殖已经形成集约化、规模化的养殖模式,但随之而来的各种动物源传染病也给集约化养殖带来了新的挑战。其中,猪源沙门氏菌病即猪副伤寒,是一种由沙门氏菌属细菌引起的传染病,主要感染断奶期仔猪,临床上以急性败血症、慢性坏死性肠炎、顽固性下痢为特征[1-2]。在集约化猪场中一旦暴发沙门氏菌和其它细菌的混合感染,很难对其诊断和对症治疗[3],因此快速、准确、有效地检测猪源沙门氏菌感染对养猪业的健康发展至关重要。
目前,传统的检测猪源沙门氏菌的方法主要包括细菌培养法、生化和血清学鉴定及免疫学检测等,其中细菌分离培养法被视为沙门氏菌检测的“金标准”,检测结果可信度高,但检验周期较长,操作步骤较为繁琐,且所需试剂繁多,使其在应用方面具有一定的局限性[4-5]。分子生物学检测方法(如PCR)因具有特异性强、敏感性高的特点,已被广泛用于多种病原微生物的检测,虽缩短了检测时间,但往往需购买昂贵的设备和耗材,且需要专业的操作人员而限制了其在基层防疫部门的推广普及[6]。因此,亟待建立一种快速、敏感、有效的方法用于猪源沙门氏菌的检测。
核酸等温扩增技术因操作简便、快速准确且无需昂贵检测仪器等优势被广泛应用于病原微生物的检测,其中环介导等温扩增(Loop-mediated isothermal amplification,LAMP)技术具有特异性强、灵敏度高且成本低的特点,目前已被用于猪源沙门氏菌的检测[7-8]。聚合酶螺旋反应(Polymerase spiral reaction,PSR)是继LAMP方法后被大力推广的一项新型核酸等温扩增技术,与LAMP扩增原理类似,在2~4条特异性引物和具有链置换活性Bst-DNA聚合酶的作用下可在恒温条件下完成对靶基因的快速扩增,因具有引物设计简单、扩增效率高且不需昂贵设备等优点而取得良好的应用效果[9-11]。本研究以猪源沙门氏菌侵袭蛋白A(Invasion protein A,invA)保守序列作为靶基因设计PSR特异性扩增引物,建立一种快速、高效且灵敏的方法,以期为基层兽医单位提供新型的猪源沙门氏菌检测方法。
1 材料与方法
1.1 主要试剂 Trans 2k plus II DNA Marker购自北京全式金生物技术有限公司;细菌DNA提取纯化试剂盒、dNTPs、MgCl2均购自宝生物工程(大连)有限公司;甜菜碱购自Sigma-Aldrich有限公司;琼脂糖购自北京沃比森科技有限公司;SYBR Green I染料购自北京索莱宝科技有限公司;Bst-DNA聚合酶大片段购自NEB(北京)有限公司;TaqManTMFast Advanced Master Mix试剂盒购自赛默飞世尔科技(中国)有限公司;营养肉汤培养基、蛋白胨、氯化钠、DBI-05干制生化鉴定试剂盒均购自北京陆桥技术股份有限公司。
1.2 菌株来源 乙型副伤寒沙门氏菌(Salmonella paratyphi β,CMCC 50094)、猪霍乱沙门氏菌(S.cholerae-suis,CMCC 50018)、大肠杆菌(Escherichia coli,ATCC 25922)、E.coli(C83930)、E.coliO157:H7、E.coli(C83093)、金黄色葡萄球菌(Staphylococcus aureus,ATCC25923)、S.aureus(ATCC29212)、奇异变形杆菌(Proteus mirabilis,ATCC12453)、嗜水气单胞菌(Aeromonashydrophila,ATCC7966)、单核细胞李斯特氏菌(Listeriamonocytogenes,ATCC19115)、小肠结肠炎耶尔森菌(Yersiniaenterocolitica,ATCC23715)、副溶血性弧菌(Vibrioparahaemolyticus,ATCC27519)、铜绿假单胞菌(Pseudomonas aeruginosa,ATCC27853)均购自中国兽医药品监察所。本研究自2017年~2018年间共采集黑龙江和吉林部分地区12个规模化养殖场共132份疑似猪源沙门氏菌临床腹泻样本,用无菌拭子蘸取粪便后放入含无菌PBS的采集管中,并在12 h内低温运输至实验室进行细菌的分离及纯化。
1.3 引物的设计 根据GenBank中登录的猪沙门氏菌侵袭蛋白A(invA)保守基因(MK017942.1),参照文献[10]设计3套PSR特异性引物(表1);LAMP特异性引物和荧光定量PCR引物分别参照文献[12-13]。
1.4 DNA模板的制备 将保存的14株不同菌株接种至灭菌的营养肉汤培养基中于37℃条件下培养12 h~18 h,利用细菌DNA提取试剂盒提取猪源沙门氏菌和其它致病菌的DNA,于-20℃保存备用。

表1 扩增引物Table 1 Primers used in PSR assay
1.5 PSR扩增引物的筛选与反应体系的优化 首先对3套PSR特异性引物进行筛选,反应体系为25μL:包括2.5 mmol/LdNTPs 2 μL、20 mmol/L MgCl22.5 μL、10×Thermo-Pol Buffer 2.5 μL、0.8 mol/L Betaine 2 μL、Bst DNA聚合酶1 μL(8 U/管)、乙型副伤寒沙门氏菌CMCC 5009 4株基因组DNA 2 μL。SPSR-1、SPSR-2和SPSR-3引物量分别为:FT和BT各1.6 μL,IF和IB各0.8 μL,并用灭菌去离子水补齐反应体系。反应于65℃条件下孵育60 min,用实时浊度仪对扩增反应进行连续监测;反应结束后向反应管内加入1 μL SYBR Green I染料混匀,分别在白光和紫外灯下观察,并经2.0%琼脂糖凝胶电泳对扩增产物分析以筛选最佳的PSR引物。
为确定PSR法的最优反应条件,选择最佳的特异性引物组合并采用方阵法优化体系的孵育温度(61℃、63℃、65℃、67℃、69℃)、dNTPs浓度(0.1 mmol/L、0.2 mmol/L、0.3 mmol/L、0.4 mmol/L)、Mg2+浓 度(1.0 mmol/L、2.0 mmol/L、3.0 mmol/L、4.0 mmol/L)、Bst聚合酶浓度(6 U/管、8 U/管、10 U/管、12 U/管)及反应时间(15 min、30 min、45 min、60 min、75 min、90 min),每个反应均重复3次,并用实时浊度仪对反应结果进行监测分析。
1.6 特异性试验 以提取的14株实验菌(2株猪源沙门氏菌和12株其它致病菌)DNA为模板分别进行LAMP法和PSR法进行检测,设灭菌去离子水为模板作为阴性对照。LAMP反应体系参考文献[12],反应结束后,分别向反应管内加入1 μL SYBR Green I混匀并分别于白光和紫外灯下观察,同时将扩增产物经琼脂糖凝胶电泳检测。
1.7 敏感性试验 以增菌培养后的猪源沙门氏菌参考株CMCC 50094菌液为模板并进行平板计数,调整初始菌液浓度为5×106cfu/mL,分别将菌液稀释到浓度为5×105cfu/管、5×104cfu/管、5×103cfu/管、5×102cfu/管、5×101cfu/管、25 cfu/管、10 cfu/管和5 cfu/管,9个稀释度备用;分别吸取2 μL稀释后的各菌液作为模板分别进行PSR、LAMP和荧光定量PCR扩增,比较3种检测方法的敏感性。
1.8 临床样本检测 对2017年~2018年间于黑龙江和吉林部分地区采集的共132份猪源临床腹泻样本按常规方法进行细菌的分离、纯化培养及生化鉴定,于无菌条件下接种到肉汤固体培养基上,37℃静置培养12 h~18 h,挑取疑似沙门氏菌菌落用DBI-05干制生化鉴定试剂盒进行鉴定,并以其结果作为参照标准。随后,将这些腹泻样品经常规处理后按照细菌DNA提取试剂盒说明书提取DNA,以其为模板,利用本研究建立的PSR法对上述132份临床腹泻样本进行检测,比较二者的检测结果,并计算二者的符合率。
2 结果
2.1 PS R引物的筛选 以乙型副伤寒沙门氏菌CMCC 50094标准株DNA为模板,分别以SPSR-1、SPSR-2和SPSR-3为引物进行扩增,实时浊度仪监测结果显示,在相同条件下3套PSR特异性引物反应扩增速度及效率由高到低依次为SPSR-2、SPSR-3、SPSR-1(图1A);SPSR-2扩增产物的琼脂糖电泳结果显示,阳性产物呈阶梯状分布,而阴性对照无条带(图1B);向反应管内加入SYBR Green I染料后,白光下可见阳性扩增结果呈绿色,阴性为橙色(图1C);紫外光下观察,阳性管内呈现绿色荧光,而阴性管颜色无变化(图1D)。表明本研究设计的3套特异性引物中,SPSR-2组合(SPSR-2 PSR)获得的扩增效果最好。
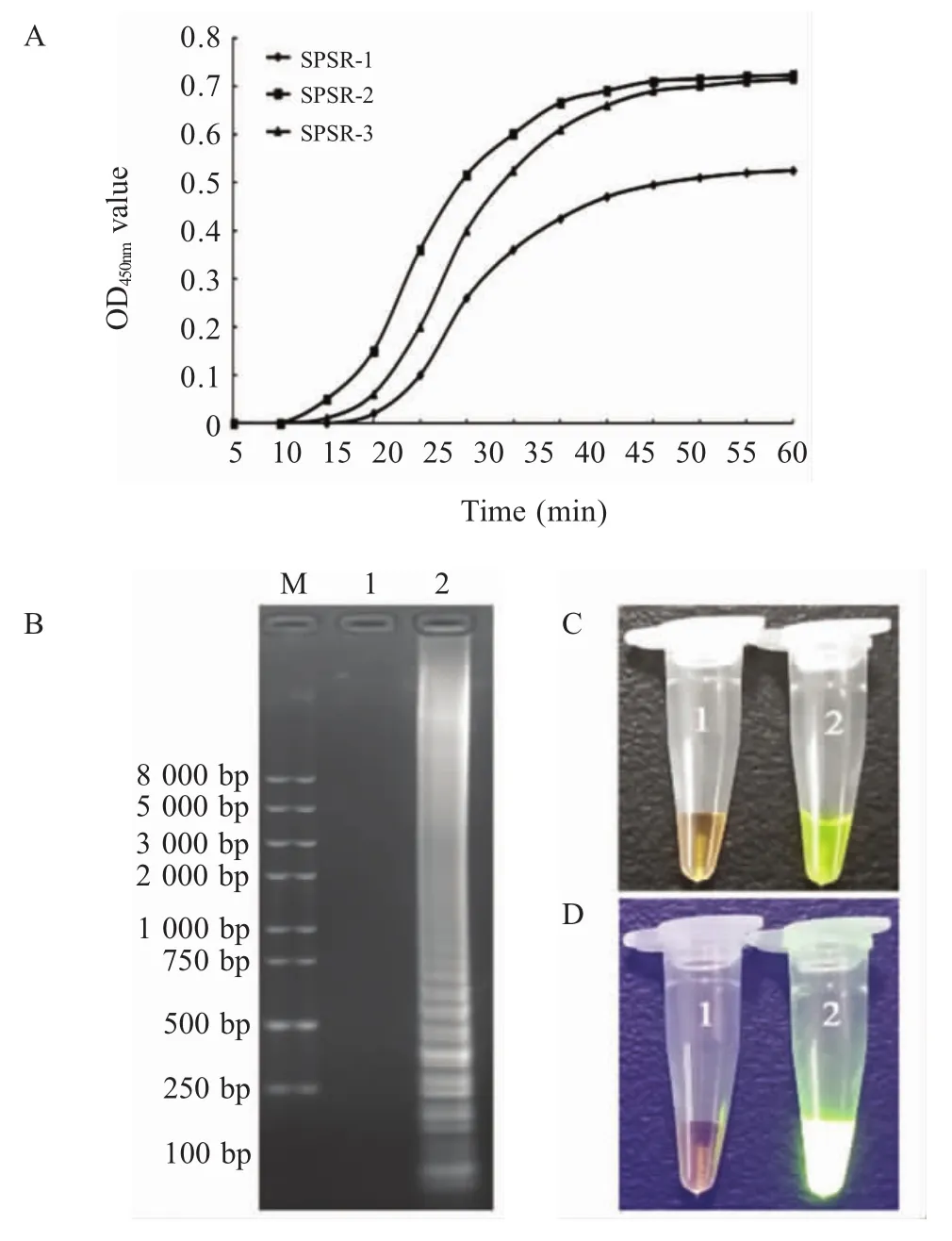
图1 SPSR-2引物组PSR扩增结果Fig.1 Amplification results of SPSR-2 PSR
2.2 PSR反应条件的优化 选择SPSR-2组作为PSR法特异性引物,分别对各反应条件进行优化,实时浊度仪监测结果显示,PSR反应温度为63℃(图2A)、dNTPs浓度为0.3 mol/L、Mg2+终浓度为2.0 mmol/L、Bst酶浓度为8 U/管、扩增时间为60 min扩增效率最高(图2B)。
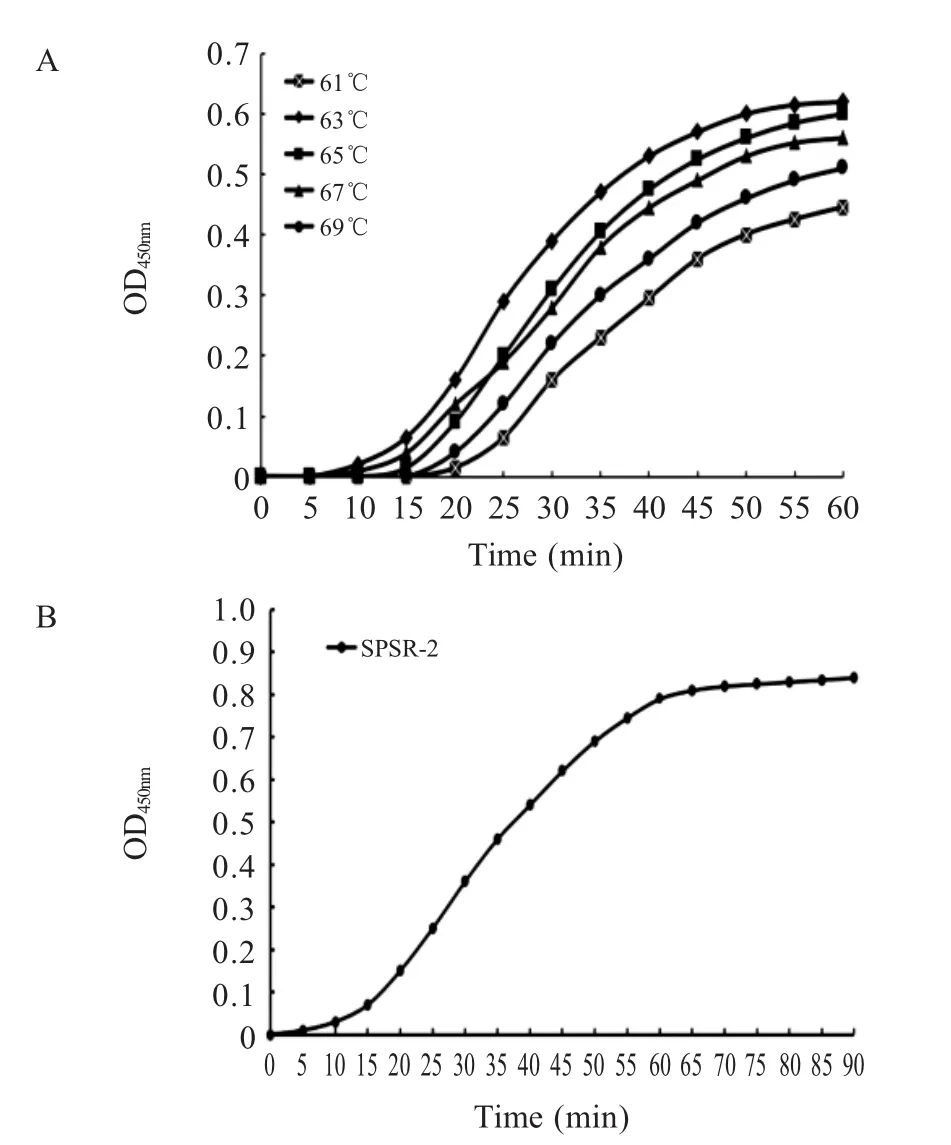
图2 PSR反应条件的优化Fig.2 Optimization of PSR reaction conditions
2.3 特异性试验结果 以灭菌后的去离子水做模板为阴性对照,选取2株猪源沙门氏菌标准菌和其它12株致病菌的DNA分别进行LAMP法和PSR法的特异性试验。结果显示,LAMP法和PSR法均可以特异性扩增2株猪源沙门氏菌,而阴性对照和其它12株致病菌无扩增(图3);在反应管内加入SYBR Green I染料后,阳性扩增产物在白光下观察呈现绿色,阴性为淡橙色(图3C、3D);紫外灯下观察阳性扩增呈绿色荧光,而阴性管内无变化(图3E、3F);2.0%琼脂糖凝胶电泳分析可见阳性产物呈梯形条带,阴性对照和其余菌株均未扩增出任何产物(图3A、3B)。结果表明,建立的PSR法与LAMP法均可以特异性地检测出猪源沙门氏菌,而与其它致病菌无交叉反应。
2.4 敏感性试验结果 将过夜培养的沙门氏菌标准株CMCC 50094菌液10倍倍比稀释后分别进行LAMP、PSR和荧光定量PCR方法的敏感性试验,结果显示,本研究建立的PSR法的敏感性与荧光定量PCR法相同,检测下限均为5×101cfu/mL(图4A、4C),而LAMP方法的检测灵敏度为5×102cfu/mL(图4B),结果表明,本研究建立的PSR方法的敏感性较高,且略高于LAMP方法。
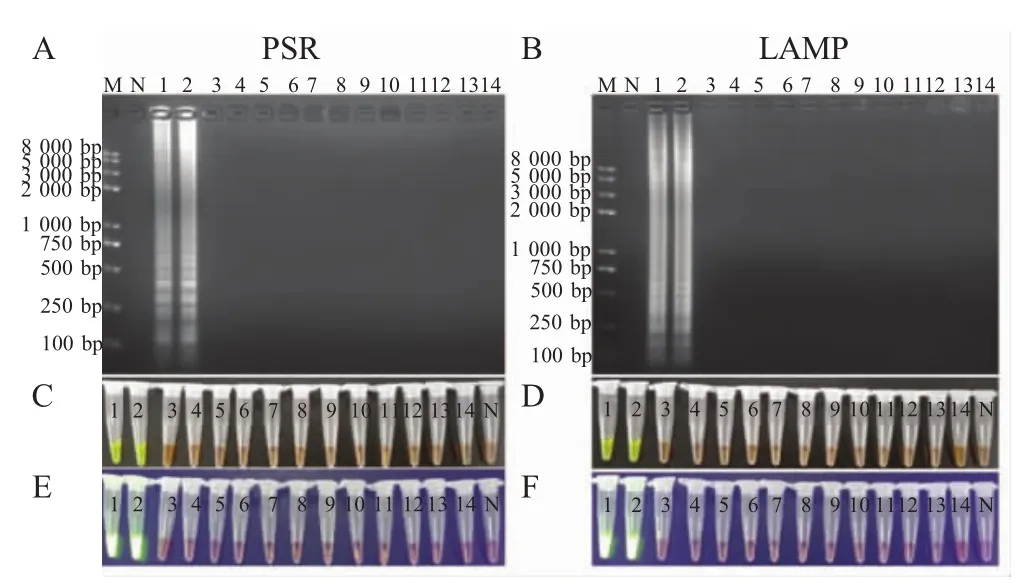
图3 特异性试验结果Fig.3 The specificity assays of PSR and LAMP amplification
2.5 临床样本检测结果 以标准细菌培养法和生化试验检测结果作为参照,对采集的132份疑似猪源沙门氏菌临床腹泻样本进行检测,经过细菌的分离、纯培养和生化试验,共检测出携带猪源沙门氏菌阳性样本18份。采用本研究建立的PSR法对采集的132份临床样本进行检测,同样检测出18份阳性样本,阳性检出率为13.64%,且结果与标准细菌培养法和生化试验检测结果相符(表2)。表明PSR法可以快速、准确地完成对临床样本的检测。
3 讨论

图4 LAMP、PSR和荧光定量PCR敏感性试验结果Fig.4 The sensitivity analysis of LAMP,PSR and real-time PCR
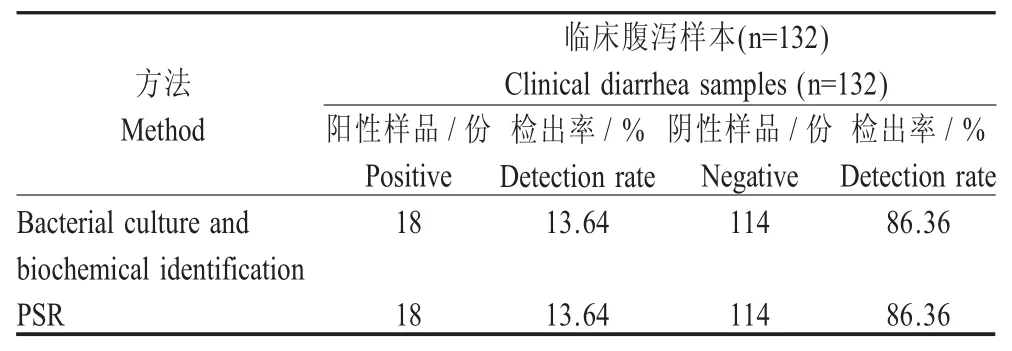
表2 临床样本检测结果Table 2 The detection results of clinical samples
猪源沙门氏菌作为引发断奶仔猪副伤寒的主要因素,目前疫苗接种和抗生素治疗仍是防治该病的主要手段。在患病早期以一种快速、有效的方法对猪群进行监测,可以在一定程度上减小猪源沙门氏菌造成的经济损失。本研究建立的PSR法是一种新型、快速的基因检测技术,不仅不需要复杂的仪器设备及昂贵耗材,同时摆脱了LAMP方法的专利限制,可以实现短时间内完成目的基因的大量扩增,现已广泛用于食品、农业和医疗机构等现场快速检测[14]。本研究选择沙门氏菌invA保守基因作为靶序列设计特异性引物,该基因表达的侵袭蛋白存在于所有沙门氏菌中且决定细菌进入宿主上皮细胞的能力,与沙门氏菌的致病性密切相关,以此为靶基因设计的PSR特异性引物保证了检测方法的可行性。此外,PSR法引物设计更加简单方便,加速引物的使用可提升反应效率,实现在短时间内完成对靶基因的大量扩增。特异性和敏感性试验结果表明,PSR法与之前建立的LAMP方法相比,两者具有相同的特异性,均可特异性地检测出猪源沙门氏菌,而对12株其他致病菌无扩增反应;但前者的敏感性较高,检测下限可达5×101cfu/mL,为LAMP法的10倍,可承担对更低细菌浓度的检测任务。此外,应用PSR法对分离的132份疑似猪源沙门氏菌腹泻样本进行检测,其检测结果与细菌培养法检测结果一致,说明PSR法作为新型、快速检测手段可以完成对猪源沙门氏菌的现场检测。此外,由于本实验临床样本数量较少,虽然PSR具有较高敏感性,且检测结果中无假阳性出现,但为了达到基层兽医部门的使用要求,还须更多的临床样本对该方法进行评价和检验。
本研究选择琼脂糖凝胶电泳分别对PSR法和LAMP法的扩增产物进行分析,但在制胶过程中需要用溴化乙锭染色,该试剂因具有强致癌性而危害人体健康,应尽量减少该染料的使用。因此本研究选择SYBR Green I染料为反应的指示剂,在反应结束后向管内滴加少量的染料即可对反应结果做出判定,提高了PSR法的检测效率。但由于反应结束后管内会产生的大量气溶胶,一旦打开反应管会对周围环境造成污染。目前,已有学者设计出了用于LAMP法的恒温反应管,可在反应结束后不开盖而添加荧光染料,克服了开盖产生气溶胶污染的缺陷,但由于价格昂贵限制了该反应管在基层部门的普及[15]。
综上所述,本研究所建立的快速检测猪源沙门氏菌的PSR法,不仅具有时间短、成本低、特异性强的特点,且不需要依赖复杂仪器设备与专业的技术操作,适合在基层兽医部门推广应用。
