2017年我国4个省份屠宰场猪链球菌的分离鉴定及耐药性分析
2019-04-17王长珍刘文宇刘思国张万江
王长珍,刘文宇,祝 瑶,栾 天,于 淼,杨 亲,刘思国,张万江*
(1.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室/动物细菌病研究室,黑龙江 哈尔滨150069;2.哈尔滨市产品质量监督检验院,黑龙江哈尔滨150036)
猪链球菌是一种重要的人畜共患病原菌,是猪最重要的几种细菌病病原之一。猪链球菌能够引起猪的脑膜炎、败血症、心内膜炎、肺炎、多发性浆膜炎等多种疾病[1]。根据菌体荚膜抗原特性的不同,猪链球菌可以分为33个血清型(1-31型、34型、1/2型),近年来报道有荚膜新型猪链球菌的出现[2]。猪链球菌病通常呈地方性流行,大部分病猪呈败血性经过,且短时间内就会蔓延至整群[3],给我国养猪业带来严重的经济损失。其中2型猪链球菌(S.suis serotype 2)感染性最强,除了感染猪,还能通过直接接触感染人。1998年和2005年,我国江苏省和四川省分别暴发了大规模的猪链球菌感染疫情,共计感染229例,死亡52例,引起了公共卫生和科学研究领域的极大关注。猪链球菌病的防控,主要通过疫苗免疫和抗生素治疗,但由于猪链球菌血清型复杂,地区差异等原因,疫苗免疫效果往往不理想,因此抗菌药物是目前治疗猪链球菌病最有效的手段。然而,随着养殖场抗菌药物的大量不合理使用,猪链球菌耐药性问题日益突出。为了及时监测我国不同地区猪链球菌的流行情况和耐药状况,本研究在2017年采集我国河南、黑龙江、广东、宁夏4个畜牧养殖大省大型屠宰场的猪肺脏样品,通过细菌分离纯化,共鉴定猪链球菌46株并确定其血清型,通过PCR技术,药敏试验,脉冲场凝胶电泳(PFGE)技术进一步分析,为采取有效措施应对不同地区猪链球菌病提供流行病学实验依据。
1 材料与方法
1.1 菌株及病料样品 大肠杆菌ATCC25922、金黄色葡萄球菌ATCC29213、沙门氏菌H9812均由本实验室保存;578份健康猪肺样品来源于2017年河南、黑龙江、广东、宁夏4个地区屠宰场。
1.2 主要试剂 THB培养基购自美国BD公司;MH培养基购自北京陆桥生物技术有限公司;无菌脱纤维羊血、无菌脱纤维马血均购自上海源叶生物科技有限公司;马血清购自HyClone公司;15种抗生素均购自中国兽医药品监察所;低熔点琼脂糖(Seakem®Gold.Agarose)购自Lonza公司;SmaⅠ酶、XbaⅠ酶、TaqDNA聚合酶及蛋白酶K均购自TaKaRa公司;细菌基因组提取试剂盒购自天根生化科技(北京)有限公司;猪链球菌保守基因gdh引物[4]、猪链球菌血清型和荚膜新型引物[2,5]、部分耐药基因引物[6-7]、毒力基因引物[8]参照相应文献设计,16S rRNA通用引物、optrA、lsa(E)耐药基因引物均由本实验室设计。所有引物由华大基因有限公司合成(表1)。

表1 引物序列Table 1 Primers used in the study
1.3 分离菌株的培养及纯化 利用接菌环蘸取肺脏内切面组织直接划线于THB血琼脂平板上,37℃过夜培养。挑取可疑单菌落在添加5%马血清的THB中37℃过夜培养,菌液划线于血琼脂平板上,如此重复直至血琼脂平板菌落单一。参照文献[4],利用猪链球菌保守基因gdh引物进行PCR初步鉴定,采用16S rRNA通用引物进行种属鉴定。将分离菌株保存在终浓度为25%的甘油中,-80℃备用。
1.4 分离菌株血清型及荚膜新型分型 采用文献中分型方法及分型引物[2,5],利用试剂盒提取分离菌株全基因组DNA,进行PCR扩增,确定猪链球菌的血清型及新发现的荚膜新型血清型。
1.5 分离菌株药物敏感性测定 参照美国CLSI推荐的方法,采用微量肉汤稀释法对分离株进行药物敏感性试验,测定46株分离菌对阿奇霉素、利奈唑胺、阿莫西林、万古霉素、青霉素、红霉素、多西环素、利福平、大观霉素、氟苯尼考、头孢噻呋、林可霉素、泰妙菌素、庆大霉素、恩诺沙星15种抗生素的最小抑菌浓度(MIC),分析猪链球菌对15种抗生素的耐药表型。质控参考菌株为大肠杆菌(ATCC25922)和金黄色葡萄球菌(ATCC29213)。
1.6 分离菌株耐药基因和毒力基因检测 参考文献[6-7]利用PCR方法检测分离菌株相关耐药基因。参照文献[8]利用PCR方法检测分离菌株epf、mrp、orf2、gapdh、sly、fbps毒力基因。
1.7 分离菌株的亲缘关系分析 参照文献[9]的方法,利用PFGE技术对分离的猪链球菌分型,并分析其亲缘关系。将分离菌划线接种于含有7%绵羊血的THA平板,37℃培养过夜后挑取单菌落于添加5%马血清的THB中培养至对数生长期,收集菌体将其包埋在1%SKG低熔点胶中,以200 μg/mL的蛋白酶K 50℃水浴过夜,SmaⅠ30℃处理4 h~5 h;采用1%SKG低熔点胶,0.5×TBE电泳液进行PFGE,设置电压6 V/cm,变换角度120°,脉冲时间2.2 s~54.2 s,电泳时间18 h。采用沙门氏菌H9812作为参考株,以XbaⅠ酶切后作为分子量标准,利用凝胶成像系统获取图片并保存。PFGE结果利用BioNumerics7.6软件进行亲缘关系分析。
2 结果
2.1 分离菌株分离及鉴定结果 将采集的肺脏组织划线接种于THB血琼脂平板上,长虫的菌落呈半透明或灰白,表面光滑针尖状,有的菌落周围出现β溶血环。纯化后利用猪链球菌保守基因gdh引物进行扩增以及通过16S rRNA进行种属鉴定。共鉴定猪链球菌46株。
2.2 分离菌株血清型及荚膜新型分型结果 利用PCR扩增猪链球菌不同血清型的标志性基因。结果显示,46株猪链球菌分为12种血清型和3种荚膜新型(表2)。每个地区的猪链球菌优势血清型各不同,且不同地区血清型存在多样性。意外的是,在广东和宁夏屠宰场的健康猪肺脏中检出了致病力最强的2型猪链球菌,其次还在两个屠宰场各分离到了4株致病力仅次于2型的9型猪链球菌。屠宰环节是肉制品进入餐桌的最后一个环节,2型和9型高致病力猪链球菌在健康猪肺脏中的发现,无疑给食品安全和人的健康带来了潜在威胁,应该引起高度重视。
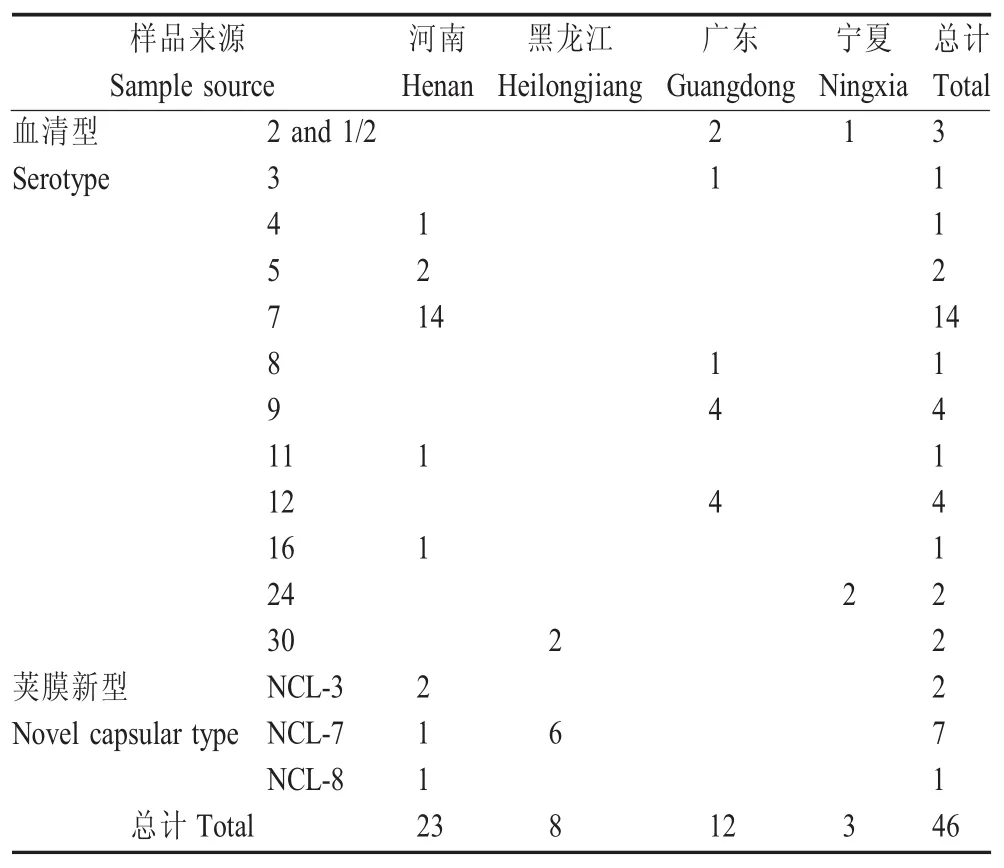
表2 猪链球菌血清型及荚膜新型分型Table 2 Serotype and novel capsular polysaccharide loci typing
2.3 分离菌株药物敏感性测定结果 参照美国CLSI推荐的方法,采用微量肉汤稀释法对分离菌株进行药敏试验。由于美国CLSI没有给出大观霉素、林可霉素、泰妙菌素、庆大霉素这4种抗生素的MIC折点值,所以采用MIC50来进行药物敏感性统计。结果显示,分离菌株对多种不同类型抗生素耐药严重,耐药谱广,其中对红霉素、阿奇霉素、多西环素的耐药率较高,对林可霉素,泰妙菌素的MIC50高达64μg/mL,对大观霉素和庆大霉素MIC50分别为32 μg/mL和1 μg/mL(表3)。以上结果表明分离株整体耐药水平较高,但所有分离株对万古霉素均敏感。
2.4 分离菌株耐药基因和毒力基因检测结果 猪链球菌耐药基因检测结果显示,分离菌株携带红霉素类耐药基因erm(B)最高达97.83%,与药敏试验中分离菌株对红霉素(91.30%)和阿奇霉素(86.96%)的耐药性相似。携带四环素类耐药基因tet(O)较高达89.13%,与药敏试验中菌株对多西环素(80.43%)的耐药性相似(表4)。猪链球菌毒力基因检测结果显示,毒力因子gapdh和fbps检出率均高达100%。毒力基因orf2检出率达95.56%,其在强弱株之间的基因序列存在差异,这种差异可能导致菌株致病性不同。毒力因子mrp和epf是强毒菌株标志,分离菌株携带率分别为50.00%和6.52%。另外一种毒力基因sly检出率为21.74%。表明不容忽视健康猪群中强毒菌株的存在。
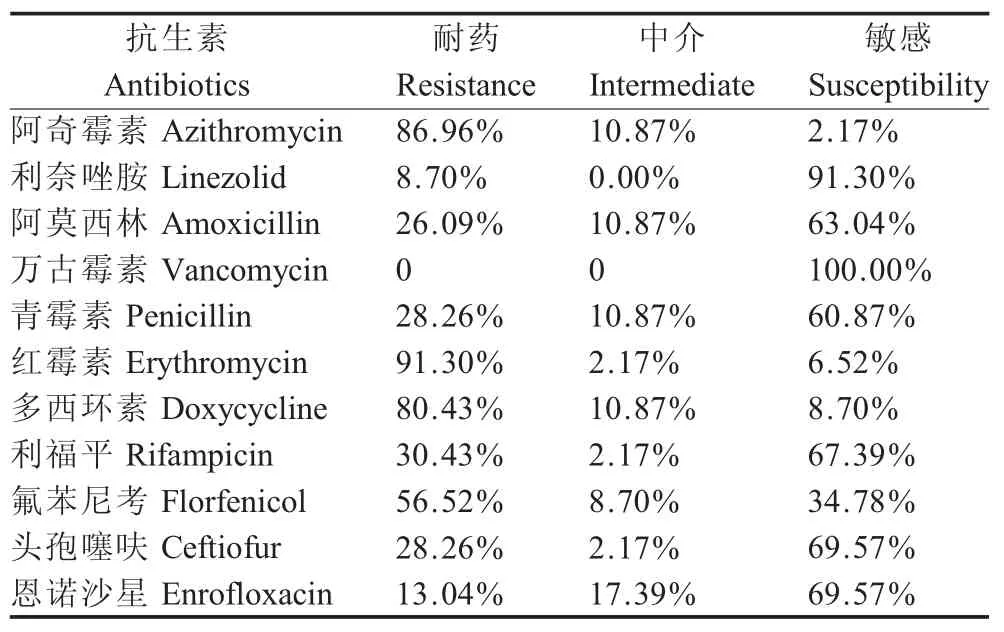
表3 46株分离猪链球菌对常见药物的敏感性试验结果Table 3 The antimicrobial susceptibility rate of 46 Streptococcus suis strains
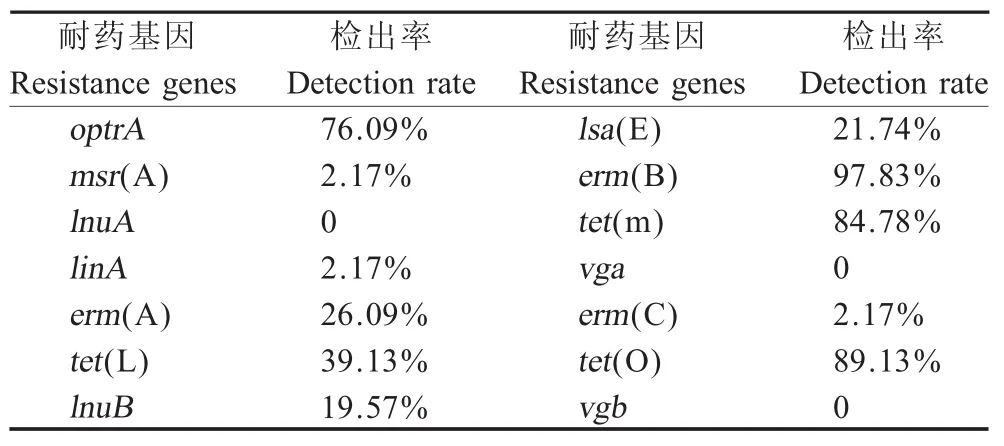
表4 46株猪链球菌耐药基因统计结果Table 4 Statistical results of S.suis resistance genes
2.5 猪链球菌的PFGE分型结果 利用PFGE技术对分离的猪链球菌进行亲缘性分析。结果显示,同一地区分离的猪链球菌存在几种相同或相似的谱型,如来自河南的菌株HN-3、HN-7、HN-8、HN-18、HN-19、HN-20有相同的PFGE谱型,表明同一地区的菌株存在克隆传播现象。河南、黑龙江、广东、宁夏4个不同地区分离的猪链球菌谱型总体差异较大,亲缘关系较远。但是,河南的菌株HN-4与黑龙江的菌株HLJ-3、HLJ-6、HLJ-9具有相同的谱型(图1),表明不同地区也有可能存在相同谱型。
3 讨论

图1 43株猪链球菌PFGE分型结果Fig.1 The PFGE profiles of 43S.suis strains
本研究通过对河南、黑龙江、广东、宁夏四省市采集的578份健康猪肺脏样品进行分离纯化,共分离猪链球菌46株。王松华对2011年至2015年河南及其周边地区规模养殖场和部分散养户发病猪的肺脏进行猪链球菌的分离纯化,共分鉴定出72株猪链球菌血清2型(53.3%),14株血清7型(10.4%),14株血清9型(10.4%)[10]。王宇婷等人对黑龙江省在2007年~2015年接诊的355头病死猪进行猪链球菌分离鉴定,其中未分出血清型的猪链球菌占75.6%(62/82)[11]。刘琪等人对广东地区猪群猪链球菌进行流行病学调查,共检测出19种血清型,其中主要流行的是血清2型(16.8%)[12]。本研究对分离菌分型鉴定出12种血清型和3种荚膜新型,不同地区优势血清型各不同,血清7型是河南分离株中的优势血清型,与王松华的血清2型优势血清型结果有所不同,原因可能是发病猪群和屠宰场健康猪群中猪链球菌血清型携带率不同,2型猪链球菌致病性最强,危害最大,因此在发病猪群中作为优势血清型的可能性较大。在黑龙江地区共分离出8株猪链球菌,荚膜新型占75.0%(6/8),王宇婷等人未检测荚膜新型,因此未分出血清型的占75.6%,这说明对黑龙江地区猪链球菌的防控不应仅仅局限于以往常见的33种血清型,应该重视荚膜新型的高分离率,对其所致疾病作出积极防控。在广东地区分离的12株猪链球菌中,血清9型(33.3%)和血清12型(33.3%)为优势血清型,与刘琪等人的结果不同,可能由于猪链球菌是不可忽视的威胁猪群健康的病原菌,而广东是畜牧业大省,发展迅速,针对以往流行且危害大的血清2型进行疫苗免疫,加之采样的区域性和时间性不同,结果可能会有所不同。这从另一方面也充分表明猪链球菌血清型复杂,即使同一地区的流行情况也需及时监测。
进一步采用微量肉汤稀释法进行药物敏感性试验测定46株猪链球菌对临床常用的15种抗生素的耐药谱,这些菌株均存在广泛耐药,其中对红霉素的耐药率高达91.3%,结果与刘修权等人对北京地区4个规模化猪场的猪链球菌对红霉素耐药率达92.7%相一致[13]。大环内酯类、林克酰胺类和四环素类抗菌药依然是临床治疗猪链球菌感染的常用药物,但从药敏结果来看,猪链球菌对阿奇霉素、红霉素、林可霉素、多西环素均表现明显的耐药趋势。作为人医临床治疗革兰氏阳性菌感染“最后一道防线”的药物-万古霉素,兽医临床上限制使用,本研究中所有菌株均对其敏感,与何宏魁等人的结果一致[14]。这提示应该合理使用抗生素,建议治疗时先进行药敏试验来选用敏感的抗生素。利用PCR方法检测耐药基因,经初步分析发现猪链球菌对抗生素的耐药性和耐药基因有一定的关联。但具体耐药机制还有待进一步研究。研究表明,猪链球菌致病性的强弱与毒力基因存在密切关联[8],本研究所检测到的毒力基因中,sly和epf检出率分别为21.74%和6.52%,低于王红宝等人测定的山西省致病性猪链球菌毒力基因sly(72.5%)和epf(58.75%)的检出率,这表明健康猪群和致病猪群中猪链球菌毒力因子有差异[15]。PFGE技术能显示不同猪链球菌菌株之间复杂的基因差异,适合应用流行病学的研究。通过PFGE技术对猪链球菌进行亲缘关系分析,结果显示,不同地区分离菌株谱型差异明显,而同一地区分离菌株谱型相似或相同,提示同一地区猪链球菌存在克隆传播现象。相同PFGE谱型存在不同的血清型和毒力基因型,表明PFGE基因型和血清型、毒力基因型无相关性。本研究为了解我国不同地区猪链球菌的流行现状以及防控猪链球菌病提供参考依据。
