鲫鱼类志贺邻单胞菌的鉴定及其致病机制研究
2019-04-17谈永萍
傅 芳,谈永萍,王 利,*,张 桦
(1.西南民族大学 青藏高原动物遗传资源保护与利用重点实验室,四川 成都610041;2.西南民族大学 生命科学与技术学院,四川 成都610041)
类志贺邻单胞菌(Plesiomonas shigelloides)属弧菌科邻单胞菌属,且为其唯一种属。该菌是一种机会致病菌,其作为病原菌存在于动物体与水环境中,尤其发生在鱼体中,被认为是多种水产动物消化道炎症的新病原[1-2]。类志贺邻单胞菌可单独或混合感染中华鳖、暗纹东方豚等水生动物[3-4],这给水产养殖业造成了重大的经济损失,也给消费者带来了一定的安全隐患。现已从鲈鲤[2]、江鳕[5]、青鱼[6]等多种水产动物中分离鉴定出类志贺邻单胞菌,但未见类志贺邻单胞菌对鲫鱼致病性的研究报道。
鲫鱼(Carassius auratus)属鲤形目鲤科鲫属动物,是我国常见的淡水鱼类,广泛分布于各地水域,其肉质细嫩、营养价值高。由于高密度的集中养殖及不适当管理,病害频繁暴发,细菌性疾病成为鲫鱼养殖过程中的常见病[7]。近年来大量关于鲫鱼细菌性疾病的研究被报道,主要包括维氏气单胞菌[8]、金黄杆菌[9]、维隆气单胞菌[10]等。成都市某养殖场出现少量患病鲫鱼,主要症状表现为腹部红肿出血、腹鳍腐烂、肛门肿大等。因此,本研究从患病鲫鱼中分离出F01菌株,并对其进行鉴定,研究该菌株对鲫鱼的致病性及其致病机制等,以期为该菌导致的疾病防控提供实验数据。
1 材料与方法
1.1 主要实验材料 患病鲫鱼取自四川省成都市某养殖场,体长(12±2)cm。人工感染试验所用鲫鱼购自成都市另一未发病养殖场,鱼体色正常、体表无损伤、活力较好,平均体长为(14±2)cm,暂养3 d后用于后续试验。
LB培养基、MH培养基均购自青岛高科园海博生物技术有限公司;细菌基因组DNA提取试剂盒购自天根生化科技有限公司;细菌微量生化反应管、药敏试纸均购自杭州微生物试剂有限公司;血清学指标检测试剂盒购自南京建成生物工程研究所;1.1×T3 Super PCR Mix、DL2000 DNA Marker均购自北京擎科新业生物技术有限公司;RNAiso Plus、PrimeScriptTMRT reagent Kit with gDNA Eraser、TB GreenTMPremix ExTaqTMⅡ均购自宝生物工程(大连)有限公司。
1.2 细菌分离鉴定 无菌条件下采集发病鱼肝脏、脾脏等组织样本,十字交叉剪开组织后用接种针穿刺于组织内,划线接种于LB固体培养基,28℃下倒置培养过夜,挑取单菌落,接种于LB液体培养基中28℃培养12 h,进行革兰氏染色观察,并参照《伯杰氏系统细菌学手册》中的细菌鉴定方法,采用细菌微量生化鉴定管对待测菌株进行各项生化指标测定。
同时采用细菌基因组DNA提取试剂盒提取分离菌株基因组DNA为模板,利用细菌16S rDNA通用引物(5'-AGAGTTTGATCCTGGCTCAG-3'/5'-CTAC GGCTACCTTGTTACGA-3')进行PCR扩增,引物由上海生工生物工程技术服务有限公司合成。扩增产物由上海生工生物工程技术服务有限公司测序,对测序结果进行Blast同源性比对,并构建系统进化树。
1.3 药物敏感试验 按照美国临床实验室标准委员会(CLSI)推荐的抗菌药物敏感性试验执行标准,采用K-B纸片扩散法进行药敏试验,测量抑菌圈直径,分析分离菌药物敏感性。
1.4 分离菌动物回归试验 将分离菌株接种于LB液体培养基,28℃培养18 h,7 200 r/min离心10 min,弃上清后经灭菌生理盐水漂洗3次。取暂养3 d的健康鲫鱼,随机分为4组,每组12尾。设3个实验组,分别注射不同浓度的菌悬液(A组注射菌液浓度为4.75×108cfu/mL,B组浓度为4.75×106cfu/mL,C组浓度为4.75×104cfu/mL),0.3 mL/尾,对照组(D组)腹腔注射等量灭菌生理盐水。试验周期为10 d,每日观察记录各组鲫鱼发病症状。试验结束后对未死亡的鱼剖检观察肝、脾等器官病变情况;取心、肝、脾、肾、肌、鳃6种组织,按常规方法制作切片用于病理组织学观察;对试验中死亡病鱼进行细菌分离鉴定,并通过SPSS 24.0计算分离菌半数致死量LD50。
1.5 患病鱼血清学指标检测 在注射无菌生理盐水或不同浓度菌悬液10 d后,分别在A、B、C、D 4组中随机取3尾尾静脉采血,分离血清后利用碱性磷酸酶(AKP)、溶菌酶(LZM)和丙二醛(MDA)试剂盒分别测定各组鲫鱼血清学指标。
1.6 患病鱼免疫因子检测 感染10 d后迫杀感染鲫鱼,分别无菌采集对照组(D组)及实验组(A组、B组、C组)脾脏、头肾组织于液氮中快速冷冻,各组织剪取100 mg加入1 mL RNAiso Plus提取总RNA,经1%琼脂糖凝胶电泳及BioSpec-nano分别检测RNA的完整性和提取质量。利用PrimeScriptTMRT reagent Kit with gDNA Eraser反转录为cDNA,以其为模板,采用荧光定量RT-PCR检测鲫鱼HSP70、IL-8、TLR22基因在脾脏、头肾中的转录水平,以beta-actin作为内参基因,引物详见表1。扩增体系(10 μL)均为:模板cDNA 1 μL,上、下游引物(10 μmol/L)各0.8 μL,ddH2O 2.2 μL,TB GreenTMPremix ExTaqTMⅡ5.2 μL;扩增程序分别为:95℃3 min;95℃10 s,53.6℃(beta-actin、HSP70)/52.8℃(IL-8、TLR22)20 s,72℃20 s,循环39次;溶解曲线65℃~95℃每5 s增加0.5℃。

表1 检测内参基因及各免疫因子的荧光定量RT-PCR引物信息Table 1 Primers used in fluorescence quantitative RT-PCR
2 结果
2.1 分离菌的鉴定结果 分离的菌株在LB固体培养基上呈白色不透明状、凸起状圆形、表面光滑湿润的菌落。革兰氏染色镜检结果显示,病原菌呈革兰氏阴性。参照《伯杰氏系统细菌学手册》鉴定结果显示,该菌能发酵葡萄糖,产赖氨酸脱羧酶、精氨酸脱羧酶、鸟氨酸脱羧酶,硝酸盐等,不发酵木糖、阿拉伯糖、甘露醇,不产尿素、明胶不液化等。
以菌株基因组DNA为模板,PCR扩增分离菌的16S rDNA基因,结果显示扩增得到了1 431 bp的目的基因,测定的菌株序列提交至GenBank,序列号为MK397781。序列分析结果显示,16S rDNA基因序列与类志贺邻单胞菌16S rDNA基因序列相似性高达99%。构建系统进化树结果显示,分离株与类志贺邻单胞菌聚为一族(图1)。上述结果表明分离菌株为类志贺邻单胞菌,将其命名为F01。
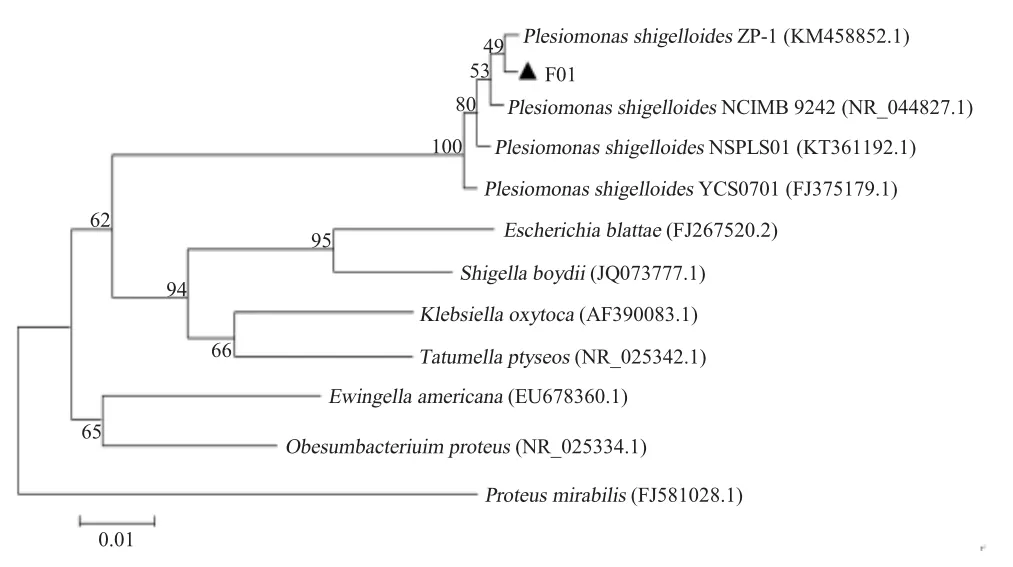
图1 基于16S rDNA的分离菌株进化分析Fig.1 Phylogenetic tree of Plesiomonas shigelloides
2.2 药物敏感试验 药物敏感性测试结果显示,在23种供试药物中,分离得到的F01菌株对头孢曲松、头孢呋辛、氧氟沙星等7种抗生素敏感,对头孢氨苄、头孢唑啉、丁胺卡那等5种抗生素中度敏感,对哌拉西林、克林霉素、多西环素等11种抗生素耐药(表2)。结果表明,可选用头孢菌素类、喹诺酮类等药物治疗由类志贺邻单胞菌引起的鲫鱼细菌性疾病。
2.3 动物回归试验结果 用分离得到的F01菌株感染健康鲫鱼,结果显示在注射4.75×108cfu/mL菌悬液4 d后鲫鱼开始死亡。各浓度菌悬液对鲫鱼的死亡率结果分析显示:A组的累积死亡率为66.67%,B组为25.00%,C组为8.33%;对照组(D组)鲫鱼未见异常(表3)。经计算,F01菌株的半数致死量LD50为2.09×107cfu/mL。注射F01菌株的患病鲫鱼主要表现为摄食量减少,体表粘液增加,腹部红肿出血且含有大量腹水,鳍条出血腐烂,肛门红肿;解剖可见肝脏出血,脾脏、肾脏有出血点,与自然发病的鲫鱼症状一致。从人工感染鲫鱼中重新分离菌株进行分子鉴定,结果显示与感染所用的类志贺邻单胞菌一致。以上结果表明可确定该菌株为患病鲫鱼的病原菌。
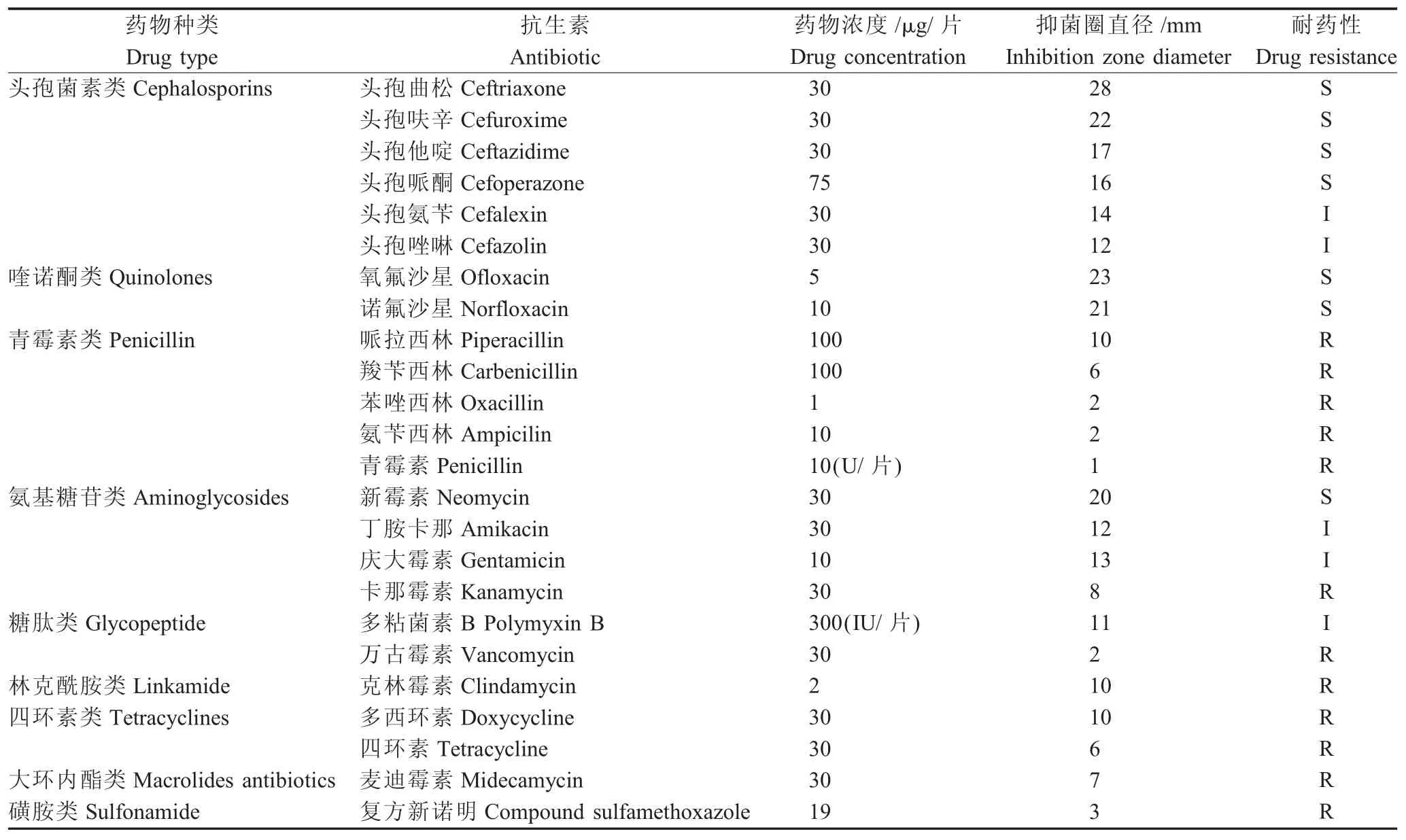
表2 F01菌株的药敏试验结果Table 2 Antibiotic sensitivity test results of strain F01
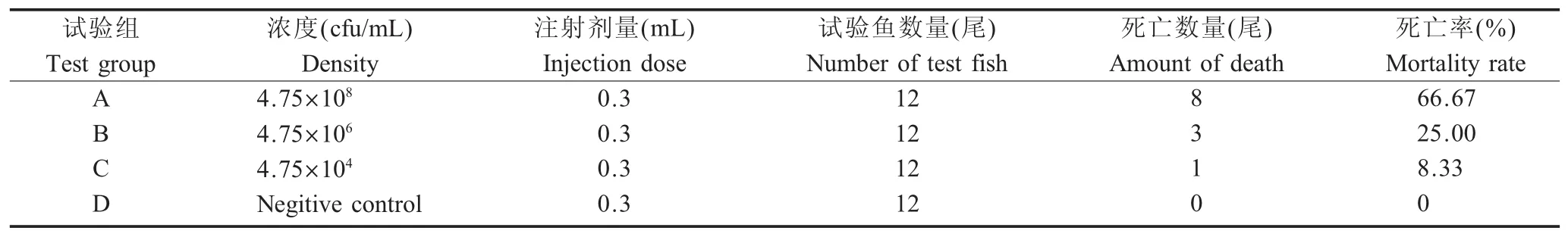
表3 F01菌株的回归感染试验结果Table 3 Regression infection test results of strain F01
2.4 患病鱼组织病理变化 F01菌株感染鲫鱼后,其病理组织学变化主要表现在心、肝、脾、肾、肌和鳃组织(图2):心肌细胞肿胀,结构紊乱,并伴有肌纤维断裂现象;肝细胞肿胀变性,肝小叶界限模糊,并伴有大面积出血点;脾脏组织有少量铁黄素沉积,白髓萎缩,所占面积减小,脾髓充血;肾脏结构紊乱,细胞肿胀变性,肾腔狭窄并出现透明管型,肾脏组织充满淋巴细胞,并伴有多处出血点,有明显的炎症反应;肌肉细胞间隙增大,结缔组织疏松;鳃细胞数量增多、肿胀,有增生和脱落现象。
2.5 患病鱼血清学指标的测定结果 对感染不同浓度F01菌株鲫鱼血清学指标进行检测,结果显示:在AKP活力检测中,实验组鲫鱼均显著高于对照组(p<0.05),且B组活力最高,与A、C组无显著差异;在LZM活性测定中,B组鲫鱼活性最高,且显著高于对照组(p<0.05),但其均与A、C组无显著差异;在MDA活力检测中,实验组鲫鱼均显著低于对照组(p<0.05),且B组含量最低(表4)。结果表明,不同浓度F01菌株感染鲫鱼后均能使其血清中AKP活力、LZM活性显著增高,MDA活力显著降低,且B组菌株作用最为明显。
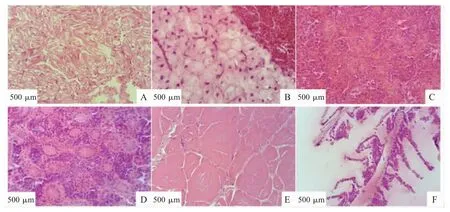
图2 感染鲫鱼组织病理变化Fig.2 Histopathological changes of infected Carassius auratus
2.6 患病鱼免疫因子转录水平的检测结果 对感染不同浓度F01菌株的鲫鱼脾脏、头肾组织免疫因子转录水平进行检测。结果显示:其免疫因子HSP70、IL-8和TLR22基因在脾脏组织中转录水平均显著高于对照组(p<0.05),且均在B组中的转录水平最高;在头肾组织中,免疫因子HSP70、IL-8和TLR22基因在B组鲫鱼中的转录水平显著高于A、C组(p<0.05);且3种免疫因子在感染鲫鱼脾脏组织中转录水平明显高于头肾组织(图3)。表明F01菌株感染鲫鱼后免疫因子HSP70、IL-8和TLR22基因在脾脏中的转录水平均显著上升,且B组菌株作用最为明显,与血清学指标分析结果一致。
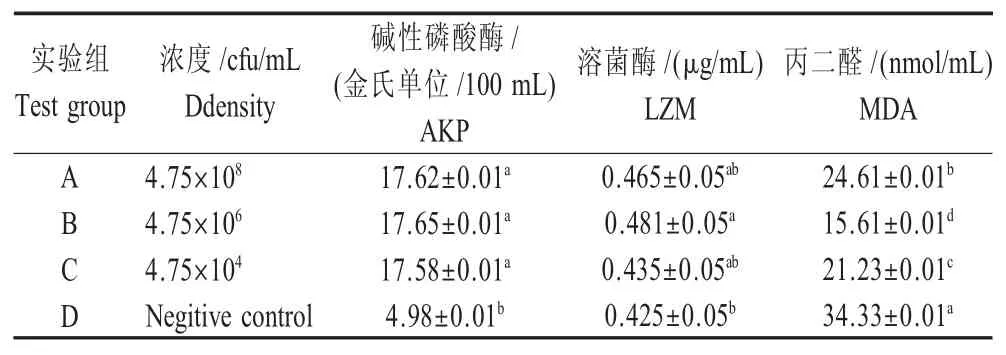
表4 感染鲫鱼血清学指标检测结果Table 4 Serological index results of infected Carassius auratus
3 讨论
类志贺邻单胞菌为条件致病菌,可在水生动物及各种哺乳动物肠道内定植,能引发人类腹泻、败血症等症状或疾病[11]。本实验中临床表现与张效平等[5],叶键等[6]使用类志贺邻单胞菌感染江鳕、青鱼的临床症状相似。组织病理结果与人工感染尼罗罗非鱼[12]、鲟鱼[13]相似。表明该菌感染鱼类的临床表现和组织病理变化均较为类似,这为类志贺邻单胞菌对鲫鱼的病理损伤研究提供参考资料。
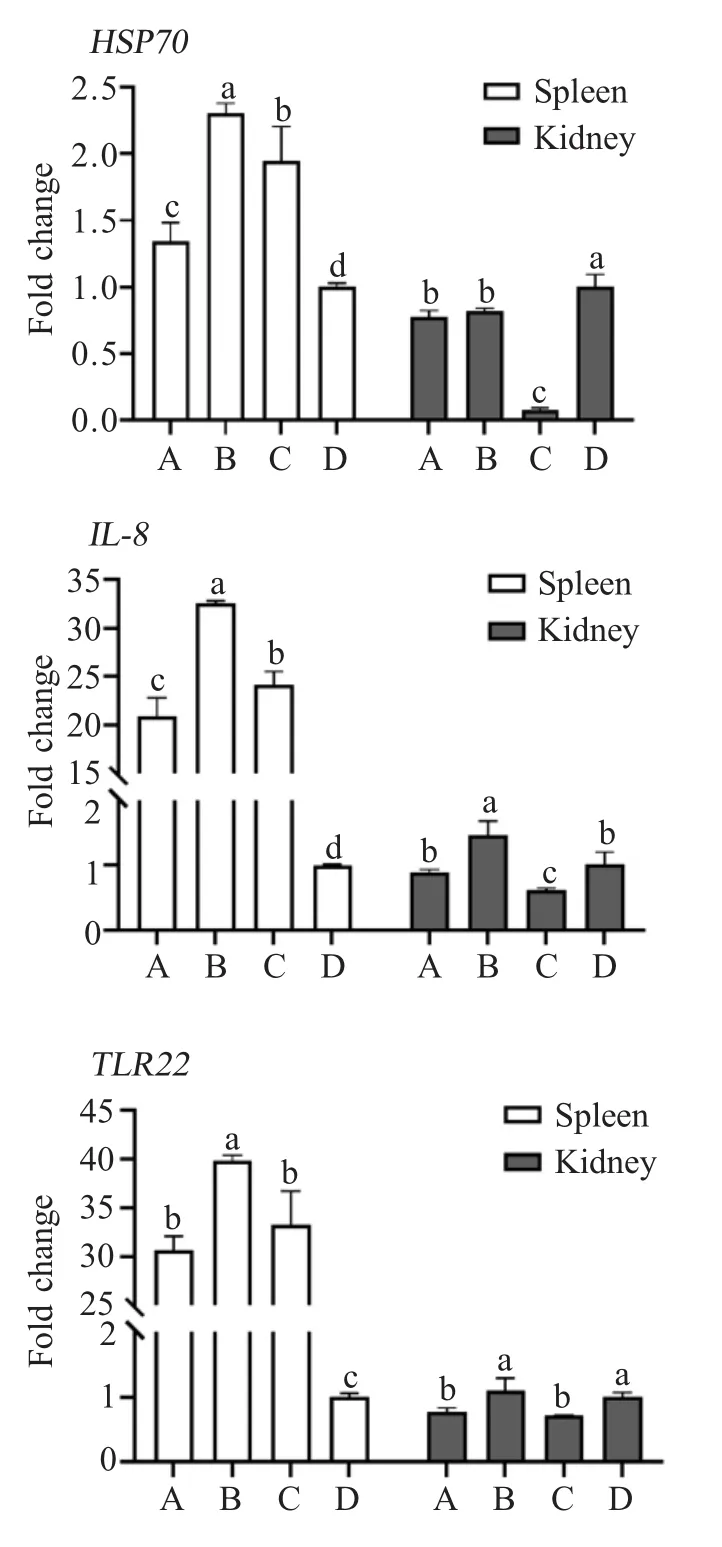
图3 各组鲫鱼各脏器各免疫因子转录水平的检测结果Fig.3 Transcript levels of genes in different tissues of Carassius auratusin each group
对类志贺邻单胞菌药敏研究显示,从濒死黄颡鱼中分离出的该菌对先锋VI、菌必治和舒普深等16种药物均高度敏感[14],从患病大鲵中分离到的该菌对头孢他啶、头孢噻肟和氯霉素等18种药物敏感[15]。以上研究结果与本文存在较大差异,本研究发现该菌株仅对头孢曲松、头孢呋辛和新霉素等7种抗生素高度敏感,这可能是由于养殖过程中抗生素不科学使用导致该病原菌已产生多重耐药,以及可能与菌株来源和各地抗生素药物使用不同等原因有关。药敏试验结果充分说明,在该病害的防治过程中,应参考分离株的耐药性结果,合理使用抗生素,才能达到科学有效的治疗目的。
血清中的AKP、LZM和MDA是反应水产养殖动物非特异性免疫应答的有力指标,可识别病原体,使病毒失活,并在一定程度上反映鱼体细胞损伤程度,在鱼类非特异性免疫中起重要作用。感染鲫鱼血清学指标结果可为其免疫应答研究提供重要的参考价值。研究显示杀鲑气单胞菌感染大西洋鲑后其AKP活力显著升高[16],这与本实验中F01菌株感染鲫鱼后的结果相符;嗜水气单胞菌感染中华鳖后LZM活性有所上升[17],这也与本实验中的分离菌感染鲫鱼后的结果一致;维氏气单胞菌感染西伯利亚鲟后MDA活力显著降低[18],这与本实验中F01菌株感染鲫鱼后的结果相类似。综上所述,不同浓度分离菌感染鲫鱼后均能刺激机体产生免疫应答反应,表现为鲫鱼血清AKP、LZM活性上升、MDA活力下降,在一定程度上刺激了鲫鱼的非特异性免疫。
HSP70、IL-8与TLR22作为免疫反应中的重要细胞因子,参与机体先天性免疫反应调节,可识别病原微生物,消除应激产生的胞内异常蛋白,介导T、B细胞增殖、分化,增强机体自身免疫反应。研究显示嗜水气单胞菌感染鱼后HSP70基因相对转录水平显著升高[19],与本实验结果一致;小林三代虫感染金鱼后IL-8具有较高的表达量[20],与本实验结果相类似;嗜水气单胞菌感染后TLR22在脾脏和头肾中的转录水平明显上调[21],与本实验结果相符。综上所述,F01菌株感染鲫鱼后HSP70、IL-8和TLR22基因在其脾脏、头肾中的转录水平均发生了变化,且在脾脏中的转录水平显著上升。这些血清学指标显示该菌株对鲫鱼的病理损伤结果一致,均表明该菌刺激了鲫鱼的免疫应答反应。本研究为在分子水平探究类贺邻单胞菌致病机制奠定基础。
