美味牛肝菌多糖对急性肝损伤小鼠的保肝作用
2019-04-16郑俏然李文峰高晓旭
郑俏然 张 恒 李文峰 陶 雯 周 凤 高晓旭
(1.长江师范学院现代农业与生物工程学院,重庆 408100;2.雅安职业技术学院药学检验系,四川 雅安 625014)
美味牛肝菌又称白牛肝菌、大脚菌,为担子菌亚门层菌纲菌目牛肝菌科大型菌根食用真菌[1]。菌盖呈扁半球型或稍平展,在重庆彭水一带生长较多,因肉厚细软味道鲜美,深受当地百姓喜爱。研究发现,美味牛肝菌液体培养菌丝体和野生子实体均含有蛋白质、多糖、氨基酸、脂肪、纤维素、矿物质等多种营养成分[2-3],具有增强免疫[4]、抗氧化[5]、抗肿瘤[6]、降血脂[7]等作用,经济价值极高。
肝脏是人体最大的腺体器官,在药物和有毒化学物质代谢中发挥着重要的作用。肝脏极易受有毒化学物质损伤,造成肝脏代谢功能紊乱。目前肝损伤已成为了尤为突出的全球性健康问题[8-10]。多糖是牛肝菌所含的活性物质之一,具有明显的抗S-180肿瘤[11]、抗氧化[12]、保护肾脏[13]与肝脏[14]等功效。笔者团队[15]前期研究发现,美味牛肝菌多糖具有较强的体外抗氧化能力,但目前有关美味牛肝菌多糖对CCl4导致的急性肝损伤的保护作用还未见报道。
四氯化碳(carbon tetrachloride,CCl4)是急性肝损伤造模的经典化学物质,会直接损害肝细胞从而引起一些特异变化。试验拟采用CCl4建立急性肝损伤小鼠模型,从体内抗氧化和病理切片方面讨论美味牛肝菌多糖对急性肝损伤小鼠的保护作用,旨在为开发保肝解毒的保健食品原料提供理论和试验依据,同时为武陵山区美味牛肝菌的精深加工提供一定的参考。
1 材料与方法
1.1 材料与试剂
美味牛肝菌:重庆彭水武陵山区;
雄性昆明小鼠:清洁级,许可证号SCXK(川)2013-24,体重(20±2)g,成都达硕实验动物有限公司;
谷丙转氨酶(ALT)、谷草转氨酶(AST)、丙二醛(MDA)、还原型谷胱甘肽(GSH)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)试剂盒:南京建成生物工程研究所;
四氯化碳:分析纯,成都市科龙化工试剂厂;
AB-8大孔树脂:上海锐谷生物科技有限公司;
DEAE-52纤维素:华中海威基因科技有限公司;
基础饲料:成都达硕实验动物有限公司;
其他试剂均为国产分析纯。
1.2 仪器与设备
冷冻离心机:Heraeus MultifugeX3R型,美国Thermo Fisher Scientific公司;
高速万能粉碎机:FW80型,天津市泰斯特仪器有限公司;
旋转蒸发器:XD-52AA型,上海贤德实验仪器有限公司;
全波长扫描式多功能读数仪:Varioskan Flash型,芬兰Thermo Scientific公司;
超声波清洗机:SB-5200 DTDI型,宁波新芝生物科技股份有限公司;
全自动新型热风干燥箱:ZFD-5040型,上海智成分析仪器制造有限公司;
光学显微镜:Nikon Eclipse E100型,日本尼康公司。
1.3 试验方法
1.3.1 美味牛肝菌多糖的制备与测定
(1)美味牛肝菌多糖(Boletusedulispolysa-ccharides,BEP)的制备:将干燥的美味牛肝菌用超微植物粉碎机粉碎,60目过筛,准确称量1.00 g美味牛肝菌粉末,加入90 ℃热水30 mL,充分搅拌,置于300 W超声波清洗机中超声处理20 min,然后90 ℃水浴浸提1 h。浸提后过滤除渣,旋转蒸发仪浓缩至原体积的1/3,加入4倍体积95%乙醇醇沉,静置过夜,4 000 r/min离心15 min,取下层沉淀,依次用两次无水乙醇、一次乙醚、一次丙酮洗涤,4 000 r/min离心15 min,取下层沉淀自然风干,即为美味牛肝菌粗多糖。牛肝菌粗多糖经Sevage法脱除蛋白,再采用AB-8大孔树脂脱色,而后通过DEAE-52纤维素离子交换柱,采用NaCl溶液梯度洗脱分离,得牛肝菌纯化多糖。
(2)多糖含量测定:采用苯酚—硫酸法[16],以葡萄糖绘制标准曲线(曲线方程y=0.017 9x+0.104 1,R2=0.990 0)。经测定,美味牛肝菌多糖提取率为6.5%,多糖含量约为90.2%。
1.3.2 动物饲养及模型建立
(1)饲养条件:小鼠喂养1周,待适应环境后,随机分为5组,各组小鼠在室温22 ℃,自然光照条件下常规饲养。试验期间,BEP低、中、高剂量组按每日灌胃0.5 mL分别给予200,400,800 mg/(kg BW·d)牛肝菌多糖,空白组和模型组给予等体积0.9%的生理盐水,连续30 d。各组小鼠自由摄食、饮水。每周称重一次,以调整灌胃浓度。
(2)CCl4肝损伤模型的建立:末次灌胃1 h后,以10 mL/kg 剂量,空白组小鼠腹腔注射花生油,其他各组腹腔注射体积分数0.2%CCl4花生油溶液,禁食不禁水。造模16 h 后称重,眼球取血后以3 000 r/min离心15 min分离血清备用。脱臼处死小鼠后,立即解剖并取出肝脏,用生理盐水冲洗残血后,滤纸滤干、称重并计算肝脏指数(肝脏质量与小鼠体重的质量百分比)[17]。
1.3.3 血清指标的测定 血清谷丙转氨酶、谷草转氨酶活性按照试剂盒说明书进行测定。
1.3.4 肝脏指标的测定 取适量小鼠肝脏,按1∶9(g/mL)比例加入生理盐水,充分研磨制成质量浓度10%的肝脏匀浆,3 000 r/min离心20 min,取上清液,按照试剂盒说明书测定超氧化物歧化酶、谷胱甘肽、谷胱甘肽过氧化物酶、丙二醛含量。
1.3.5 肝脏病理组织学观察 将各组小鼠的新鲜肝脏切成小方块,浸入10%福尔马林固定,经石蜡包埋、切片,常规HE染色后,在光学显微镜下观察。
2 结果与分析
2.1 对CCl4急性肝损伤小鼠体重、肝重及肝脏指数的影响
美味牛肝菌多糖对CCl4急性肝损伤小鼠体重、肝重及肝脏指数的影响见表1。
表1 BEP对CCl4急性肝损伤小鼠体重与肝指数的影响
Table 1 Effect of BEP on body weight and liver weight indexes in mice with liver injury(n=10)

组别终体重/g肝脏重量/g肝脏指数/%空白组 38.81±1.631.18±0.10 3.02±0.21 模型组 38.19±2.921.38±0.16##3.55±0.28###低剂量组38.25±1.151.28±0.053.34±0.15∗中剂量组37.13±3.851.28±0.203.29±0.24∗∗高剂量组37.80±2.221.21±0.07∗∗3.29±0.14∗∗
† 相对于空白组,##.P<0.01,###.P<0.001;相对于模型组,*.P<0.05,**.P<0.01。
由表1可以看出,BEP对小鼠体重无显著性影响。模型组小鼠肝重及肝指数均显著高于空白对照组(P<0.01),说明CCl4会导致小鼠肝脏受损,肝脏肿大,建模成功;与模型组相比,高剂量BEP显著降低急性肝损伤小鼠的肝重(P<0.01),各剂量组BEP均显著降低了小鼠的肝脏指数(低剂量组P<0.05,中、高剂量组P<0.01),由此说明,一定剂量的BEP能有效抑制CCl4所致的小鼠肝脏肿大。
2.2 对CCl4急性肝损伤小鼠血清AST、ALT的影响
谷丙转氨酶(ALT)和谷草转氨酶(AST)是评价肝脏受损的两个重要血清生化指标。正常情况下,ALT和AST在血清中的含量较低,而当肝脏受损时,会有大量ALT和AST释放入血液,引起血清中这两种酶的活性明显提高[18]。如图1、2所示,模型组小鼠血清中ALT、AST活性显著高于空白组(P<0.001),说明造模成功。与模型组相比,低、中剂量组小鼠血清ALT、AST显著降低(P<0.01),高剂量组小鼠血清ALT、AST极显著低于模型组(P<0.001),表明BEP具有一定的保肝作用。
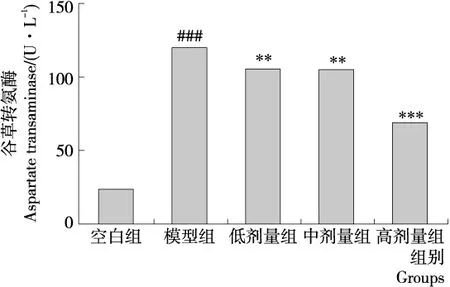
相对于空白组,###.P<0.001;相对于模型组,**.P<0.01,***.P<0.001
图1 BEP对 CCl4急性肝损伤小鼠血清中谷草转氨酶(AST)的影响
Figure 1 Effect of BEP on the serum aspartate transaminase(AST)levels in mice with liver injury(n=10)
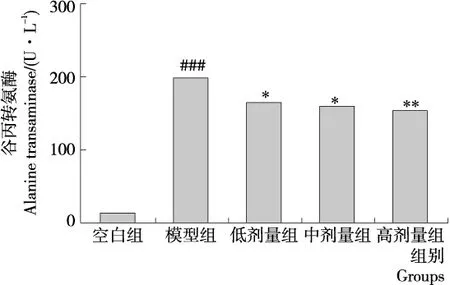
相对于空白组,###.P<0.001;相对于模型组,*.P<0.05,**.P<0.01
图2 BEP对 CCl4急性肝损伤小鼠血清中谷丙转氨酶(ALT)的影响
Figure 2 Effect of BEP on the serum alanine transaminase(ALT)levels in mice with liver injury(n=10)
2.3 对CCl4急性肝损伤小鼠肝脏组织SOD、GSH、GSH-Px活性及MDA含量的影响
如图3所示,与空白组比较,模型组CCl4造成肝组织的SOD、GSH-Px及GSH活性显著降低(P<0.01),而MDA在肝脏堆积(P<0.001),并进一步破坏细胞膜结构,说明CCl4引起的小鼠肝损伤与氧化应激有关[19];SOD是生物体内重要的抗氧化酶,能有效清除代谢过程中产生的氧自由基,减缓细胞衰老进程,其活性高低可间接反映机体的抗氧化能力[20];而MDA是脂质过氧化的终产物之一,其含量的多少直接反映了细胞损伤程度[21]。与模型组比较,灌胃BEP各剂量组小鼠肝组织中SOD活性均显著增强(P<0.05),MDA含量显著降低(P<0.01),见图3(a)和(d);GSH-Px是机体中广泛存在的一种含硒酶,同样具有清除自由基的作用,其活性越高,自由基清除速率越快,如图3(b)所示,BEP中剂量组和高剂量组肝脏GSH-Px活性显著高于模型组,而低剂量组与模型组差异不显著(P>0.05);灌胃高剂量的BEP能显著提高小鼠肝脏GSH活性(P<0.01),见图3(c)。以上结果说明,BEP能通过提高肝脏SOD、GSH-Px及GSH活性,有效清除自由基,抑制自由基引起的脂质过氧化,延缓小鼠肝脏氧化进程,提高肝脏抗氧化能力,从而降低MDA含量,避免肝脏损伤,同时,这种肝脏保护作用存在一定的剂量效应。
2.4 对CCl4急性肝损伤小鼠肝脏组织形态的影响
HE染色结果表明,空白组小鼠肝小叶结构完整、轮廓清晰,细胞排列整齐,未见细胞变性坏死及炎症细胞浸润,见图4(a);而模型组可以观察到肝细胞大片坏死,排列紊乱,细胞核大小不一,说明造模成功,见图4(b);低剂量组和中剂量组出现炎性细胞浸润,但与模型组相比,肝细胞病变减少,说明一定程度上减轻了肝细胞损伤程度见图4(c)和(d);高剂量组肝细胞结构较为完整,炎性细胞数量较少,炎性细胞浸润程度明显减轻,见图4(e),由此说明,美味牛肝菌多糖可有效保护肝细胞抵御CCl4的损害。
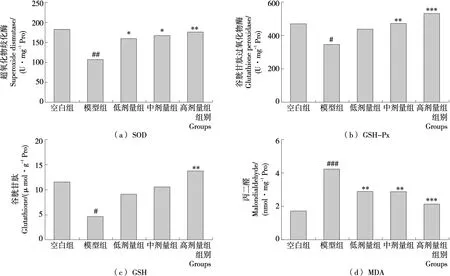
相对于空白组,#.P<0.05,##.P<0.01,###.P<0.001;相对于模型组,*.P<0.05,**.P<0.01,***.P<0.001
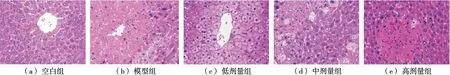
图4 小鼠肝组织切片
3 结论
研究了美味牛肝菌多糖对四氯化碳急性肝损伤小鼠的保护作用。结果表明:一定剂量的美味牛肝菌多糖能减轻CCl4引起的小鼠肝损伤,降低血清谷草转氨酶和谷丙转氨酶活性及肝脏丙二醛含量,提高肝脏抗氧化能力,对CCl4所致小鼠肝损伤有保护作用,其具体的作用机制还有待于进一步的研究。
