stomatin对非小细胞肺癌细胞中葡萄糖转运蛋白1表达及定位的影响△
2019-04-15刘明依安华英袁伟马洁2国家癌症中心国家肿瘤临床医学研究中心中国医学科学院北京协和医学院肿瘤医院分子肿瘤学国家重点实验室北京0002
刘明依,安华英,袁伟#,马洁2国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院分子肿瘤学国家重点实验室,北京0002
2北京医院生物治疗中心/国家老年医学中心,北京100730 0
stomatin蛋白是一种单向、低聚合的脂筏相关蛋白,也称作band 7.2b。该蛋白组织细胞膜的胆固醇依赖性调节过程,并参与调节离子通道的生理过程,最初是在研究遗传性口形红细胞增多症(一种溶血性贫血)病因时从正常人红细胞质膜中被分离出来[1-3]。近年来研究发现stomatin在多种恶性肿瘤中的表达异常,提示其可能参与肿瘤的发生发展过程。Montel-Hagen等[4]发现在少数无法合成维生素C的哺乳动物红细胞膜中,stomatin能够与葡萄糖转运蛋白1(glucose transporter 1,Glut1)相互作用,影响Glut1的葡萄糖吸收速率。Glut1是Glut家族的首要成员,存在于多种正常组织中(脑和红细胞中存在丰富,动物脂肪、肌肉、肝脏、胰腺中表达量一般)[5]。现阶段普遍认为在主要组织中,Glut1起到主要的葡萄糖摄取功能。据研究Glut1已被证明是恶性肿瘤细胞中葡萄糖转运的关键限速因子,在不同类型的人类肿瘤中过度表达,如肺癌、肝癌、胃癌、乳腺癌、宫颈癌和结直肠癌等[6-10]。stomatin与Glut1相互作用关系的改变可以影响葡萄糖摄取的机制尚不清楚。因此,本研究对stomatin与Glut1的相互作用进行探究,以证实stomatin基因对非小细胞肺癌细胞中Glut1表达及定位的影响。
1 材料与方法
1.1 细胞株
人肺鳞癌细胞系H520购自中国医学科学院基础医学研究所细胞中心,人肺腺癌细胞系A549购自美国模式菌种收集中心。
1.2 主要试剂和仪器
PRMI 1640培养基、牛血清白蛋白(bovine serum albumin,BSA)、磷酸盐缓冲液(phosphate buffered saline,PBS)购自美国Sigma公司;F12K培养基购自美国Gibco life technology公司;stomatin、Glut1抗体购自美国Abcam公司;LipofectamineTM2000试剂盒、Alexa Fluor 488 goat anti-mouse IgG、Alexa Fluor 594 goat anti-rabbit IgG购自美国Life Technology公司;过表达stomatin基因慢病毒、病毒感染试剂HitransG P购自中国吉凯基因公司;普通DNA产物纯化试剂盒、琼脂糖凝胶DNA回收试剂盒、高纯度质粒小提试剂盒购自中国天根生化科技有限公司;Prime ScriptTMRT Master Mix(Perfect Real Time)、SYBR Premix Ex TaqTMⅡ购自日本Takara公司;ribo-FECTTMCP转染试剂盒购自中国锐博生物公司;PE anti-DYKDDDDK流式抗体购自美国Biolegend公司。正置荧光显微镜购自日本Olympus公司,流式细胞仪购自美国Becton-Dickinson公司,ELX800酶标仪购自美国BIO-TEK Instrument公司,Image QuantTMLAS 4000数字成像系统购自美国GE Healthcare Life Sciences公司,激光共聚焦显微镜成像系统购自德国Leica Microsystems公司。
1.3 实验方法
1.3.1 细胞培养 人肺腺癌细胞系A549放入含10%BSA的F12K培养基中,置于37℃、5%CO2饱和湿度培养箱中传代培养;人肺鳞癌细胞系H520放入含10%BSA的PRMI 1640培养基中,置于37℃、5%CO2饱和湿度培养箱中传代培养。
1.3.2 stomatin siRNA转染A549、 H520细胞 取对数生长期的A549、H520细胞,分别以2×105/孔接种于6孔板内,培养24 h。待达到40%~60%融合度时,按照riboFECTTMCP转染试剂盒说明书转染细胞。转染stomatin siRNA下文以A549sistom、H520-sistom表示,转染control siRNA下文以A549sinc、H520sinc表示。
1.3.3 蛋白质印迹法(Westernblot)检测stomatin蛋白及Glut 1蛋白表达 提取A549sinc、A549sistom、H520sinc、H520sistom细胞总蛋白,采用二喹啉甲酸(bicinchoninic acid,BCA)法测定蛋白浓度。取等量蛋白质进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离,200 mA恒定电流转移至硝酸纤维素膜上,5%脱脂牛奶4℃封闭过夜。stomatin、Glut1抗体(均1∶1000稀释)和内参β-actin抗体(1∶3000稀释)室温孵育2 h,TBST洗膜,加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗鼠抗体和羊抗兔抗体(1∶3000稀释),室温孵育1 h。采用化学发光法显色并曝光。实验重复3次,取平均值。
1.3.4 RNA的提取和实时荧光定量聚合酶链反应法检测stomatin及Glut 1基因表达情况 以Trizol法提取 A549sinc、A549sistom、H520sinc、H520sistom细胞的总RNA,提取方法参见说明书。采用实时荧光定量聚合酶链反应法(quantitative real time polymerase chain reaction,qRT-PCR)检测 stomatin、Glut1基因表达情况,反应条件参见SYBR Premix Ex TaqTMⅡ说明书,其中扩增温度分别为57℃和63℃,选取 β-actin 为内参基因,采用 2-△△Ct方法计算。stomatin基因的正向引物序列为5'-CACACACGGGACTCCGAAG-3',反向引物序列为5'-ATGAGAACGCCACCAAAATCC-3';Glut1基因的正向引物序列为5'-GGCCAAGAGTGTGCTAAAGAA-3',反向引物序列为5'-ACGCGTTGATGCCAGACAG-3'。实验重复3次,取平均值。
1.3.5 细胞免疫荧光染色 取stomatin siRNA转染24 h后的A549、H520细胞,以1×105/孔加入至24孔板中进行细胞爬片,3%甲醛和2%蔗糖溶液固定15 min,0.1 mmol/L甘氨酸室温孵育5 min,1%BSA室温封闭2 h以上。加入stomatin与Glut1混合抗体稀释液,室温孵育3 h,PBS洗涤,加入二抗稀释液,室温避光孵育 1 h,PBS洗涤,4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)染核,封片。实验重复3次,取平均值。
1.3.6 慢病毒感染A549、H520细胞构建过表达stomatin基因细胞系 以1.5×105/孔将细胞接种于24孔板,使用相应培养基培养过夜。感染前使用完全培养基1∶25稀释病毒感染试剂HitransG P,并替代旧培养基。24孔板每孔500 μl。根据细胞感染复数(multiplicity of infection,MOI)值加入相应病毒使用量,MOIA549=10,MOIH520=50。
1.3.7 3×flag-Glut 1-PcDNA 3.1(-)质粒的构建及转染 A549、 H520细胞在Glut1的第一个细胞外段序列中插入3个连续的flag标签。选取PcDNA3.1(-)作为载体,利用酶切、连接技术将含有flag标签的Glut1序列插入其中,构建完成3×flag-Glut1-PcDNA3.1(-)质粒。取对数生长期的过表达stomatin的A549、H520细胞,分别以2×105/孔接种于6孔板内,培养24 h。待达到60%~80%融合度时,按照LipofectamineTM2000转染试剂盒说明书转染细胞。实验组转染 3×flag-Glut1-PcDNA3.1(-)质粒,对照组转染 PcDNA3.1(-)质粒。
1.3.8 流式细胞术检测Glut 1细胞内定位情况将完成 3×flag-Glut1-PcDNA3.1(-)转染的 A549、H520细胞制成单细胞悬液,加入PE anti-DYKDDDDK抗体4℃孵育30 min,PBS洗涤,上机检测。实验重复3次,取平均值。
1.4 统计学方法
采用SPSS 20.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验,以P﹤0.05为差异有统计学意义。
2 结果
2.1 肺癌细胞 A549、H520中敲降stomatin表达对Glut 1表达的影响
利用siRNA敲降A549、H520细胞中的stomatin基因,qRT-PCR结果显示,与A549sinc相比,stomatin敲降后的A549细胞中stomatin的mRNA表达量变化为(0.14±0.11)倍,差异有统计学意义(t=13.860,P﹤0.01);Glut1的 mRNA 表达量变化为(0.93±0.33)倍,差异无统计学意义(t=0.371,P﹥0.05)。与H520sinc相比,stomatin敲降后的H520细胞中stomatin的mRNA表达量变化为(0.07±0.03)倍,差异有统计学意义(t=46.500,P﹤0.01);Glut1的mRNA表达量变化为(0.92±0.34)倍,差异无统计学意义(t=0.386,P﹥0.05)。Western blot结果显示,敲降stomatin后,A549及H520细胞中stomatin的蛋白表达量降低,而Glut1的蛋白表达量不变(图1)。
2.2 肺癌细胞 A549、H520中敲降stomatin表达对Glut 1蛋白表达位置的影响
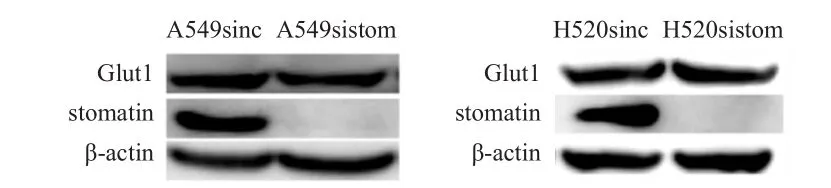
图1 Western blot法检测转染后 A549、 H520细胞中stomatin蛋白及Glut 1蛋白的表达情况
stomatin siRNA 转染 A549、H520细胞后,对A549、H520两种细胞的对照组和实验组的stomatin、Glut1蛋白和细胞核进行细胞免疫荧光染色,结果显示,stomatin与Glut1存在紧密的共定位情况。与A549sinc相比,A549sistom中Glut1蛋白的主要表达位置由细胞膜转移至细胞质内;H520细胞中stomatin与Glut1蛋白的表达虽未及A549细胞明显,但呈现一致的Glut1转位现象。(图2)
2.3 肺癌细胞 A549、H520中stomatin的过表达对Glut 1蛋白表达位置的影响
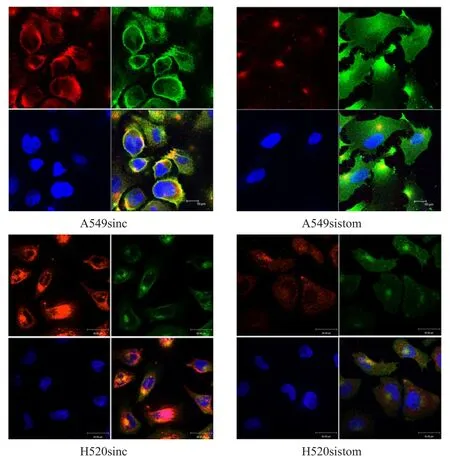
图2 细胞免疫荧光染色显示肺癌细胞 A549、 H520中敲降stomatine表达对Glut 1蛋白表达位置的影响(×630)
为了检测Glut1在细胞膜上表达的变化,本研究在Glut1蛋白的第一个细胞外环上插入flag标签,构建 3×flag-Glut1-PcDNA3.1(-)质粒。向过表达stomatin的A549、H520细胞中导入3×flag-Glut1-PcDNA3.1(-)质粒,流式抗体识别flag标签检测Glut1蛋白在细胞膜的表达情况。stomatin过表达的A549细胞中3×flag-Glut1在细胞膜的表达率为(1.30±0.13)%,明显高于对照组A549细胞的(0.53±0.23)%,差异有统计学意义(t=7.690,P﹤0.01);stomatin过表达的H520细胞中3×flag-Glut1在细胞膜的表达率为(24.07±0.83)%,明显高于对照组H520细胞的(20.17±0.93)%,差异有统计学意义(t=5.414,P﹤0.01)。
3 讨论
Glut1是Glut家族的首要成员,已被证明是恶性肿瘤细胞中葡萄糖转运的关键限速因子,并在不同类型的人类肿瘤中过度表达。大量的研究表明,Glut1参与了肿瘤细胞的生长和转移。此外,Glut1的过度表达与血管浸润、微血管密度和肿瘤浸润深度有关[11]。
作为肿瘤细胞摄取葡萄糖的关键载体,Glut1主要分布在细胞膜,在细胞质内也存在富含Glut1的囊泡,但只有细胞膜表面的Glut1增多时,细胞对葡萄糖的摄取量才能增加。早在1995年,科学家就发现白细胞介素-3(interleukin-3,IL-3)和激酶的激活通过促进Glut1向细胞表面的易位来刺激葡萄糖转运[12]。由生长因子或致癌基因调控的Glut1转位可能在抑制造血细胞的细胞凋亡中起重要作用。而后的研究表明,IL-3能够使磷脂酰肌醇-3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)活化进而激活蛋白激酶B(protein kinase B,PKB,又称AKT),通过RAB11A依赖的细胞内蛋白循环使得Glut1能够在细胞膜上表达[5]。不只是PI3K/PKB信号通路对Glut1转位进行调控,TP53的相关通路也起到了一定作用。肿瘤相关突变的p53可以激活Warburg效应。这种激活Warburg效应的机制为通过激活Ras同源基因家族成员A(Ras homolog gene family member A,RhoA)和其下游效应器Rho激酶(Rho-associated coiled-coil-forming kinase,ROCK),促进Glut1转位到细胞膜上。在饥饿和压力环境下,肿瘤细胞会启动自噬反应,通过增加细胞表面Glut1的表达促进葡萄糖的摄取和糖酵解的流向[13]。有报道指出,在代谢压力下,表达微管相关蛋白轻链3阳性(light chain 3,LC3)的自噬泡与Retromer复合体结合从而隔断自噬泡与TBC1域家族成员 5(TBC1 domain family member 5,TBC1D5)的结合,将其招募到内含体膜上形成Glut1的转位。因此在代谢压力引起的自噬中,TBC1D5能够关闭Retromer依赖的Glut1转位,以保证Glut1在细胞膜上的表达,维持葡萄糖的摄取[14]。虽然目前科学家们对Glut1的转位调控进行了一些信号通路相关研究,但是具体的调控机制还有待研究。
本研究对非小细胞肺癌细胞A549、H520中stomatin与Glut1之间的调控关系进行了探究。首先通过RNA干扰技术降低stomatin的表达,发现在A549、H520细胞中stomatin表达的降低并不影响Glut1的表达。Kumar等[15]检测了在正常的3T3-L1脂肪细胞中,Glut1在Triton X-100可溶性和不溶性部分中的分布,几乎90%的细胞膜池中的stomatin都是耐洗涤剂的脂筏,该研究结果显示在正常的3T3-L1脂肪细胞中,无法在免疫共沉淀实验中证明Glut1和stomatin之间的相互作用。然而,在过表达stomatin的细胞中,stomatin与Glut1抗体明显共沉淀。故猜测stomatin能够在非小细胞肺癌细胞中起到Glut1转位的关键作用。本研究在Glut1的第一个细胞外跨膜区插入flag标签,通过识别flag标签,利用流式细胞术检测Glut1在细胞膜上的表达情况,研究结果发现在stomatin过表达的A549、H520细胞中,Glut1在细胞膜中的表达量升高。而利用细胞免疫荧光染色技术发现stomatin表达量降低时,Glut1的表达从细胞膜上转移到了细胞质中。根据这些结果,猜测stomatin是通过影响Glut1表达位置的变化影响Glut1的功能。
