新型吡咯并嘧啶衍生物N67对3T3-L1细胞的抑制作用及机制初探
2019-04-15易晓红李汶峰钟占琼贺玉萍谢璐霜陈继兰龚圆渊
易晓红,李汶峰,钟占琼,贺玉萍,谢璐霜,陈继兰,李 敏,龚圆渊,杨 岚
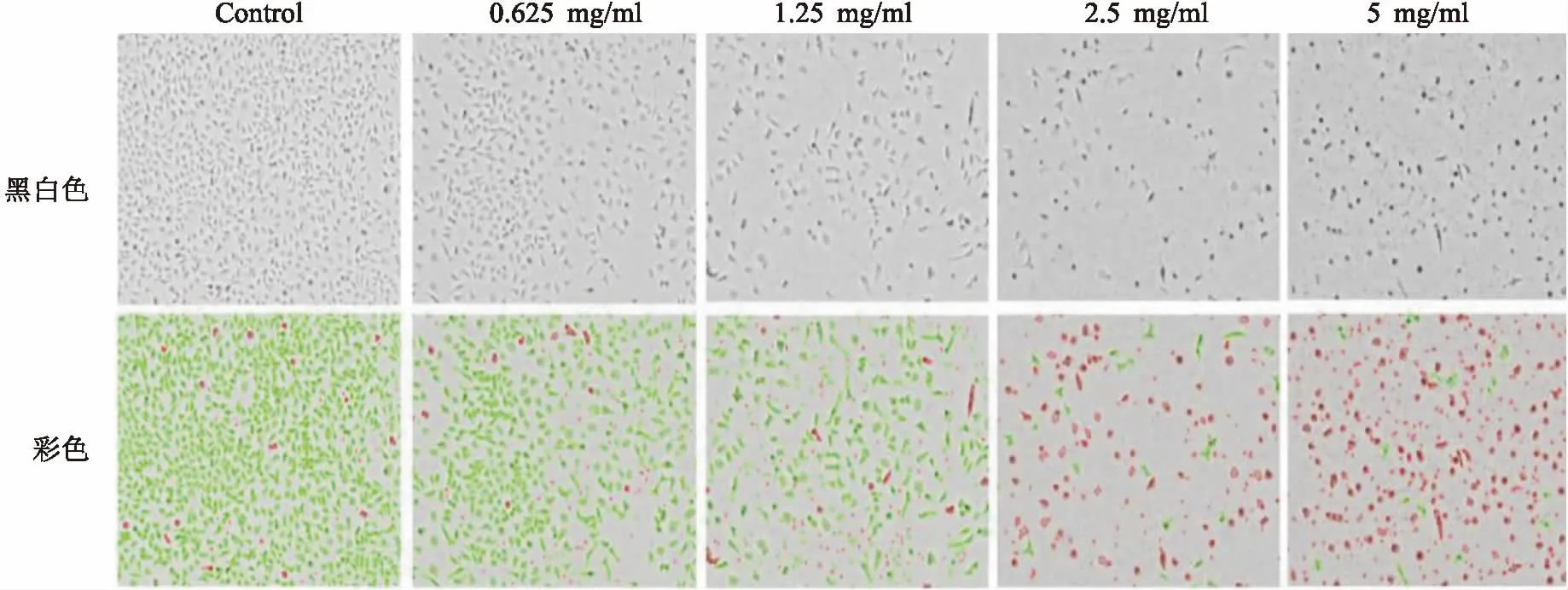
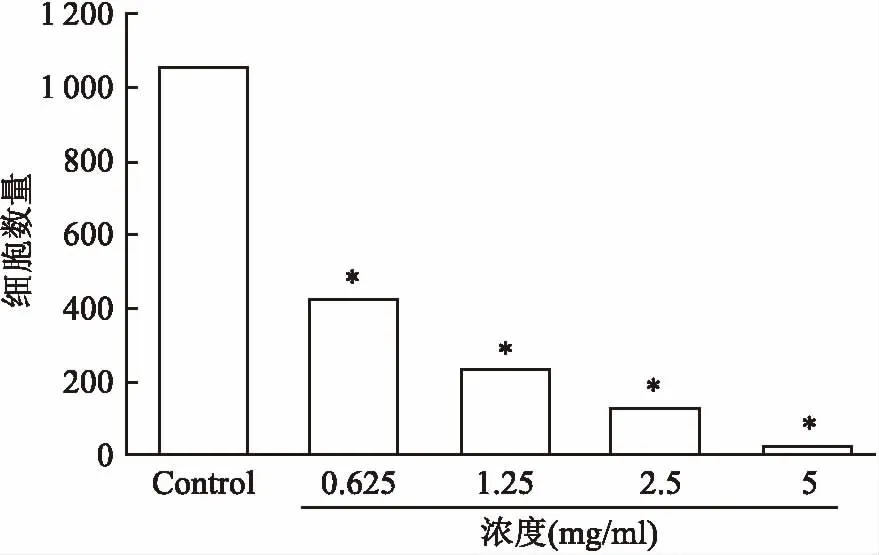
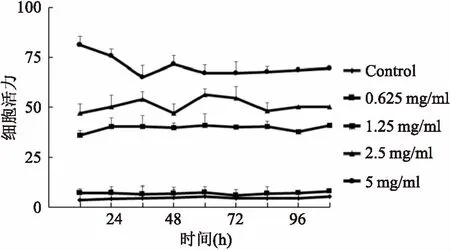
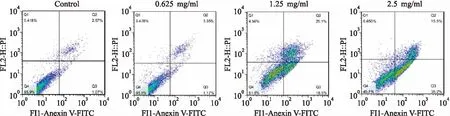
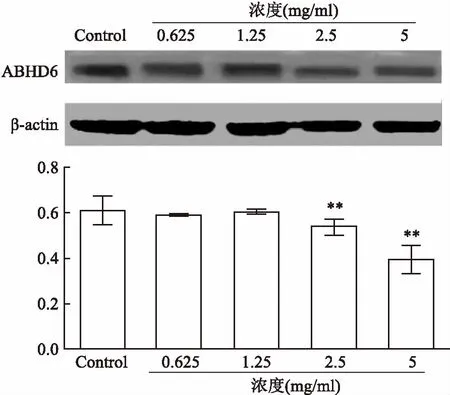
非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)是指患者在无过量饮酒史的条件下,以肝细胞内脂肪过度沉积并超过5%~10%的肝重量为主要特征的临床病理综合征。如不及时治疗,可演变为脂肪性肝炎、肝硬化、肝纤维化、甚至发展成肝细胞癌[1]。全球流行病学调查表明,我国非酒精性脂肪肝的发病率约为15%[2]。而上海地区的患病率更是高达17.29%[3]。NAFLD不仅给患者带来沉重的疾病痛苦和经济压力,而且为国家带来沉重的经济负担和人才损失。目前,尚无推荐用于NAFLD常规治疗的药物,只能通过改变不良生活方式[4],或服用胰岛素增敏剂、减肥药、调脂药、血管紧张素受体拮抗剂、抗氧化剂等防治糖代谢紊乱,间接改善NAFLD病情[5]。因而,针对NAFLD新靶点创新药物的研究具有重要意义。研究[6-7]表明,ab-水解酶域包含蛋白6(alpha/beta-Hydrolase domain containing 6,ABHD6)在NAFLD的发生发展过程中扮演着重要角色,是脂肪代谢的关键酶之一。研究[8-9]显示在NAFLD患者中,ABHD6的表达很高,ABHD6可以水解几个脂质底物,在甘油磷脂代谢和脂质信号转导的过程中起到重要作用。ABHD6抑制剂报道目前较少,2015年,Abide et al发现了吡咯类和唑酮类的小分子ABHD6抑制剂[9-12]。本课题前期研究工作中基于和这类化合物结构相似的38个活性已知的ABHD6小分子抑制剂(0.04 μmol/L 图1 N67结构式(分子量:483.16) 1.1细胞与试剂Swiss小鼠3T3-L1前脂肪细胞来自美国ATCC细胞库;磷酸盐缓冲溶液(PBS)、胎牛血清(FBS)、十二烷基磺酸钠 (SDS)、三羟甲基氨基甲烷(Tris)和MTT、多聚甲醛(成都科龙试剂公司);DMEM培养基、辅酶I(NADH)碘化丙啶(PI)、四甲基偶氮唑蓝(MTT)和丙酮酸钠(美国Sigma 公司);胰蛋白酶 - EDTA溶液(0.25%,EDTA 0.52 mmol/L)、青霉素-链霉素溶液、兔单抗 β-actin(sc-4778)、兔多抗 ABHD6 Polyclonal Antibody(美国Millipore 公司);Annexin V-EGFP/PI双染细胞凋亡检测试剂盒(江苏凯基生物技术股份有限公司);显影化学发光剂ECL,BCA蛋白定量试剂盒(上海碧云天生物技术研究所)。 1.2仪器与设备BIO-RAD680 酶标仪、Powerpas Basic蛋白电泳仪器(美国伯乐公司);流式细胞仪(美国贝克曼库尔特公司);;倒置显微镜(日本Olympus公司)。 1.3方法 1.3.1细胞培养 Swiss小鼠3T3-L1前脂肪细胞在DMEM 培养液(含有10%胎牛血清、100 U/L青霉素、100 μg/ml链霉素)中(以下简称 DMEM10),于37 ℃、5% CO2孵箱环境下常规培养。当细胞生长至大部分融合时,用胰蛋白酶-EDTA溶液进行细胞传代。 1.3.2细胞毒性试验 取96孔培养板,每孔加入浓度为5×104个细胞/ml的100 μl的3T3-L1前脂肪细胞悬液,然后放入 37 ℃、5% CO2孵箱中进行培养。24 h后弃去培养液,每孔加入100 μl含有不同浓度的N65溶液,用不含样品的DMEM10作为空白对照,孵箱孵育72 h。弃去培养液,加入0.5 mg/ml MTT的 DMEM10孵育4 h,再加入100 μl的0.1 g/ml的SDS溶液过夜。酶标仪在 570 nm处测定吸光度值。重复3次。以药物浓度为横坐标,细胞存活率为纵坐标进行直线回归并求出IC50。 1.3.3细胞形态观察 用 90 mm 直径培养3T3-L1前脂肪细胞。贴壁培养24 h后弃去培养液,向皿中加入5 ml含有相应IC50的N67营养液,用不含有样品的DMEM10为空白对照。孵育72 h后弃去培养液,用5 ml PBS溶液轻柔清洗细胞层,重复1次。于超净台上放置至干燥,于显微镜下放大200倍观察凋亡的细胞形态。实验重复3次。 1.3.4Annexin-FITC/PI双染法流式细胞术测细胞凋亡 取24孔培养板,每孔加入浓度为5×104个细胞/ml的3T3-L1细胞悬液1 ml,于37 ℃、5% CO2孵箱中培养。24 h后弃去培养液,每孔加入1 ml不同浓度的N65的培养液孵育,以不含样品的DMEM 为空白对照,于48 h弃去培养液,PBS溶液清洗细胞层,洗液收集至离心管中。每孔加入500 μl胰蛋白酶-EDTA消化液,将细胞消化后其悬液打匀后加入离心管中。用4 ℃预冷的70%冷乙醇固定,4 ℃保存。调整细胞浓度为106细胞/ml,取1 ml细胞悬液,用PBS洗3次,细胞重悬于1 ml染液中,37 ℃孵育30 min即可进行流式分析。实验重复3次。 于贝特曼库尔特流式细胞仪检测细胞凋亡,用贝特曼库尔特软件处理数据。 1.3.5Western blot实验 预冷RIPA蛋白抽提试剂,加入蛋白酶抑制剂。细胞计数,以细胞数量1×107加入1 ml裂解液,用枪头吹打充分悬起细胞,完成后在冰上孵育20 min,4 ℃离心,离心完成后取上清,分装保存,待测。BCA试剂测定蛋白浓度,根据目的蛋白的分子量,配制12%分离胶,5%分离胶。待检测蛋白样品上样15 μg。浓缩胶恒压90V,约20 min,溴酚蓝进行分离胶界面;分离胶恒压160V,电泳至溴酚蓝到凝胶底部。湿转法转膜,将胶完全浸没封闭液中室温轻摇60 min。用TBST稀释一抗,室温孵育10 min,放4 ℃过夜。第2天从冰箱拿出膜,在室温孵育30 min。洗膜:TBST洗膜3次,每次10 min。二抗孵育,显影,曝光。实验重复3次。 1.4统计学处理采用SPSS 16.0软件进行数据分析,组间比较选用χ2或Fisher确切概率法,以P<0.05为差异有统计学意义。 2.1N67作用于3T3-L1细胞的细胞形态观察分别将0.625、1.25、2.5、5 mg/ml N67处理的 3T3-L1 前脂肪细胞固定,并设对照组,24 h后利用显微镜观察细胞形态。如图 2 所示,第一行的图片示显微镜下各组细胞的图像,为方便观察和计数,第二行在第一行的图片上用绿色标记活细胞,列入计数范围,红色标记为非活细胞。对照组的细胞生长状况良好,结构完整,形态正常,细胞核居中。而处理组的细胞相对分散,细胞数量随着N67浓度升高而减少,细胞失去纤维状形态,细胞具有典型的凋亡形态特征:体积缩小、细胞核固缩、核染色质边集聚,甚至核碎裂。计数每个实验组5个视野的细胞数进行统计分析,实验组与control组差异均有统计学意义(P<0.05),见图3。 2.2N67对3T3-L1前脂肪细胞生长抑制作用由图4可知,N67对 3T3-L1 前脂肪细胞有明显生长抑制作用。随着N67浓度的升高(0.6~5)mg/ml,细胞的存活率下降,剂量效应关系明显。从图4可以看出,N67的浓度从0.6 mg/ml到5 mg/ml,细胞存活率从约75% 降至 10%。以细胞存活率与N67的浓度进行直线回归并求出 IC50。经计算,N67对 3T3-L1 前脂肪细胞的 IC50为 (0.66±10)mg/ml。 2.3N67诱导3T3-L1细胞的凋亡3T3-L1前脂肪细胞经不同浓度的N67处理,24 h后分别在流式细胞仪上测定细胞凋亡的变化。用贝特曼库尔特软件进行细胞周期分析。图5中四个象限Q1区域的细胞为坏死细胞。也可能有少数的晚期凋亡细胞在其中。Q2区域的细胞为晚期凋亡细胞。Q3区域的细胞为早期凋亡细胞。Q4区域的细胞为活细胞。从图5可看出 3T3-L1前脂肪细胞随N67浓度早期凋亡细胞明显增多,0.625 mg/ml浓度到2.5 mg/ml浓度凋亡细胞比例从1.17%上升至38.2%,说明N67对 3T3-L1前脂肪细胞有诱导凋亡的作用。 图2 不同浓度N67对3T3-L1细胞形态的影响 图3 不同浓度 N67对3T3-L1细胞作用后的形态计数 图4 N67对3T3-L1细胞生长抑制作用的剂量效应关系 图5 N67诱导3T3-L1细胞凋亡 2.4Westernblot实验结果分析如图6所示,已知ABHD6的分子量为38.3 ku,结果显示在此范围出现目的条带,并且随着浓度的升高,蛋白表达降低,实验组与control组差异均有意义(P<0.05,P<0.01)。说明药物对3T3-L1前脂肪细胞有抑制作用,并且靶点为ABHD6。 图6 N67抑制ABHD6的表达并具备浓度依赖性 Swiss小鼠前脂肪细胞3T3-L1是来源于小鼠的前脂肪细胞的细胞株,具有接触性抑制生长特征且可向脂肪样细胞分化特性,是国际上公认的研究脂肪细胞分化的细胞模型。ABHD6是由337个氨基酸组成的蛋白质,相对分子量为38.3 ku。ABHD6基因属于α/β水解酶超家族,这一家族也是目前所知最大的蛋白超家族之一,它们具有相似的高级结构,即共有一个α/β水解酶折叠结构[6]。此前的一些研究[13-15]表明,ABHD6可以水解单酰甘油,从而调节脂类代谢和胰岛素的分泌,因此在治疗非酒精性脂肪肝以及糖尿病的过程中,它们起着重要的作用。 Discovery Studio是一个面向生命科学领域的新一代分子建模和模拟环境的软件,它的Catalyst Hypothesis模块可对一组化合物进行基于特性结构的比对,并且自动生成药效团模型。若能提供具体的活性数据,则可产生3D-QSAR药效团并预测新化合物的活性,节约大量的实验时间和成本。所以此款软件在药物筛选和模拟有效活性团模型构件上被广泛应用,在疾病治疗的创新药物研发上取得了很好的效果。结构和N67类似的化合物已经有相应的报道,笔者在之前的研究基础上进一步用该药效团模型对10 000个化合物的数据库进行虚拟筛选,得到一个活性较好的化合物,命名为N67。 本实验证明新型小分子化合物N67对Swiss小鼠前脂肪细胞3T3-L1具有明显的生长抑制作用,且呈剂量依赖效应,IC50为(0.66±10)mg/ml。对其生长抑制机制进行研究发现,N67可通过调节其表达来发挥作用,诱导3T3-L1前脂肪细胞凋亡。其机制可能是通过作用于ABHD6靶点。由于细胞凋亡过程中多条通路在发挥作用而且交叉。相同的药物作用不同的细胞系所启动的信号通路可能不同,不同的药物作用于同一个细胞系启动的也不同,本实验只是初步发掘N67对ABHD6的作用机制,具体的凋亡机制研究具有进一步研究的潜在价值。同时实验亦说明ABHD6是治疗非酒精性脂肪肝的潜在靶点之一,对非酒精性脂肪肝的治疗研究有一定临床意义,值得进一步研究。此外值得肯定的是,实验选择的化合物研究表明,利用Discovery Studio软件的Catalyst Hypothesis 模块来构建药效团模型具有可操作性和临床应用的可能性。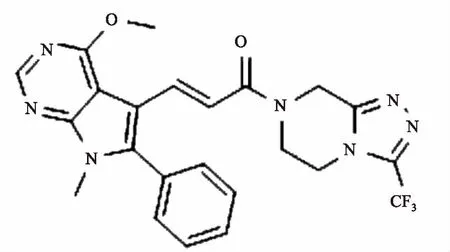
1 材料与方法
2 结果
3 讨论
