基于RNA-seq分析人肝癌耐药细胞BEL-7402/FU的差异表达基因
2019-04-15周谢海崔志华许杜娟
周谢海,张 婷,谢 刚,崔志华,许杜娟,,3,夏 泉
原发性肝癌主要是肝细胞癌 (hepatocellular carcinoma, HCC),简称肝癌,是常见的恶性肿瘤之一,临床发病率和死亡率均较高。化疗是中晚期肝癌重要的治疗手段,然而,患者往往因为多药耐药的产生而导致化疗失败。肝癌耐药是一个多进程多种因素相互作用的结果,其中包括多药耐药蛋白的高表达[1],凋亡抑制途径异常[2],以及细胞内在信号通路的调节[3]等。但迄今为止仍尚未完全阐明肝癌耐药的机制。RNA-seq,即对经RNA反转录以及PCR扩增得到的cDNA进行高通量测序分析,具有数据量大、定量准确、可重复性高、分析可靠等特点[4],近些年来已广泛运用于生命科学领域。该研究基于RNA-seq技术,筛选出肝癌耐药细胞与亲本细胞的差异表达基因(differentially expressed genes, DEGs),以期探讨与肝癌耐药相关的基因及信号传导通路。
1 材料与方法
1.1材料人肝癌细胞株BEL-7402购自中科院上海细胞库,人肝癌耐药细胞株BEL-7402/FU购自南京凯基生物有限公司,由本实验室液氮冻存保种;5-氟尿嘧啶(5-FU)购自美国Sigma公司(货号:V900394);TRIzol Reagent 购自美国 Invitrogen公司。
1.2方法
1.2.1细胞培养 使用含10% 胎牛血清、双抗(青霉素100 IU/ml、链霉素100 mg/L)的RPMI-1640培养基进行培养。置于 37 ℃、5% CO2培养箱中贴壁培养,细胞在对数生长期时用胰酶消化传代。肝癌耐药细胞株BEL-7402/FU每48 h使用含有20 mg/L 5-FU的培养基刺激,以维持细胞的耐药性。为了避免5-FU的影响,在样本处理前将BEL-7402/FU细胞在正常培养基中培养48 h后再进行取样。
1.2.2Total RNA提取与鉴定 使用TRIzol试剂分别提取两组细胞的总RNA,每组细胞重复3个生物学样品,使用Agilent 2100 Bioanalyzer 检测总RNA的浓度、RIN值、28S/18S和片断大小。
1.2.3转录组测序及DEGs筛选 将提取的 RNA 样品送至华大基因进行转录组文库构建,并通过BGISEQ-500平台进行测序。运用DEseq2 和 PossionDis 算法进行DEGs检测,DEseq2方法根据差异倍数在两倍及以上且校正后的P值≤0.05来筛选DEGs。PossionDis 方法计算得到差异基因后,对差异检验的P值作多重假设检验校正,并通过控制错误发现率(false discovery rate, FDR)决定P值的域值。本研究中,DEGs默认定义为FDR≤0.001且倍数差异在2倍以上的基因。
1.2.4DEGs分析 根据GO富集、KEGG注释结果以及官方分类,将DEGs进行功能分类、生物通路等分类,同时使用R软件中的Phyper函数进行富集分析。使用DIAMOND软件将DEGs比对至STRING数据库,利用与已知蛋白的同源性获得DEGs编码蛋白间的互作关系,即蛋白互作网络(protein protein interaction network,PPI)分析。取得分最高的前1 000个关系画示例图。
1.3统计学处理本项目使用R软件里的Cor函数对每两个样品之间进行Pearson相关性分析,P<0.05为差异有统计学意义。样品基因表达量服从泊松分布,本项目P值采用Wald test方法计算并通过多重假设检验校正得出,P<0.05为差异具有统计学意义。
2 结果
2.1转录组测序结果分析本项目使用BGISEQ-500平台一共测了两组细胞的样品,每组重复3个样品,样品比对基因组的平均比对率为81.25%,比对基因集的平均比对率为69.47%;共检测到基因数为17 738个,其中已知的基因为16 897个,预测的新基因为928 个;共检测出12 995个新转录本,其中11 390个属于已知蛋白编码基因的新的可变剪接亚型,928个属于新的蛋白编码基因的转录本,剩下的677个属于长链非编码RNA。
为了反映样本间基因表达的相关性,本研究计算了每两个样品之间所有基因表达量的Pearson相关系数,并将这些系数以热图的形式反映出来,图中颜色越深代表相关性越高,颜色越浅代表相关性越低,见图1。
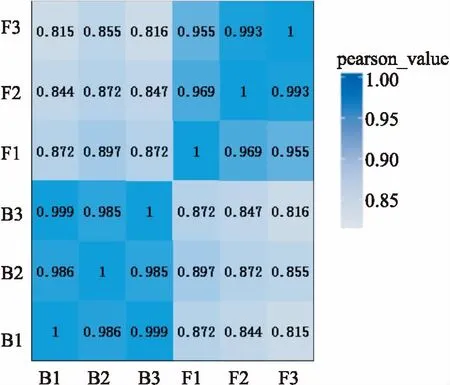
图1 样品间相关性分析热图X、Y轴均代表每个样品;颜色代表相关性系数
2.2DEGs表达水平分析根据各个样品基因表达水平不同,筛选出样品组之间的DEGs。统计结果显示,共筛选出样品组之间的DEGs数为6 212个,其中上调数为2 899个,下调数为3 313个,使用MA plot图展示DEGs的分布,见图2。为了筛选表达差异最为显著的基因,项目对表达量上、下调10倍以上的基因进行分析。结果显示,上、下调10倍以上的DEGs共有83个,其中72个属于已知基因,11个log2FoldChange指经过log2转换后的BEL7402和BEL7402/FU细胞样品组之间的差异表达倍数;NA指检测到的新基因为预测的新基因。本次选择上、下调的前10名分别列表展示,见表1。
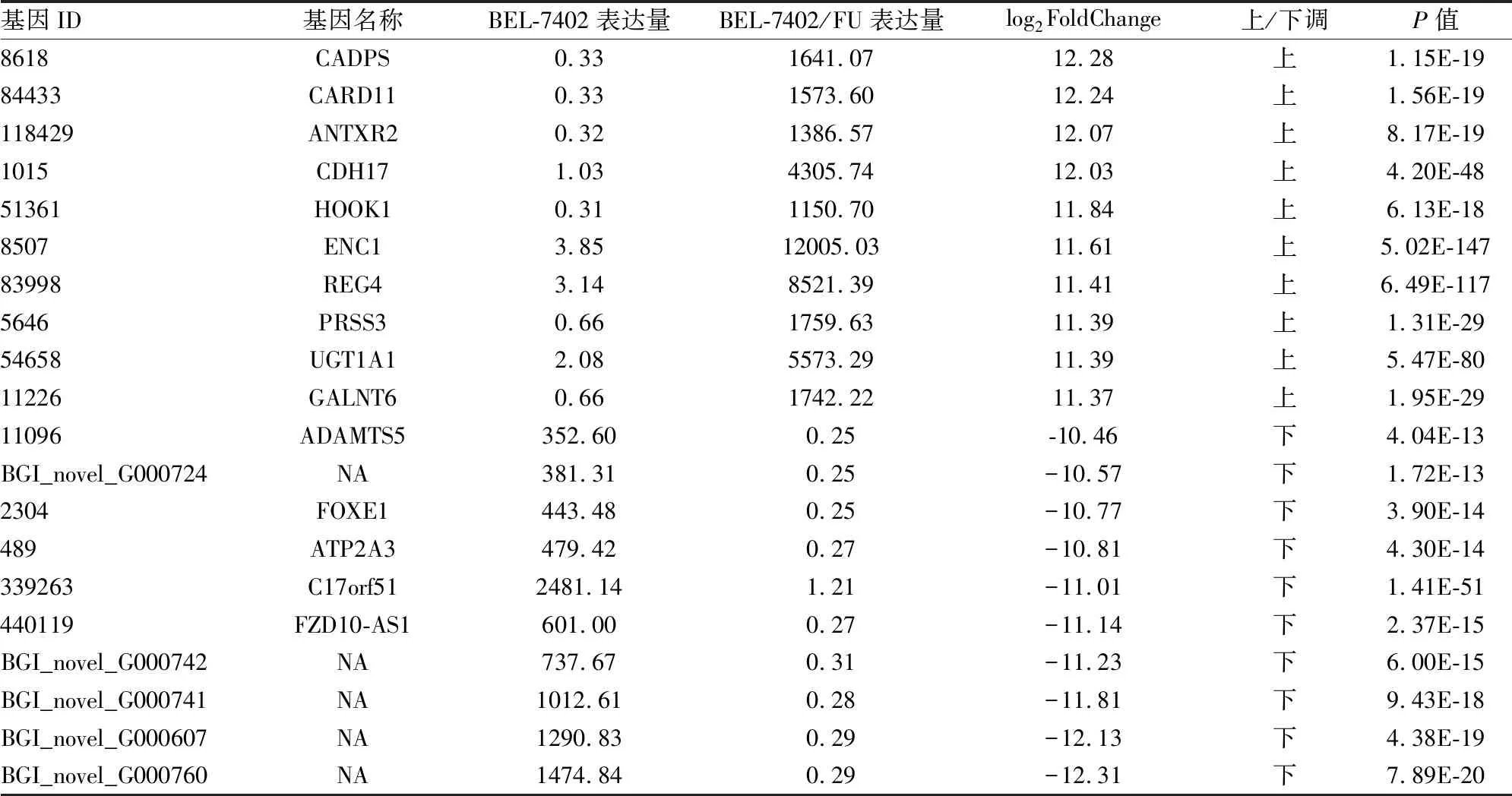
表1 BEL7402和BEL7402/FU细胞的部分DEGs表达
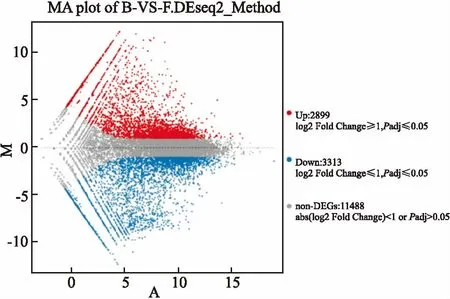
图2 DEGs的MA-plot分布图
2.3DEGs的GO富集分析根据DEGs检测的结果,本项目利用GO富集分析对转录组数据进行功能注释。GO分析结果表明,分别有4 138条注释到生物学进程(biological process, P),有4 743条注释到细胞组分(cellular component, C),有4 465条基因注释到分子功能(molecular function, F)。之后又将其细分为62个小类。在P分类中, 70.5%的DEGs可被富集到单生物体过程类别(single-oranism process)条目中,富集的基因数最多,其次为单生物细胞过程类别(single-oranism cellular process),约占61.3%。在C分类中,分别有约82.5%的DEGs可被富集到细胞类别(cell)和细胞部分类别(cell part)条目,约75.5%的DEGs可富集到细胞内类别条目(intracellular)。在F分类中,结合分子功能类别(binding)条目所占比例最多(84.3%),其次为蛋白结合类别(protein binding)条目,约占42.9%。
2.4DEGs的KEGG生物通路富集分析KEGG 分析表明,共有5 718条DEGs涉及共312个通路(pathways),主要涉及的通路见图3,其中代谢通路 (metabolic pathways) 富集的基因数目最多,约占DEGs总数的10.84%;其次为肿瘤中的蛋白聚糖通路(proteoglycans in cancer)以及人类嗜T细胞病毒感染通路(HTLV-I infection)。
与此同时,通过对上、下调10倍以上的基因进一步进行富集分析发现,筛选出的83条DEGs中,共有57条可被富集到KEGG通路中,其中有11条基因涉及代谢通路,约占19.30%;5条涉及丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路,约占8.77%;其余的主要涉及RNA降解(RNA degradation),磷脂酰肌醇-3-激酶/蛋白激酶B信号通路(PI3K-Akt signaling pathway)等。接下来,对代谢通路中上、下调10倍以上的基因进行汇总,上调的基因有UGT1A1、GALNT6、CDS1、MOCS1、HSD3B1、UGT8、DGKG、B3GALNT1、TFF1,下调的基因为GALNT3、LINC00689。
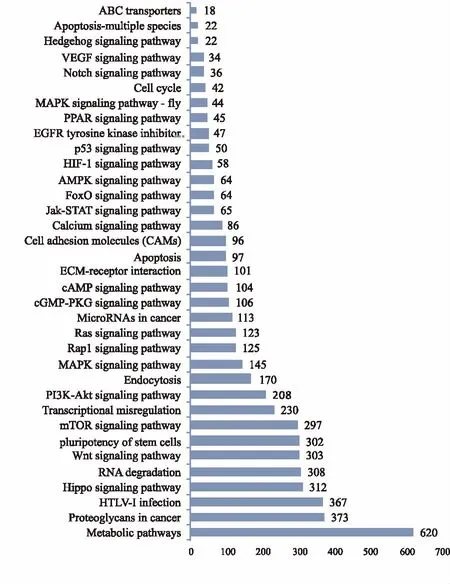
图3 差异表达基因的Pathway显著性富集分析
2.5DEGs编码蛋白质之间的PPI分析蛋白之间通常通过相互作用结合成复合物之后行使相应的功能,具有相互作用的DEGs通常具有相似的功能。根据STRING蛋白互作数据库,对每组DEGs进行PPI分析。采用可信度最高的前1000个互作关系做图,结果见图4。如图所示,与各蛋白联系最密切的为TP53和表皮生长因子受体(epidermal growth factor receptor, EGFR),蛋白质相互作用主要集中在CDKN1A、BCL2、ABALON、BCL2L1、MAPK8、FYN、ESR1、STAT5B及STAT5A等基因之间。以上基因平均涉及到23条信号通路,基因的表达情况见表2。
3 讨论
本项目运用RNA-seq技术,从整体水平研究肝癌亲本细胞BEL-7402与耐药细胞BEL-7402/FU的基因转录水平,筛选出DEGs并通过生物信息学分析寻找与肝癌耐药关系密切的基因和通路。研究显示,BEL-7402和BEL-7402/FU细胞之间存在着多个DEGs的上调和下调,涉及到多种细胞信号通路和生物学过程。
GO富集分析发现,两组细胞在各分类中均富集了大量的DEGs,说明肝癌耐药的过程不是单一因素引发的,而是多条途径相互作用的结果。例如在P分类中,Single-organism process和Single-organism cellular process显著富集,它们是最基础的生命活动类别;在C分类中,Cell占比最多, 说明细胞适应化疗药物的过程是整体的和全局性的;在F分类中,Binding和Protein binding富集最为显著,说明肝癌耐药涉及到细胞中各种蛋白和分子的结合作用。

图4 差异表达基因的蛋白互作关系网络图圈的大小表示关系密集程度,颜色深浅表示基因在网络中的重要程度
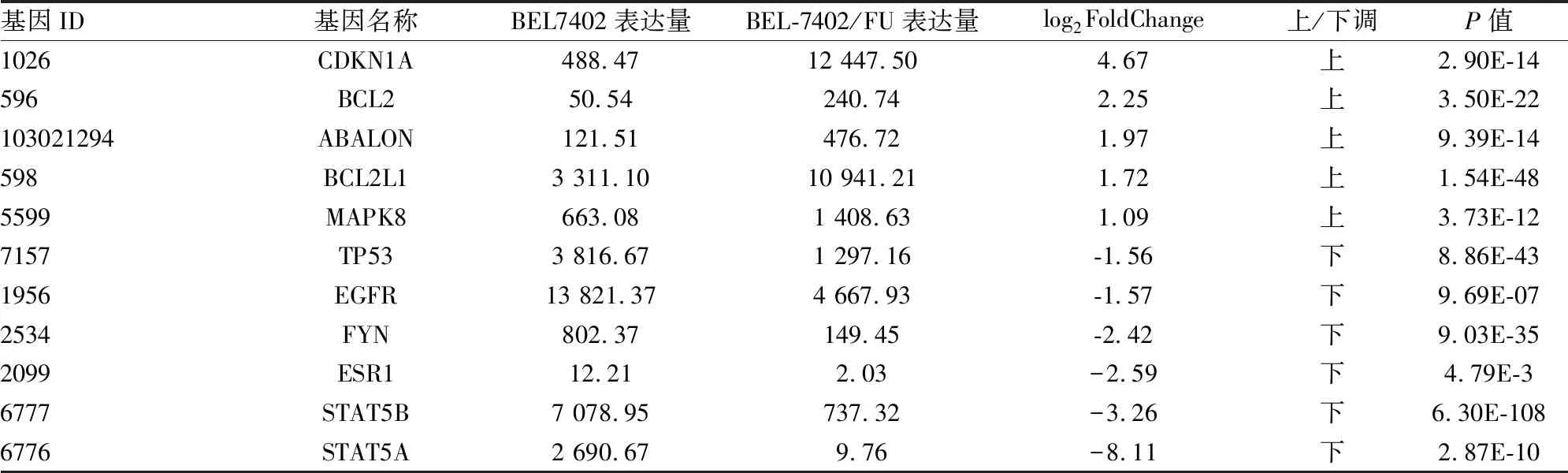
表2 PPI分析中主要DEGs的表达
KEGG分析结果显示,代谢通路富集的基因数目最多,并且在上、下调10倍的DEGs中,富集到代谢通路的基因占比最大,多数基因涉及到肿瘤能量代谢和糖蛋白的合成。肿瘤在适应化疗和放疗带来的损伤时,需要通过适应环境并开启防御机制,其中包括药物的外排、抵抗凋亡、DNA的损伤修复以及信号通路的激活等,这些生物过程都需要足量的能量供给。早在20世纪初,科学家就发现肿瘤细胞具有高水平的糖酵解作用,并通过代谢重组维持细胞内的ATP和NADH水平的正常,以满足细胞生存和大分子合成的需要[5]。本课题组前期研究[6]发现,在肿瘤酸性微环境中,ASIC1a通过调控Ca2+/PI3K/AKT信号通路诱导人肝癌耐药。肿瘤酸性微环境的产生原因之一正是肿瘤缺氧、肿瘤细胞高水平的糖酵解的发生[7],此外,Zhou et al[8]研究也发现,结直肠癌细胞ATP损耗可以提高化疗药物的敏感性。因此,有理由认为肿瘤代谢通路与肝癌耐药关系密切。
在代谢通路中,尿苷二磷酸葡萄糖醛酸转移酶1A1(Uridine diphosphoglucu-ronosyl transferase 1A1, UGTlA1)表达差异显著。UGT1A1是参与胆红素代谢的一种酶,也是伊立替康代谢的关键酶,与结直肠癌耐药有关[9],并且特异性沉默UGT1A1基因可显著提高伊立替康对结直肠癌细胞的化疗敏感性[10],但UGT1A1与肝癌耐药的研究却鲜有报道。肿瘤耐药的机制之一为肿瘤细胞对化疗药物的代谢增强,因此,在BEL-7402/FU细胞中,可能存在由于UGT1A1的过度表达而提高了对5-FU的代谢,从而导致肝癌耐药的产生。本次研究中还发现GALNT6、B3GALNT1、GALNT3参与到O-糖基化过程,与细胞膜上的糖蛋白合成和癌症进展息息相关[11]。以上DEGs可能在肝癌耐药细胞的代谢调节中起到不可或缺的作用,它们均有可能是调控肝癌耐药的潜在基因。
PPI分析显示,蛋白质相互作用主要集中在CDKN1A、BCL2、ABALON等基因之间,与各蛋白联系最密切的为TP53和EGFR基因。以上基因平均可富集到23条信号通路,它们多数参与了细胞周期、凋亡以及增殖等信号通路的调节,在肿瘤耐药的调节中起到了关键作用。TP53是重要的抑癌基因之一,主要通过转录合成细胞周期相关蛋白进而调控细胞增殖和凋亡,TP53的突变与化疗耐药有关[12]。本研究发现TP53表达轻度下调(-1.56倍),但其位点是否存在突变仍需要进一步的检测。EGFR是表皮生长因子受体(HER)家族成员之一,在大部分肝癌患者标本中呈高表达[13],目前认为,EGFR主要通过调控激活RAS/MAPK信号通路诱导原癌基因的表达促进肝癌的发展[14]。本次检测发现EGFR在肝癌亲本细胞中呈现高表达,而在耐药细胞中表达轻度下调(-1.57倍),考虑到EGFR的调节需要磷酸化后发挥功能,因此仅仅只观察受体表达水平并不能代表功能的变化,仍须进一步检验其磷酸化水平。
本项研究共检测了17 738个基因,测序范围广,并且在本次测序中发现了928个属于新的蛋白编码基因的转录本。这些新基因的发现,为以往测序的结果做了补充,在这些基因中有可能存在尚未被发现的引起肝癌耐药的潜在位点。
综上所述,本研究筛选出代谢通路为肝癌耐药最为密切的通路,其中UGT1A1、GALNT6、B3GALNT1和GALNT3在代谢通路中高表达,可能是与肝癌耐药最为密切的基因,而TP53和EGFR等基因可能是蛋白调控网络中最为关键的基因。这些DEGs的筛选为解决肝癌耐药问题提供了新思路,课题组后期将针对DEGs的筛选结果进行验证,以期进一步探讨肝癌耐药的机制。
