墨鱼缠卵腺糖蛋白提取工艺优化及纯化
2019-04-15,,,,,,*,,
,, ,,,,*,,
(1.宁波大学海洋学院,浙江宁波 315211;2.宁波大学科学技术学院,浙江宁波 315211)
墨鱼是软体门,头足纲,十腕目,乌贼科,也叫目鱼、乌贼鱼等,中国的墨鱼大多源自中国东海,有曼氏无针乌贼和金乌贼两个种。墨鱼是我国著名的海产品之一,与大黄鱼、小黄鱼、带鱼统称为“四大经济鱼类”,深受广大消费者喜爱[1]。墨鱼缠卵腺是雌性生殖腺的附属腺,因形似禽蛋,所以又称墨鱼蛋,墨鱼蛋营养丰富,解暑驱寒,具有开胃利水的功效,是我国古代八珍之一[2]。
糖蛋白是由分支的寡糖链与多肽链共价结合形成的一类重要的生物大分子,在生物体中有着至关重要的作用。研究发现细胞识别、免疫保护、代谢调控等都与糖蛋白中的糖链有关[3-4]。近年来,国内外研究人员对糖蛋白的研究越来越重视,根据糖蛋白的溶解性不同,研究人员通过水提法、盐提法、酸碱提法及有机溶剂等方法提取生物体中的糖蛋白。包郁明等[5]通过丙酮脱脂、NaCl溶液超声浸提、硫酸铵分级沉淀、透析,柱层析等从鲍鱼脏器中提取了一种糖蛋白,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳发现,该糖蛋白纯度达到电泳纯,分子质量为73.7 kDa。王倩等[6]采用NaOH溶液在鱿鱼缠卵腺中提取了糖蛋白,经响应面优化工艺,得出鱿鱼缠卵腺糖蛋白的最佳提取工艺为提取时间3.44 h,提取温度25 ℃,NaOH浓度为0.37 mol/L,在此工艺条件下糖蛋白提取率为12.79%。随着海洋生物的深入研究,关于海洋生物中糖蛋白的研究,也逐渐成为国内外研究的热门。目前已有从海蜇[7]、海兔[8]、河蚬[9]、鱿鱼[10]、章鱼[11]等海洋生物中提取了糖蛋白,发现其具有显著的抗氧化、抗疲劳、降血脂等功效。目前尚未有发现墨鱼蛋糖蛋白的研究。
糖蛋白的纯化是指去除粗糖蛋白中的小分子蛋白、糖等杂质,主要参考蛋白和多糖的纯化方法,目前国内外较常用的分离方法有色谱法[12-13]、膜分离法[14]、电泳法[15]。Wang等[16]采用DEAE-52 celloulus阴离子交换柱层析结合凝胶柱层析、电泳法,对大蒜中的糖蛋白进行提纯、鉴定,得到一种纯度达到电泳纯的糖蛋白,为本文的提纯方法提供了一定的设计思路。
本课题参考王倩[17]的提取方法在预实验的基础上,采用碱法提取,选择NaOH浓度、提取时间、提取温度、料液比、超声功率为单因素,对墨鱼缠卵腺糖蛋白提取工艺进行了研究,结合Wang等[16]、Senthilkumar等[18]的方法,运用DEAE-52柱层析、Sephacryl S-300HR柱层析,对糖蛋白粗提物进行纯化,得到纯化后的糖蛋白再进行SDS-PAGE电泳实验,鉴定其纯度,为后续墨鱼缠卵腺糖蛋白的结构及生物活性研究提供基础保障。
1 材料与方法
1.1 材料与仪器
墨鱼缠卵腺 宁波市江北区路林市场,清理后除去外层薄膜置于-20 ℃冰箱保存备用;30%的丙烯酰胺、1.5 mol/L的Tris-HCl、1 mol/L的Tris-HCl、10% SDS、10%过硫酸铵、TEMED试剂、Schiff试剂 Solarbio公司;乙醇、氢氧化钠、浓硫酸、葡萄糖、蒽酮、牛血清蛋白、DEAE-52、考马斯亮蓝R-250、磷酸、PBS(pH7.4)、盐酸、高碘酸、偏重亚硫酸钠、三氯乙酸等 均为分析纯。
GL21MC型冷冻离心机 湖南湘仪实验室仪器开发有限公司;UV-3300型紫外分光光度计 上海美谱达仪器有限公司;DNP-9162型电热恒温培养箱 宁波江南仪器厂;HD-A层析系统(泵、紫外检测器、记录仪、收集器、控制器) 上海沪西分析仪器厂有限公司;DYY-12型电泳仪 北京市六一仪器厂;KYC-100B空气恒温摇床 宁波江南仪器厂;MD44透析袋(截留分子量8000~14000 Da) 北京索莱宝科技有限公司;DY89-Ⅱ型匀浆机 宁波新芝仪器设备有限公司。
1.2 实验方法
1.2.1 工艺流程 取2 g墨鱼缠卵腺,去外层薄膜,洗净加一定量的NaOH溶液8000 r/min匀浆2 min,超声波控温反应一定时间后离心10000 r/min 15 min,取上清,2倍无水乙醇醇沉4 h,放入透析袋中透析48 h,冷冻干燥机中-60 ℃(下同)冻干得粗品。
1.2.2 单因素实验 以粗糖蛋白得率为指标,选定NaOH浓度、提取温度、提取时间、料液比、超声波功率为单因素,设定基本条件为NaOH浓度0.3 mol/L、提取温度25 ℃、提取时间2 h、料液比1∶20 g/mL、超声波功率180 W,改变其中一个条件,其它条件保持不变,分别考察NaOH浓度(0.1、0.3、0.5、0.8、1.2 mol/L)、提取温度(4、15、25、35、45 ℃)、提取时间(0.5、1、2、3、4、5 h)、料液比(1∶5、1∶10、1∶20、1∶30、1∶40 g/mL)和超声波功率(40、80、120、160、200 W)等因素对墨鱼缠卵腺糖蛋白得率的影响,每项实验设置3个平行,结果取平均值。
1.2.3 响应面优化试验 在单因素实验的基础上,以NaOH浓度、提取温度、提取时间三个因素为因子,粗糖蛋白得率为响应值,设计响应面实验。每组实验进行三次,结果取平均。响应面试验设计因素表见表1。

表1 Box-Benhnken响应面试验设计因素水平表Table 1 Box-Benhnken experimental factor level table
1.2.4 粗糖蛋白得率的测定
得率(%)=(粗糖蛋白冻干质量/干物料质量)×100
1.2.5 糖蛋白纯化
1.2.5.1 DEAE-52阴离子交换柱层析 运用HD-A层析系统将响应面优化条件下制备的粗糖蛋白按1∶50的比例溶解在缓冲液中(pH7.4的PBS),微膜过滤(孔径0.1~1 μm),过DEAE-52阴离子交换柱,用NaCl梯度洗脱(浓度范围0~1 mol/L),洗脱速度为1 mL/min,每隔1 min记录蛋白280 nm下的吸光度值,收集每个蛋白峰的流出液,再用硫酸蒽酮法测糖含量,收集既有糖又有蛋白的峰,冻干得糖蛋白半纯品[19]。
1.2.5.2 Ssphacyl S-300HR柱层析 运用HD-A层析系统将糖蛋白半纯品按1∶50的比例溶解在pH7.4的PBS缓冲液中,0.1~1 μm微膜过滤,再用该缓冲液洗脱,洗脱速度为0.5 mL/min,每隔1 min记录蛋白吸光度值,收集每个蛋白峰流出液,分别检测糖含量,收集既有蛋白又有糖的峰,蒸馏水透析24 h,冻干得糖蛋白纯品[5]。
1.2.5.3 SDS-PAGE电泳 电泳样品预处理:取10 mL浓度为1 g/100 mL的糖蛋白样品,加入2 μL电泳缓冲液。10%分离胶、5%浓缩胶、80 V起始电压,待样品进入分离胶后电压升至100 V,同一块胶进行蛋白质考马斯亮蓝R-250染色,PAS糖染色[19],观察电泳条带。
1.2.6 墨鱼缠卵腺纯化物基本成分含量测定 总糖含量测定:采用硫酸-蒽酮法[20]测定,以葡萄糖标准液的质量浓度为横坐标,以吸光值A为纵坐标作图,线性回归分析得标准曲线为:y=0.0047x-0.0038,R2=0.9997,按照标准曲线计算糖含量,计算公式如下:
式(1)
式(1)中:y-墨鱼缠卵腺中总糖含量,g;m-样品溶液中总糖含量,g;M-干物料质量,g。
蛋白含量测定:采用考马斯亮蓝R-250法[21],以牛血清清蛋白的质量浓度为横坐标,以吸光值A为纵坐标作图,线性回归分析得标准曲线为:y(%)=0.0061x+0.0056,R2=0.9996,按照标准曲线计算蛋白含量,计算公式如下:
式(2)
式(2)中:y-墨鱼缠卵腺中蛋白含量,g;m-样品溶液中蛋白含量,g;M-干物料质量,g。
脂类测定:参照GB/T 14772-2008进行[22];水分测定:采用水分测定仪;灰分测定:采用马弗炉灼烧法[5]。
1.3 数据处理
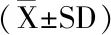
2 结果与分析
2.1 单因素实验条件的确立
2.1.1 NaOH浓度对墨鱼缠卵腺糖蛋白提取工艺的影响 由1图可知,随着NaOH浓度的增大,得率呈现先增后减的趋势,当NaOH浓度达到0.4 mol/L时,糖蛋白得率达到最大值11.22%,NaOH浓度超过0.4 mol/L时蛋白含量,糖蛋白得率明显下降,可能是因为NaOH浓度过高破坏了糖蛋白的结构,导致糖和蛋白的结合断裂,使得得率直线下降[17],因此选择最佳NaOH浓度为0.4 mol/L。
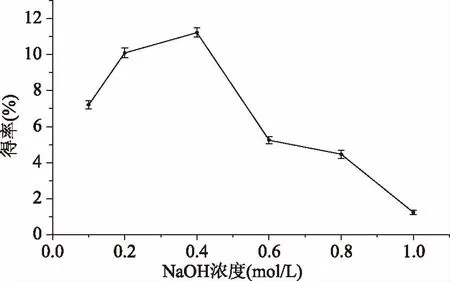
图1 NaOH浓度对墨鱼缠卵腺糖蛋白得率的影响Fig.1 Effects of NaOH concentration on the extraction yield of nidamental gland glycoprotein from cuttlefish
2.1.2 提取温度对墨鱼缠卵腺糖蛋白提取工艺的影响 由2图可知,糖蛋白得率随着温度的升高,呈现先增后减的趋势,在25 ℃时达到最大值10.33%,当温度低于25 ℃时,可能由于在低温条件下糖蛋白在NaOH溶液中的溶出率不高,导致糖蛋白得率低,而温度过高则导致糖蛋白糖链断裂,小分子糖无法在乙醇中沉淀,影响糖蛋白得率[24],因此选择最佳浸提温度为25 ℃。

图2 不同提取温度对墨鱼缠卵腺糖蛋白得率的影响Fig.2 Effects of different temperature on the extraction yield of nidamental gland glycoprotein from cuttlefish
2.1.3 提取时间对墨鱼缠卵腺糖蛋白提取工艺的影响 由3图可知,在浸提时间小于3 h时,糖蛋白得率随时间的延长逐渐增大,在3~4 h之间糖蛋白得率相差不大,达到9%左右,但当浸提时间继续延长,得率开始降低,可能是由于浸提时间过长糖蛋白分解成小分子蛋白和糖[23],在后期纯化过程中被除去,导致得率降低。因此选择浸提时间3或4 h为最佳浸提时间。
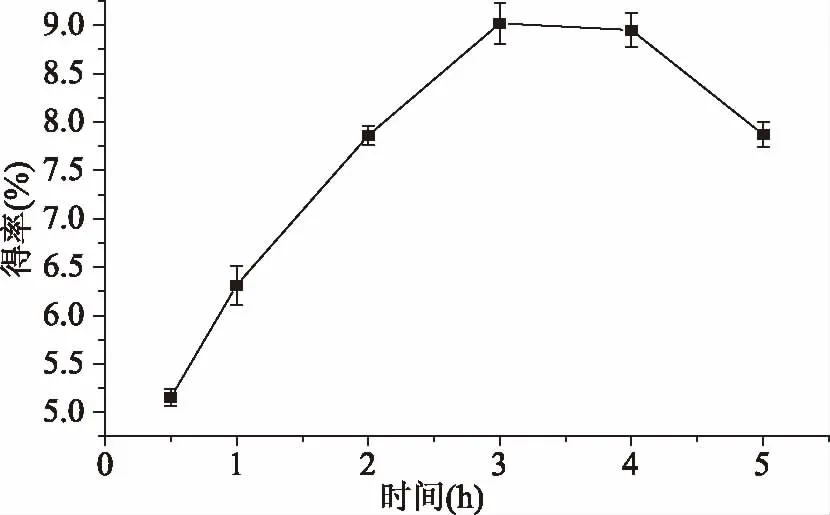
图3 不同提取时间对墨鱼缠卵腺糖蛋白得率的影响Fig.3 Effects of different time on the extraction yield of nidamental gland glycoprotein from cuttlefish
2.1.4 料液比对墨鱼缠卵腺糖蛋白提取工艺的影响 由图4可知,料液比在1∶5 g/mL时,浸提液中NaOH含量相对偏低,使得糖蛋白无法充分富集,导致糖蛋白得率较低,料液比在1∶20 g/mL时,糖蛋白得率达到11.53%,再增加浸提液量,糖蛋白得率无明显变化,并且浸提液过多时,糖蛋白不易收集。综合考虑选择最佳料液比1∶20 g/mL,并不继续对料液比进行响应面优化研究。

图4 不同料液比对墨鱼缠卵腺糖蛋白得率的影响Fig.4 Effects of different solid-liquid ratio on the extraction yield of nidamental gland glycoprotein from cuttlefish
2.1.5 超声功率对墨鱼缠卵腺糖蛋白提取工艺的影响 由图5可知,糖蛋白随着超声功率的增大而增大,超声波促进了糖蛋白在NaOH溶液中的溶解度,使得糖蛋白得率明显增加,因此选择超声功率200 W作为糖蛋白提取的最佳超声功率,且不对其进行响应面优化研究。

图5 不同超声功率对墨鱼缠卵腺糖蛋白得率的影响Fig.5 Effects of different ultrasonic power on the extraction yield of nidamental gland glycoprotein from cuttlefish
2.2 响应面优化墨鱼缠卵腺糖蛋白提取工艺
2.2.1 响应面法试验设计结果及方差分析
2.2.2 回归模型方差分析 响应面试验方案及结果见表2,采用Design-Expert 8.06对试验结果进行多项拟合回归,得到糖蛋白得率Y的回归方程模型:Y=16.06-0.4A+0.37B-0.97C-0.29AB+0.17AC+0.31BC-1.36A2-0.54B2-1.67C2。该回归方程中各项系数的绝对值表示该因素对响应值影响程度的大小,系数的正负则表示该因素对响应值影响的方向[24]。

表2 响应面结果Table 2 Experimental design and results of response surface method

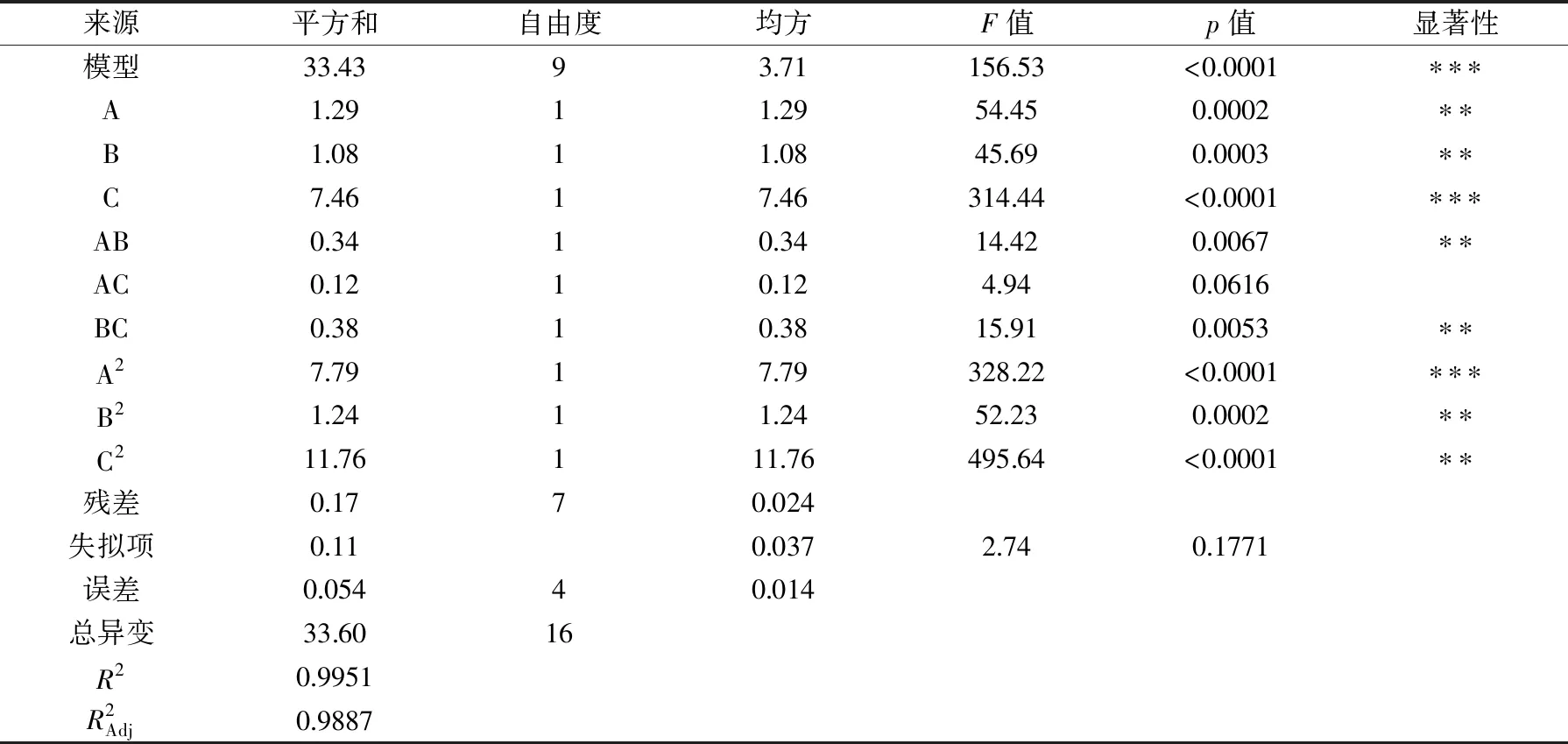
表3 回归模型的方差分析Table 3 Analysis of variance for the fitted quadratic polynomial model
2.2.3 响应面交互作用分析 利用Design-Expert V8.0.6软件分析,得到的3D图可直观反映响应因素,如图6所示。

图6 各因素交互作用响应面图Fig.6 Response surface graph between the various factors interaction effect
由图6可知,提取温度和提取时间,提取时间和NaOH浓度的交互作用呈椭圆形状,曲面陡峭,说明提取温度与提取时间之间交互作用和提取时间与NaOH浓度的交互作用对糖蛋白得率影响较强,而提取温度与NaOH浓度之间的交互作用等高线较疏,表明提取温度与NaOH浓度交互作用对糖蛋白得率的影响较弱[27],这与方差分析中回归模型的显著性检验结果一致,由图6可知,响应面最高点在所选范围内,说明糖蛋白得率存在最大值。
2.2.4 墨鱼缠卵腺糖蛋白最佳提取工艺确定及验证 利用Design Expert 8.06软件对糖蛋白提取工艺进行优化,得到墨鱼缠卵腺糖蛋白的最佳提取工艺参数为提取温度24.01 ℃,提取时间3.66 h,NaOH浓度0.37 mol/L,料液比1∶20 g/mL,超声功率200W,此条件下,墨鱼缠卵腺糖蛋白提取得率预测值为16.2862%,结合现实条件,将实际工艺简化为:温度24 ℃,时间3.6 h,NaOH浓度0.4 mol/L,料液比1∶20 (g/mL),超声功率200 W。在此条件下进行3次验证试验,得出墨鱼缠卵腺糖蛋白实际得率为16.13%±0.16%,与预测值误差仅为0.96%,任艳国等[7]采用缓冲液法在海蜇头中提取糖蛋白得率为9.14%,曾婷婷等[9]采用超声辅助盐溶液法提取河蚬中的糖蛋白,得率仅为0.4466%,说明碱法提取糖蛋白效果较好,该模型对优化墨鱼缠卵腺糖蛋白提取工艺具有可行性。
2.3 糖蛋白纯化结果
2.3.1 DEAE-52纯化 将冻干的糖蛋白粗品经DEAE-52纤维素阴离子交换层析柱层析,用0~1 mol/L的NaCl洗脱,分别检测蛋白和糖含量,得到流出曲线如图7。
如图7所示,经层析柱分离,每隔1 min收集流出液,用硫酸-蒽酮法在吸光度为620 nm处检测糖含量,发现有两组重叠峰(11~20 min,21~31 min),由于21~31 min的重叠峰中含有两个糖峰,考虑到后期纯化过程,故选择11~20 min时的重叠峰为研究对象,经透析,冷冻干燥得糖蛋白半纯品。

图7 DEAE-52柱层析分离图谱Fig.7 DEAE-52 column chromatography separation map
2.3.2 Sephacyl S-300 HR柱层析 将冻干的糖蛋白半纯品经Sephacyl S-300 HR柱层析,用0.02 mol/L的PBS(pH7.4)缓冲液洗脱分别检测蛋白和糖的吸光值,得到流出曲线如图8。
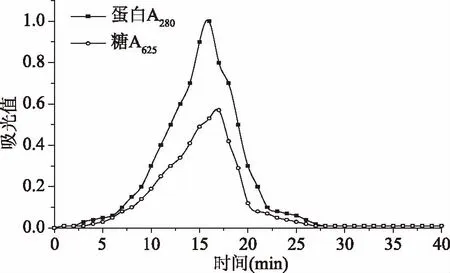
图8 Sephacyl S-300 HR柱层析分离图谱Fig.8 Sephacyl S-300 HR column chromatography separation map
由图8可知,经过Sephacyl S-300 HR柱层析,采用硫酸-蒽酮法在吸光度为620 nm处检测糖的吸光值,得到一组重叠组峰,收集高峰重叠部分,经透析,冻干后得到白色糖蛋白纯品。
2.3.3 SDS-PAGE电泳鉴定纯化后的糖蛋白 通过蛋白染色和糖染色条带可以发现,两块染色胶在同一位置显示条带,且都只有一个条带,说明纯化物是糖蛋白,纯度达到电泳纯。根据marker条带显示墨鱼缠卵腺糖蛋白的分子量约为80 kDa。

图9 SDS-PAGE电泳图Fig.9 SDS-PAGE Electrophoresis注:1:电泳标准蛋白(marker);2~4:墨鱼缠卵腺糖蛋白考马斯亮蓝染色条带;5~7:墨鱼缠卵腺糖蛋白PAS染色条带。
2.3.4 墨鱼缠卵腺糖蛋白各组分含量 由表4可知,墨鱼缠卵腺去外层薄膜后脂类含量较少,水分、蛋白、糖含量较多,纯化后得到纯化物的蛋白含量为65.53%±0.8%,糖含量为31.74%±1.1%,说明提取纯化过程有效。

表4 墨鱼缠卵腺原料、墨鱼缠卵腺糖蛋白基本成分(%)Table 4 Basic ingredients of cuttlefish egg-wrapping glands and cuttlefish egg-wrapping glands glycoprotein(%)
3 结论
本实验利用单因素结合响应面法优化墨鱼缠卵腺糖蛋白提取工艺,采用Design-Expert软件的中心组合设计方法设计响应面实验。根据分析结果并结合操作实际得出墨鱼缠卵腺糖蛋白最佳提取工艺为:温度24 ℃,时间3.6 h,NaOH浓度0.4 mol/L,料液比1∶20 g/mL,超声功率200 W。在此条件下进行验证试验,得出墨鱼缠卵腺糖蛋白实际得率为16.13%±0.16%,与预测值误差仅为0.96%,说明该模型对优化墨鱼缠卵腺糖蛋白提取工艺具有可行性。
对最优工艺下的提取物进行纯化,经EDAE-52离子交换柱层析分离、Sephacryl S-300HR柱层析分离后得到纯品糖蛋白,经电泳分析得出所纯化的糖蛋白纯度达到电泳纯,其中蛋白含量为65.53%±0.8%,总糖含量为31.74%±1.1%,得率为墨鱼缠卵腺去外层薄膜原料的0.91%。
