纤维亚麻种间杂交D1代的RAPD-PCR鉴定
2019-04-14宋鑫玲曹洪勋孙宇峰王晓楠夏尊民
宋鑫玲,曹洪勋,孙宇峰,王晓楠,夏尊民
(黑龙江省科学院大庆分院,黑龙江 大庆 163319)
种间杂交是育种工作者创造新变异的重要手段,种间杂交技术不仅能创新种质资源,而且能够拓宽种质资源遗传基础,丰富遗传背景。通常情况下,同一作物同一属、不同种之间杂交会出现不亲和的现象,表现为种间杂交结实率降低、不结实、种子干瘪、种子不能萌发、幼胚败育等现象,很难得到完整种子。基于以上问题周光宇等[1]首次提出利用花粉管通道技术打破种间杂交不亲和的障碍。花粉管通道技术是利用自然授粉之后能发出花粉管,外源DNA直接经花粉管进入子房而实现与染色体配对交换的过程。这一技术已在玉米[2]、水稻[3]、小麦[4]等作物实现了应用,并得到了丰富变异的导入后代。王玉富等[5]首次将这一技术应用于亚麻育种上,并获得亚麻新品种黑亚14号。由于外源DNA导入后代中仅有一部分是真正的导入后代,而哪些是真正的变异材料,需要开展科学规范的鉴定,因此,采用一定的方法将后代中真正的杂交变异材料筛选出来十分必要。
目前常用的技术有AFLP、RAPD、SSR、SNP等。前人对于外源DNA导入后代真实性鉴定的研究鲜有报道,张丽丽等[6]采用SSR技术对宿根亚麻与栽培亚麻杂交的后代进行鉴定,结果发现杂交后代中仅有1株为真正的杂交种。由于作物遗传变异是以性状变异为单位,一个性状可能由单基因控制,也可能由多基因控制,而且外源DNA导入后代的变异是多方向的[7],故而本试验拟采用RAPD技术对后代进行鉴定,利用特异性引物对参试的后代群体进行PCR扩增,筛选出后代群体中出现供体条带的个体,计算导入率,旨在为创新种质资源奠定基础。
1 材料与方法
1.1 试验材料
试验采用野亚麻为供体材料,Viking为受体材料,随机取130个个体作为导入后代参试群体,RAPD引物10个,2 × Taq Master Mix (Dye Plus),ddH2O,Argorse(琼脂糖),1×TAE,EB(溴化乙锭),DL2000 bp DNA Marker,DL15000 bp DNA Marker。
1.2 试验方法
1.2.1 亚麻种子DNA提取
试验采用改良的高盐低pH值法[8],提取供体、受体、参试群体种子的总DNA,采用超微量分光光度计及琼脂糖检测纯度及条带的完整性。
1.2.2 引物筛选
试验采用李秋芝等[9]筛选的试验引物10个,引物编号及序列见表1。
表1 10个RAPD引物编号及序列
Table 1 10 RAPD primer numbers and sequences
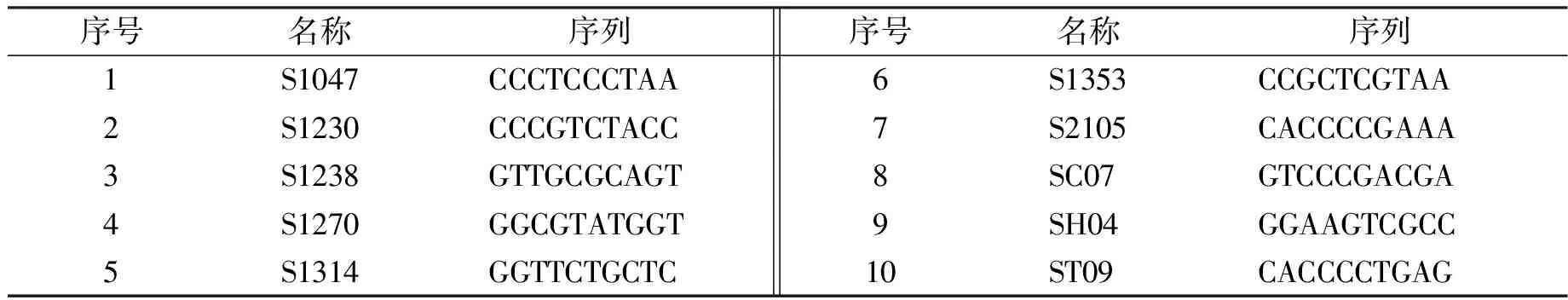
序号名称序列序号名称序列1S1047CCCTCCCTAA6S1353CCGCTCGTAA2S1230CCCGTCTACC7S2105CACCCCGAAA3S1238GTTGCGCAGT8SC07GTCCCGACGA4S1270GGCGTATGGT9SH04GGAAGTCGCC5S1314GGTTCTGCTC10ST09CACCCCTGAG
RAPD反应体系:2×Taq Master Mix 12.5 μL+DNA模板2 μL+Primer 1 μL+无菌水4.5 μL。
PCR过程:94 ℃ 5 min预变性,94 ℃ 1 min,36 ℃ 1 min,72 ℃ 2 min,35次循环之后,72 ℃ 5 min延伸,4 ℃保持。将PCR产物经琼脂糖凝胶电泳检测,筛选供体与受体有差异的引物条带。
1.2.3 群体鉴定
采用筛选得到的RAPD多态引物,经PCR扩增后,将产物经琼脂糖凝胶电泳检测,选择与供体具有相同条带的个体。
2 结果与分析
2.1 亚麻种子DNA提取效果及检测结果分析
由图1可知,提取的DNA产物在260 nm下有最大吸收峰,3次重复显示的吸收峰较为一致。第3、5、6泳道检测出明显条带,第5泳道浓度最大,提取的野亚麻DNA条带完整清晰,无拖尾,片段大于1.5 kb,RNA消化比较干净,其他泳道没有检测出条带(见图2)。基于传统DNA提取亚麻种子的方法优化一粒亚麻种子DNA提取技术,结果如图3所示,可以看出微量DNA能够检测到完整条带,通过与marker亮度比对,估算其浓度约为50 ng/uL,条带片段大于1.5 kp,无降解,略有少量RNA,但不影响PCR反应。
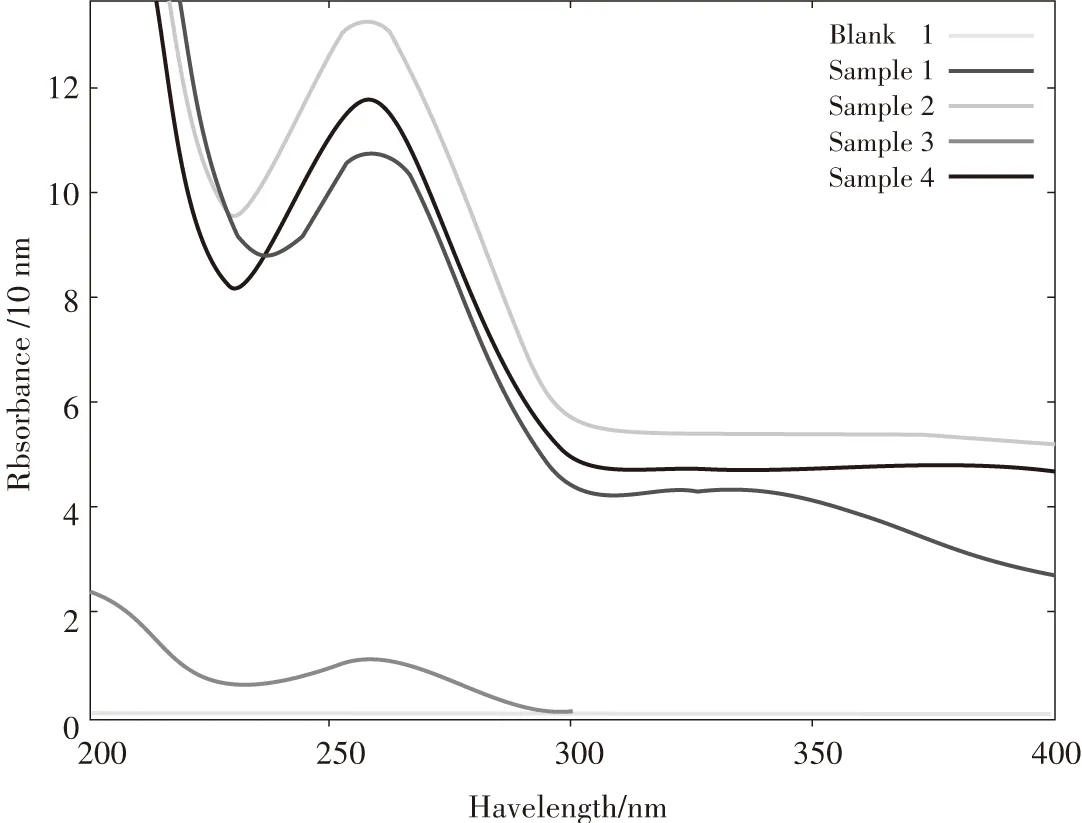
图1 野亚麻DNA的超微量检测Fig.1 Ultra-micro-detection of wild flax DNA
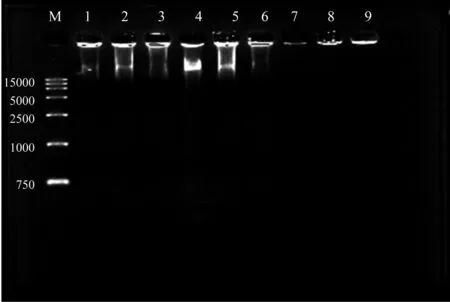
图2 DNA大量提取的琼脂糖电泳检测Fig.2 Agarose electrophoresis detection of DNA extraction
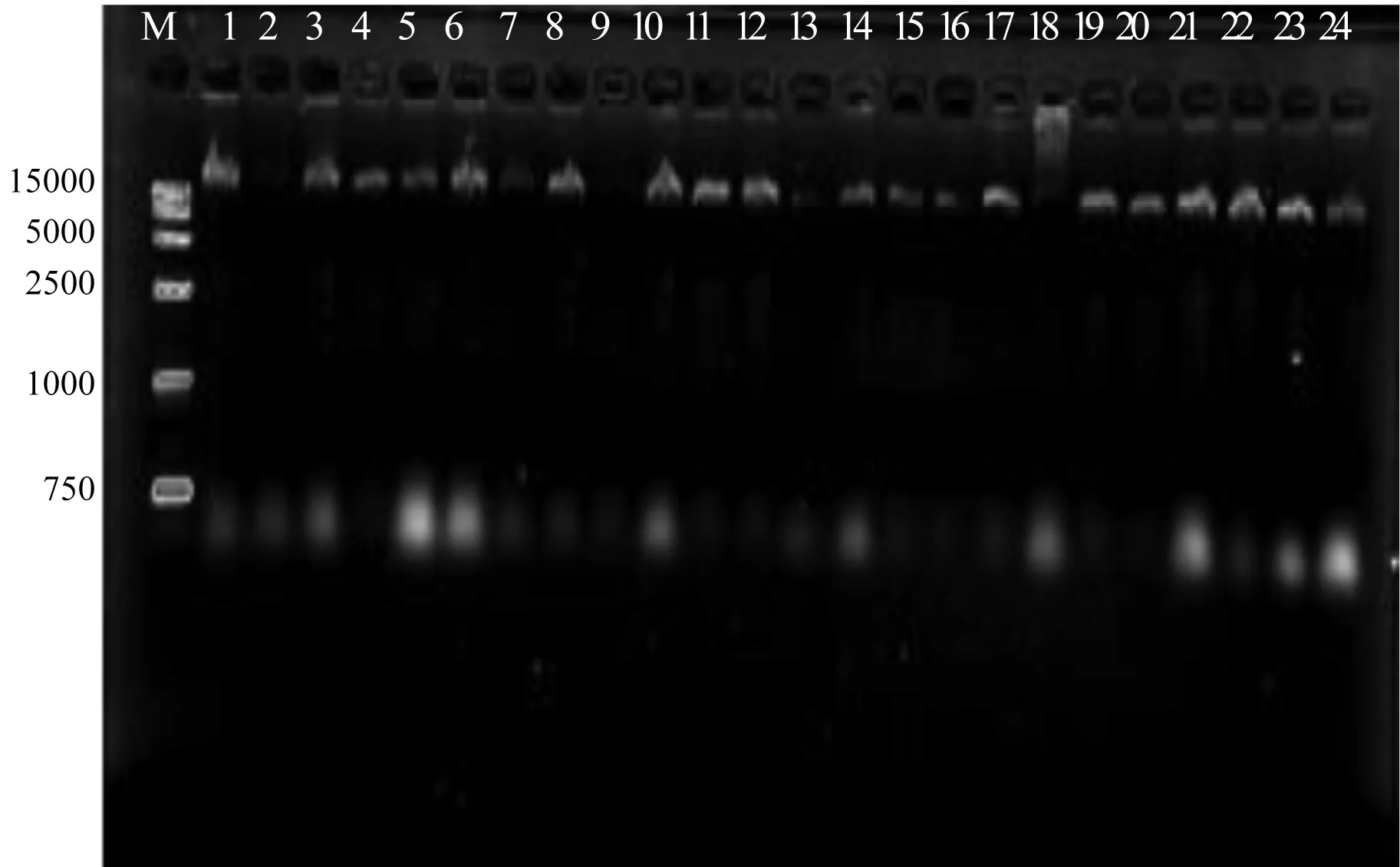
图3 DNA超微量提取的琼脂糖检测Fig.3 Detection of DNA ultra-micro extraction agarose
2.2 RAPD引物筛选结果分析
参试的10个引物经PCR扩增获得如下结果(见图4、 5),由图4可知,引物S1314在受体Viking扩增出一条介于250~500 bp的条带,在供体野亚麻上扩增出750 bp和500 bp两条条带,证明该引物在供体与受体之间具有多态性。从图5可以看出,引物SH04在受体扩增出一条250 bp的条带,在供体扩增出1000、750、500 bp以及介于500~750 bp和250~500 bp之间的5条条带,因此证明该引物在供体与受体之间具有多态性。

图4 特异引物S1314的筛选与条带Fig.4 Screening and banding of specific primer S1314

图5 特异性引物SH04筛选与条带Fig.5 Specific primer SH04 screening and banding
2.3 导入后代群体真实杂交种的筛选
将Viking为受体的部分后代做鉴定,随机抽取的后代个体经PCR扩增获得如下结果:参试的130个个体中,经引物SH04扩增后,有5个与供体一致的条带,图6显示的是部分群体的PCR鉴定结果。从图中可以看出,14号个体在引物SH04下共扩增出7条带,其中存在和供体与受体相同的条带;17号个体扩增出 7条带,包含供体与受体的条带;22号个体扩增出6条带,也同时包含供体与受体的条带。图7是经过引物S1314筛选得到的14号个体,可见14号个体在引物S1314扩增出 6条带,包含供体和受体的条带。证明上述个体为种间杂交种,导入率为1.3%。
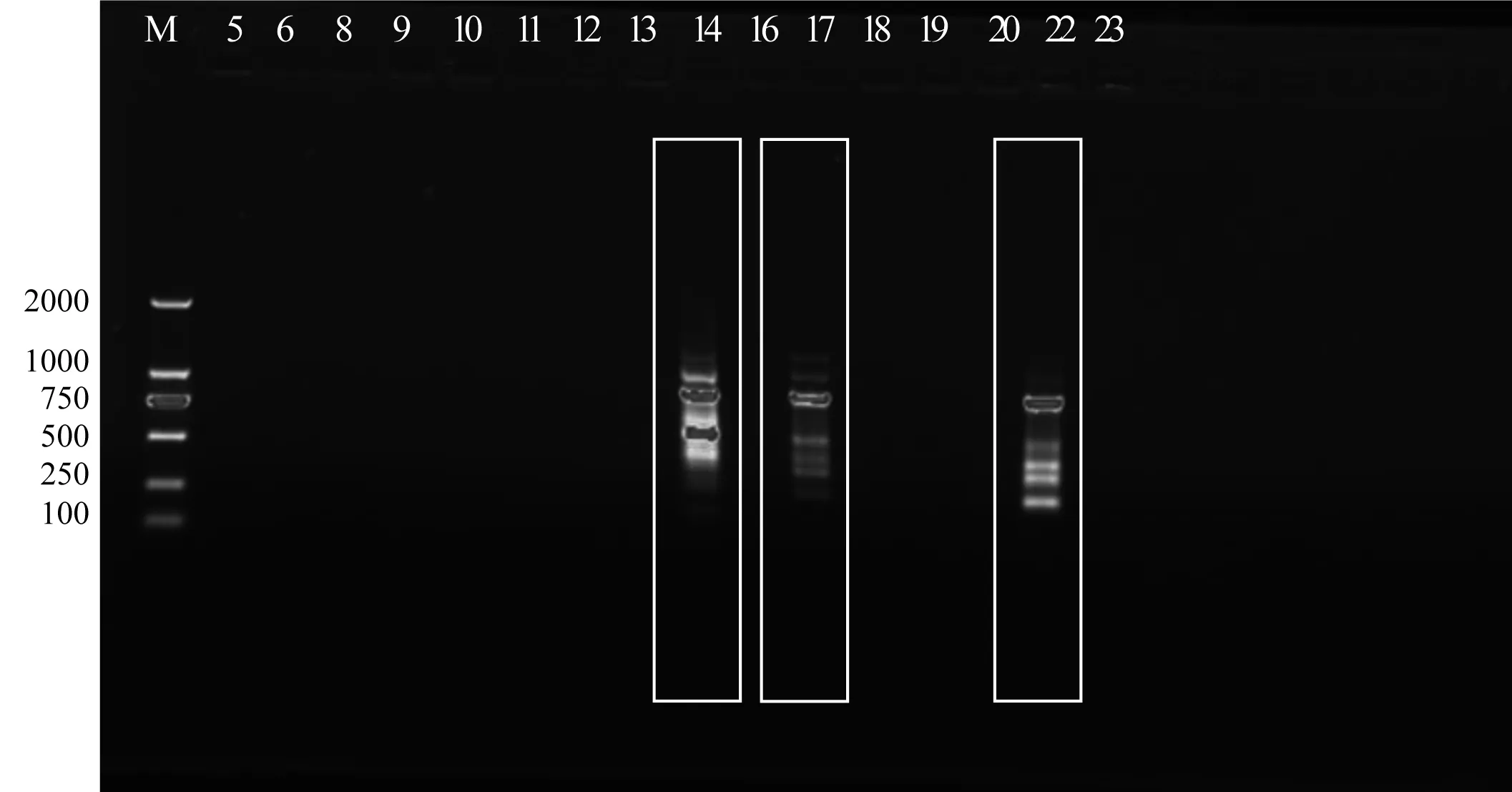
图6 引物SH04筛选出的差异个体Fig.6 Differential individuals screened by primer SH04

图7 引物S1314筛选出的差异个体Fig.7 Differential individuals screened by primer S1314
3 讨论
外源DNA导入对提取的DNA要求较高,研究[10]表明,DNA浓度对导入率影响差异显著,浓度过低,导入率降低,浓度过高则DNA很难随花粉管进入子房,以250 ng/μL为适宜浓度。在野亚麻DNA提取过程中,由于野亚麻种皮含有大量的果胶质,果胶作为一种多糖,与DNA分子属耦合关系,很难与其分离,传统的CTAB法提取的DNA粘度很大,可采用分光光度计检测其浓度,但琼脂糖凝胶电泳无法跑出完整条带。本试验中提取缓冲液为酸性,可将DNA-果胶最大程度释放,经尼龙网过滤可去除大部分果胶质,再用酸性醋酸钾去除杂质,便可得到大量的DNA,溶液的粘度几乎为零,最高浓度1200 ng/μL。在此研究基础上,同时实现了一粒亚麻种子DNA的超微量提取,浓度约为50 ng/μL,条带清晰完整,满足PCR的基本需求。
采用外源DNA导入技术获得的后代中,有一部分是真正的杂交后代,大部分是自花授粉的后代。前人[11]采用具有明显差异的供体受体为研究对象,通过田间筛选选出后代中具有受体性状的植株。王黎明等[12]采用同工酶法研究高粱导入外源DNA后的同工酶谱的变化,发现酶谱出现增加或减少的现象,说明有部分基因整合到了受体DNA上。随着分子生物学的发展,可以从基因水平鉴定后代中是否有供体条带出现以及基因片段的大小。本试验在引物筛选中获得了两个RAPD多态性引物,分别是S01314和SH04。参试的130个个体经SH04引物筛选得到个体14号、17号、22号、84号和105号具有差异性的条带。经引物S1314筛选得到个体14号具有差异性条带。在本试验中外源DNA导入率为3.8%,这一结果与周光宇[13]的研究结果相一致。本试验中筛选的5个差异个体中均有受体条带的出现,这些片段与供体的DNA发生整合,说明外源DNA导入法在野生资源利用方面具有重要价值,发生基因整合的个体可以通过田间表型来观测变异的方向,同时扩增出的基因片段可以用来测序,进一步开展变异基因的功能等研究。
种间杂交的最终目的是创造新变异材料,最终形成品种,而新品种的鉴定技术与方法具有多样性[14]。RAPD技术并不是唯一的检测手段,变异株的形态学、农艺学性状的变异仍需在大田或盆栽中进行,观察活体植株的变异,下一步将围绕导入后代的表型鉴定开展变异株DNA扩增片段个体重测序,寻找有利变异基因。
4 结论
参试的10对引物中,具有特异性的引物2个,分别是S1314、SH04。参试的130个个体中有5个个体检测出与供体具有相同的条带,导入率为3.8%。
