转化生长因子β1诱导胰腺癌肿瘤干细胞产生的研究
2019-04-13史壹雄梁雅琴叶百亮胡炳仁阮小蛟
史壹雄 梁雅琴 叶百亮 胡炳仁 阮小蛟
胰腺癌细胞具有极强的运动侵袭能力,早期即可出现胰周组织侵袭浸润或远处转移,导致根治性手术切除率极低和术后短期内肿瘤复发转移,造成患者死亡[1,2]。肿瘤干细胞(cancer stem cell,CSC)是肿瘤组织中具有永久自我更新能力并能产生异质性肿瘤细胞的细胞,所占比例极少,但因具有永久自我更新能力,故是肿瘤源源不断产生的根源[3,4]。白细胞分化抗原(cluster of differentiation,CD)133是最常用的干细胞的表面标志物,CD133阳性细胞具有自我更新和无限增殖、致瘤性强等特点,而CD133阴性的细胞缺乏这种潜力[5]。最近研究发现,CD133与肿瘤恶性程度和侵袭性相关,并且其表达程度与胰腺癌患者的存活率降低相关[6]。通过上皮-间质转化(epithelial-mesenchymal transition, EMT),上皮细胞失去了细胞极性,失去与基底膜的连接等上皮表型,获得了较高的迁移与侵袭、抗凋亡和降解细胞外基质的能力等间质表型,能为肿瘤细胞提供运动迁徙和向邻近组织侵袭的能力[7,8],EMT典型表现为钙黏蛋白E(E-cadherin)丢失。研究表明胰腺癌患者体内TGF-β1呈现过度表达状态,高血清转化生长因子β1(TGF-β1)水平与胰腺癌的不良预后相关[9]。TGF-β1是EMT的重要诱导因子,EMT在增强肿瘤细胞运动侵袭能力的同时,还能诱导肿瘤细胞获得CSC特性[10,11]。 本研究通过将TGF-β作用于PANC-1、BxPC-3、AsPC-1 3种胰腺癌细胞系,研究TGF-β对胰腺癌细胞生长的影响及CD133表达的影响,并检测胰腺癌细胞EMT相关因子,E-cadherin和波形蛋白(vimentin)的表达,探讨TGF-β在胰腺癌的发展过程中的所起作用,为从干细胞的层面上抑制胰腺癌的侵袭、转移提供新的思路。
材料与方法
1.细胞系和细胞培养:本研究采用3种人类胰腺癌细胞系:PANC-1、BxPC-3和AsPC-1细胞株作为体外模型,购于中国科学院上海细胞生物学研究所。PANC-1细胞和BxPC-3细胞培养于添加了10%胎牛血清的DMEM培养基(Dulbecco′s Modified Eagle Media培养基, 500ml C11995, 美国Gibco公司)中进行,AsPC-1细胞培养于添加了10%胎牛血清的 R PMI-1640培养基(RPMI MEDIUM 1640,500ml,C11875, 美国Gibco公司)中进行。以上3种细胞均培养于CO2含量5%,37℃及饱和湿度的恒温培养箱中。TGF-β1(美国R&D systems公司)储存于添加了0.1%的胎牛血清的4mmol/L晶体盐酸溶液中冻存于-20℃冰箱,在每次实验前融化并溶解在各细胞相应的含10%胎牛血清的培养基中。
2.细胞计数法:取3种人类胰腺癌细胞系对数生长期细胞,制成单细胞悬液,对照组培养基为含10%胎牛血清的普通培养基,实验组培养基为含10ng/ml TGF-β1的10%胎牛血清培养基,各2ml,第1~6孔细胞分别培养1、2、3、5、6天,每3天更换培养液,第1天取第1孔细胞分别取实验组及对照组用细胞计数器行癌细胞计数,第2天取第2孔细胞行癌细胞计数,依次类推。上述实验重复3次。使用Excel绘制生长曲线,并作图法在细胞生长曲线的对数生长期找出细胞增加一倍所需的时间即细胞倍增时间,即在Excel内添加生长曲线的趋近线,并同时显示公式y=k×ex,k为一常数系数,在细胞指数生长期内分别取两个呈倍增关系的y值,根据公式y=k×ex计算相应x值,两x值相减即为细胞倍增时间。
3.流式细胞学:每种胰腺癌细胞系处理时分3组,即空白组、对照组、实验组,每种胰腺癌细胞以5×105个/ml的浓度种植于6孔板内,每孔包含10%胎牛血清的培养基2ml,实验组孵育过夜后换用TGF-β1浓度为10ng/ml的10%胎牛血清的相应培养基2ml,空白组与对照组则加不包含TGF-β1的普通10%胎牛血清的培养基2ml。作用72h后获得对数生长期的胰腺癌细胞,胰酶(0.25%Trypsin-EDTA, 1X, 100ml, 美国Gibco公司)消化获得单细胞悬液,对照组与实验组均在避光条件下在细胞液内加样反应。避光条件下在细胞培养液内加样反应:依次加入80μl PBSE(pH值为7.2的PBS,含0.5%BSA,2mmol/L的EDTA液即10ml PBS液中加入0.05g BSA 和 7.45mg EDTA),再加入20μl FCR blocker试剂(德国Miltenyi Biotec公司)及10μl CD133/1 (AC133)-PE, human(德国Miltenyi Biotec公司,货号:130-080-801),室温避光孵育20min后再次用PBSE漂洗2次,振荡混匀后于1h内使用Beckman Coulter FC500 流式细胞仪,使用CXP流式细胞学软件 (美国Beckman Coulter公司) 上机检测CD133+的表达率, 空白组不经过上述加样过程直接使用 CXP 流式细胞学软件上机检测CD133+的表达率。
4.PANC-1及TGF-β1表达Western blot法检测:蛋白样品制备:组织匀浆,裂解,台式离心机,11000r/min,4℃离心10min。BCA法测定蛋白浓度,聚丙烯酰胺凝胶电泳,转膜,封闭,孵育一抗,洗膜,孵育二抗,洗膜,化学发光显影。actin作为参照基因。 E-cadherin (cell signaling,#3195),一抗浓度1∶1000,二抗浓度(anti rabbit)1∶3000,135000;Vimentin (美国R&D system公司,AF2105 ),一抗浓度1∶1000,二抗浓度(anti goat)1∶3000,55000。

结 果
1.TGF-β1对3种胰腺癌细胞生长的影响:TGF-β1处理PANC-1实验组细胞及无处理对照组6天培养结果显示两组细胞均呈对数生长,培养前3天,两组生长速度相似,两组细胞计数无显著性差异(P>0.05),培养第5天及第6天,与对照组比较,实验组胰腺癌细胞生长明显受抑制,其细胞计数显著低于对照组(P均<0.05),PANC-1对照组、实验组培养5天的PANC-1胰腺癌细胞数分别为(13.70±1.03)×105个、(9.97±0.95)×105个;两组培养6天的PANC-1胰腺癌细胞数分别为(24.10±2.64)×105个、(15.41±1.35)×105个,详见图1。计算对照组和实验组细胞群体倍增时间分别为29.0和35.2h,倍增时间明显延长。

图1 TGF-β1对PANC-1细胞生长的影响
TGF-β1处理BxPC-3实验组细胞及无处理对照组6天培养结果显示两组细胞亦呈指数生长,培养前2天,两组生长速度相似,两组细胞计数比较,差异无统计学意义(P>0.05),培养第3天及第5天,与对照组比较,实验组胰腺癌细胞生长明显受抑制,其细胞计数显著低于对照组(P均<0.05),第6天实验组细胞计数较对照组有降低趋势,但差异无统计学意义(P>0.05)。BxPC-3对照组、实验组培养3天的BxPC-3胰腺癌细胞数分别为(5.24±0.31)×105个、(4.85±0.33)×105个;两组培养5天的BxPC-3胰腺癌细胞数分别为(12.97±0.64)×105个、(8.78±0.36)×105个;两组培养6天的BxPC-3胰腺癌细胞数分别为(20.71±2.51)×105个、(14.36±3.55)×105个,详见图2。计算对照组和实验组细胞群体倍增时间分别为34.8和41.2h,倍增时间明显延长。

图2 TGF-β1对BxPC-3细胞生长的影响
TGF-β1处理AsPC-1实验组细胞及无处理对照组6天培养结果显示两组细胞均呈对数生长,培养前2天,两组生长速度相似,两组细胞计数比较差异无统计学意义(P>0.05),培养第3天、第5天及第6天,与对照组比较,实验组胰腺癌细胞生长明显受抑制,其细胞计数显著低于对照组(P均<0.05),AsPC-1对照组和实验组培养3天的AsPC-1胰腺癌细胞数分别为(4.75±0.35)×105个、(3.83±0.06)×105个;两组培养5天的AsPC-1胰腺癌细胞数分别为(12.67±0.81)×105个、(10.93±1.37)×105个;两组培养6天的AsPC-1胰腺癌细胞数分别为(18.72±1.21)×105个、(14.53±2.34)×105个,详见图3。对照组和实验组细胞群体倍增时间分别为30.8和34.49h,倍增时间延长。

图3 TGF-β1对AsPC-3细胞生长的影响
2.3种胰腺癌细胞系CD133+胰腺癌细胞比例:TGF-β1作用于人类胰腺癌PANC-1、BxPC-3及AsPC-1细胞系72h后,流式细胞术检测胰腺癌细胞系中CD133+细胞比例变化情况,结果显示PANC-1胰腺癌细胞系空白组、对照组、实验组CD133+细胞率分别为(23.57±5.46)×104、(28.78±14.38)×104及(105.90±27.82)×104,BxPC-3胰腺癌细胞系空白组、对照组、实验组CD133+细胞率分别为(47.73±5.86)×104、(51.60±7.75)×104及(124.73±52.84)×104,AsPC-1胰腺癌细胞系空白组、对照组、实验组CD133+细胞率分别为(39.20±4.81)×104、(39.96±5.13)×104及(88.80±15.94)×104,详见图4、图5。

图4 3种胰腺癌细胞空白组、对照组及实验组流式细胞学检测CD133+细胞率
独立样本t检验显示,PANC-1、BxPC-3及AsPC-1 3种胰腺癌细胞系空白组与对照组CD133+细胞比例比较,差异无统计学意义,3种胰腺癌细胞细胞系实验组与对照组比较,CD133+细胞比例实验组较对照组明显升高(P<0.05,图5)。

图5 3种胰腺癌细胞不同处理组CD133+细胞比例(1/万)
3.Western blot法检测结果:(1)PANC-1胰腺癌细胞系E-cadherin表达:Western blot法检测结果显示,10ng/ml TGF-β1处理组PANC-1胰腺癌细胞E-cadherin表达较正常组有降低趋势,但差异无统计学意义(P>0.05,图6)。(2)PANC-1胰腺癌细胞系Vimentin表达:Western blot法检测结果显示, 10ng/ml TGF-β1处理组PANC-1胰腺癌细胞Vimentin表达较对照组有有升高趋势,但差异无统计学意义(P>0.05,图7)。

图6 E-cadherin Western blot法检测结果
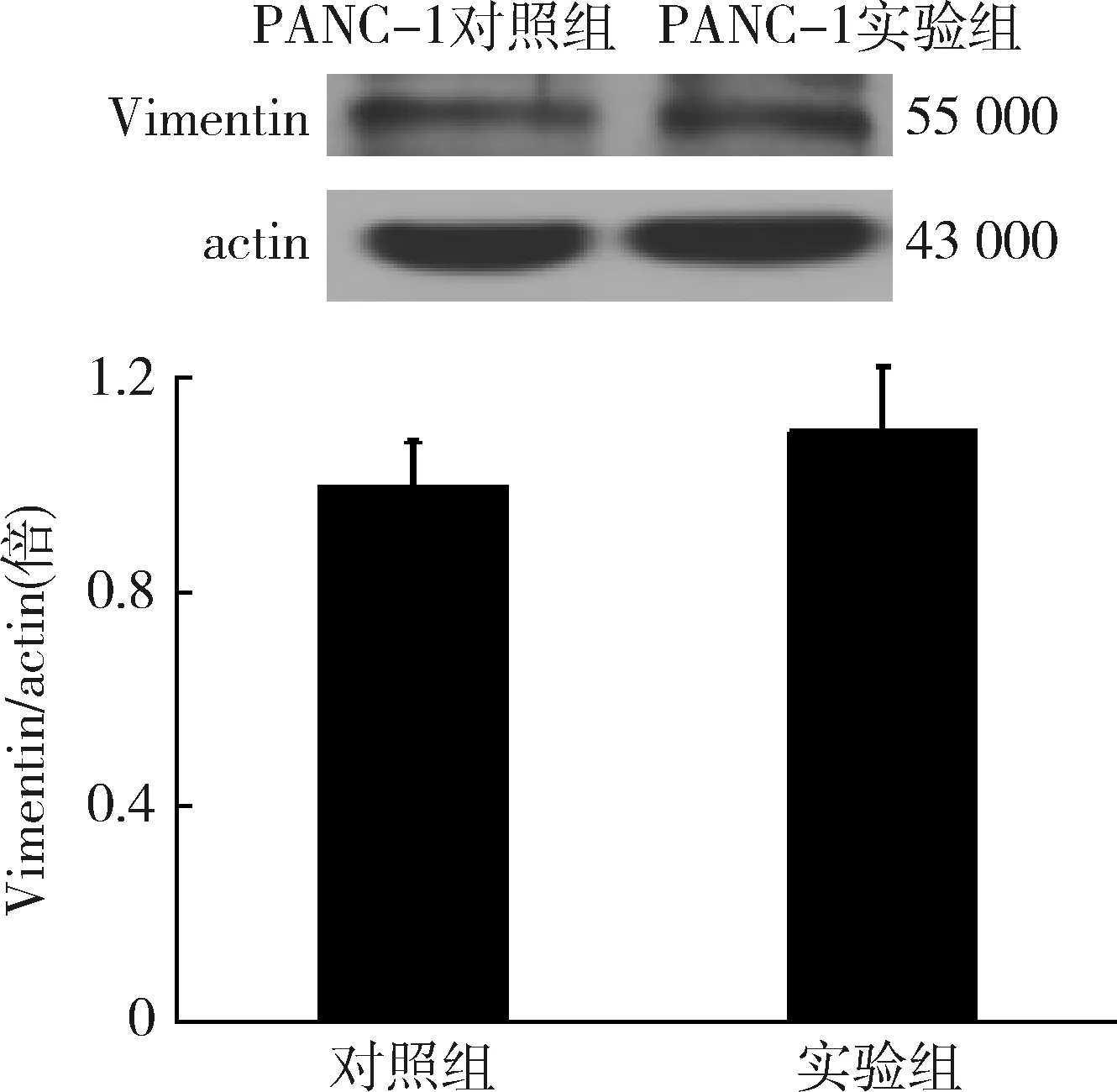
图7 Vimentin Western blot法检测结果
讨 论
在肿瘤形成过程中,TGF-β1可能以自分泌或旁分泌的方式而对肿瘤的进展起双相调节作用。早期肿瘤形成过程中,TGF-β1起抑制细胞周期进程的作用,进而抑制肿瘤生长。 相反,癌细胞后来通过增加TGF-β1拮抗剂的表达、突变TGF-β1受体或使SMAD4失活逐渐对 TGF-β1-介导的生长抑制作用产生了适应和抵抗,最终,TGF-β1对肿瘤的生长抑制作用消失,并进而转变为通过提升EMT或诱导血管生成而促进肿瘤细胞的转移[12,13]。
本研究发现,胰腺癌细胞在TGF-β1作用后生长速度减缓,倍增时间延长,TGF-β1在生长的中后期均能显著抑制3种肿瘤细胞的生长速率,但起效及作用持续时间不同。
TGF-β1作用后能显著提高胰腺癌BxPC-3及AsPC-1细胞系中CD133+细胞比例(P<0.05)。而CD133+阳性细胞代表胰腺癌CSC,CD133+胰腺CSC已被证明是具有完全的致瘤性,以及对放化疗高度抵抗,且CD133阳性的胰腺癌CSC对肿瘤的转移至关重要[14~16]。
流式细胞学实验结果提示10ng/ml的TGF-β1作用后3种胰腺癌细胞系的CD133+表达增加了。这里似乎有矛盾之处,TGF-β1抑制了胰腺癌细胞的生长,但却提高了CSC的比例,可能有两种原因造成以上结果:(1)TGF-β1抑制了非致肿瘤细胞的生长,但对CSC的作用甚微,故导致CSC相对增多,其比例增高。(2)10ng/ml的TGF-β1虽抑制了普通非致肿瘤细胞的生长,但诱导CSC干细胞形成,TGF-β1作为肿瘤EMT的诱导剂,肿瘤细胞的EMT和CSC之间存在着“相辅相成”的有机联系,肿瘤细胞可通过EMT而获得CSC的特性,从而获得高致瘤能力。You等[17]研究采用EMT的诱导因子TGF-β作用于CD133-的肝癌细胞,发现能诱导产生CD133+的肝癌细胞,且体内荷瘤实验证明诱导产生的CD133+肝癌细胞与野生型CD133+肝癌细胞的致瘤能力未见明显差异,具有肝癌CSC特性。
肿瘤细胞的运动侵袭能力和CSC特性对于实现肿瘤进展同等重要,两者缺一不可。上皮屏障功能和完整性依赖于细胞间连接的形成。钙黏蛋白(E-cadherin)构成的主要跨膜组件和黏合连接处并且对上皮和信息交互至关重要。钙黏蛋白丢失常被病理学家使用作为肿瘤细胞入侵的一个标志。用转基因动物实验证明钙黏蛋白的过表达可预防肿瘤的转移和侵袭。本研究发现PANC-1胰腺癌细胞系E-cadherin有降低趋势,且Vimentin有增高趋势,但均无显著性差异,考虑细胞培养时间尚短,相当于胰腺癌细胞发展早期,故TGF-β1诱导EMT作用不显著有关。研究显示,采用不同剂量(5、10、20、50ng/ml)的TGF-β1作用BxPC-3胰腺癌细胞均24h,各剂量E-cadherin的表达比较,差异无统计学意义;而采用不同时间(0、4、7、14天)的TGF-β1,剂量均为10ng/ml 作用BxPC-3胰腺癌细胞,结果显示E-cadherin的表达随着作用时间的延长而降低,从4~7天开始有差异[18]。研究证实,Erk途径的激活参与TGF-β1诱导的EMT过程[19]。TGF-β1虽然对BxPC-3、 AsPC-1及PANC-1 3种胰腺癌细胞系均有抑制其细胞生长作用,但TGF-β1作用增加CSC比例,故提示非选择性应用TGF-β1可能并不利于胰腺癌细胞的生长,却能提高CD133+的比例,增加胰腺癌细胞的侵袭性及致瘤性,TGF-β1在不同时期对胰腺癌细胞的作用及其具体机制将成为未来的研究重点。
