响应面法优化猕猴桃叶绿素提取工艺
2019-04-12,,,
,, ,
(三峡大学生物与制药学院,湖北省生物酵素工程技术研究中心, 生物催化宜昌市重点实验室,湖北宜昌 443002)
猕猴桃是猕猴桃科(Actinidiaceae)猕猴桃属植物的一种浆果,又称猕猴梨、藤梨、羊桃、毛木果等,原产于中国湖北宜昌,是20世纪人工驯化栽培野生果树最早且最优的四大树种之一,其营养丰富,风味独特,经济价值高,而被誉为“水果之王”,深受消费者的青睐,尤其因其果实富含维生素C,而有“VC之王”的美誉[1]。猕猴桃果肉颜色各异,主要有绿肉、黄肉和红肉3种,其绿肉猕猴桃果实含有大比例的叶绿素和低含量的类胡萝卜素,猕猴桃果实及其加工品不仅可以增进食欲、滋补强身、防癌、抗氧化、抗衰老、提高身体免疫机能,提高运动能力,还能有效调节脂肪细胞的分化,降低血液中胆固醇和甘油二酯,对糖尿病和特异性皮炎均有良好治疗效果[2-3]。
绿肉猕猴桃中叶绿素含量高,叶绿素具有抗癌、抑菌、抗氧化、护肝、抗突变、抗贫血等药理作用[4-6],同时叶绿素作为天然色素,可应用于医疗、食品、化妆品等行业。叶绿素不稳定,在热、酸、光照、氧气、酶等条件下极易发生降解,生成黄褐色或深褐色产物[7-8]。猕猴桃果实酸含量高,在加工过程中遇热易降解,但热处理又是果蔬产品加工中灭酶、灭菌必不可少的工序,所以护绿难度大。在工业上,碱液护绿、金属离子护绿、高温短时热处理护绿应用范围最广[9]。
近年来,叶绿素提取较成熟的方法有:有机溶剂萃取法,此法根据对材料的前处理方式分为研磨法和浸提法[10];微波萃取法,具有热效率高、便于控制、选择性好、回收率高等优点[11];超临界二氧化碳萃取法,具有萃取速度高、常温操作、传热速率快、易控制等特点[12];超声波法,具有安全性好、操作简单、萃取效率高、成本低等优势[13]。
目前对绿肉猕猴桃中叶绿素提取工艺的报道较少,其主要用Arnon法的公式计算值作为研究指标,计算较繁琐。本文以宜昌绿肉猕猴桃为实验对象,采用浸提法提取叶绿素,用响应面优化其提取工艺条件,并以全波长扫描法直接测定的OD值和由Arnon法公式的计算值作为指标,进行比较分析为简化相关数据分析工作提供理论参考。
1 材料和方法
1.1 材料与仪器
新鲜绿肉猕猴桃 当地市场购买;无水乙醇、乙酸乙酯、丙酮 均为分析纯,天津市天力化学试剂有限公司。
FW177中草药粉碎机 天津市泰斯特仪器有限公司公司;JLL30-A食物搅碎器 顺德市希贵电器制造有限公司;ME204E电子天平 梅特勒-托厉多仪器(上海)有限公司;754紫外可见分光光度计 上海光谱仪器有限公司制造,LXJ-IIB低速台式大容量离心机 上海安亭科学仪器厂;HH-2水浴锅 常州智博瑞仪器制造有限公司;EV312旋转蒸发器 北京莱伯泰科仪器股份有限公司;HB-03加热锅 北京莱伯泰科仪器股份有限公司;SHZ-0(III)循环水式真空泵 巩义市予华仪器有限责任公司;UV-1800紫外可见分光光度计 岛津制作所。
1.2 实验方法
1.2.1 工艺流程 猕猴桃→去皮打浆→匀浆称量→提取→离心→减压浓缩→定容→叶绿素提取液→测定[14-15]
操作要点:提取剂为丙酮和乙醇时,取样20 g;提取剂为乙酸乙酯时,取样10 g;提取液离心转数为5000 r·min-1,时间10 min,减压浓缩水浴温度为35 ℃。在相同提取条件下,提取剂为丙酮和乙醇的提取液,测定的OD值在0.1左右,为使得OD值在0.2~0.8范围内,丙酮和乙醇提取液浓缩至5 mL测定,而乙酸乙酯提取液测定的OD值在该范围内。
为了检验OD666值和叶绿素提取含量变化趋势是否一致,以及验证不同条件下此法的适用性和准确性,且只有在得到每种溶剂最优工艺条件下的结果,才能确定哪种溶剂提取效果好。所以在单因素实验中采用三种溶剂及其不同条件下提取叶绿素。
1.2.2 叶绿素a(Chlorophyll a)和叶绿素b(Chlorophyll b)提取含量测定 采用分光光度计比色法,参考Arnon的方法[16-17]。分别测定663和645 nm下的吸光度。按下式计算叶绿素a、叶绿素b的含量。
Chl(μg/g)=Chla+Chlb
式中,Chla、Chlb分别为叶绿素a、b提取含量;Chl为总叶绿素提取含量;v为提取剂的体积,单位mL;m为果浆质量,单位g;n为浓缩倍数;OD663为663 nm下的吸光度值;OD645为645 nm下的吸光度值。
1.2.3 果浆中叶绿素提取液吸光值测定 将待测的叶绿素提取液浓缩至适宜浓度,采用紫外可见全波长扫描仪进行扫描,确定提取液最适吸收波长,在此吸收波长下,以分光光度计法[12-13]测定果浆提取液中吸光值。
1.2.4 叶绿素提取的单因素实验 将猕猴桃匀浆,以叶绿素提取含量和666 nm下的吸光值(OD666)为测定指标,OD666的值对应叶绿素提取含量,在固定液料比1.5∶1 mL/g、提取时间3 h、提取温度60 ℃的情况下,研究不同乙酸乙酯浓度(10%、20%、40%、60%、80%、100%)、不同丙酮浓度(50%、70%、80%、90%、100%)和不同乙醇浓度(60%、70%、80%、90%、100%)对叶绿素提取含量和OD666的影响;固定提取温度60 ℃、提取时间3 h,研究液料比(60%乙酸乙酯:0.9∶1、1.2∶1、1.5∶1、1.8∶1、2.1∶1 mL/g)、液料比(80%乙醇:0.7∶1、1.0∶1、1.2∶1、1.5∶1、2.0∶1 mL/g)、液料比(100%丙酮:0.5∶1、0.7∶1、1.0∶1、1.2∶1、1.5∶1 mL/g)对叶绿素提取含量和OD666的影响;在固定提取时间3 h,乙酸乙酯浓度60%、液料比1.2∶1 mL/g,丙酮浓度100%、液料比1.0∶1 mL/g,乙醇浓度80%、液料比2.0∶1 mL/g条件下,研究温度(20、30、40、50、60、70 ℃)对叶绿素提取含量和OD666的影响;在固定提取温度60 ℃,乙酸乙酯浓度60%、液料比1.2∶1 mL/g,丙酮浓度100%、液料比1.0∶1 mL/g,乙醇浓度80%、液料比2.0∶1 mL/g条件下,研究提取时间(1、2、3、4、5、6 h)对叶绿素提取含量和OD666的影响。为提高试验的可靠性,该试验中每组数据重复做3次。
1.2.5 Box-Behnken法优化试验设计 以单因素试验结果为基础,利用Designexpert 8.0.6软件,根据Box-Behnken设计方法,确定提取剂为乙酸乙酯,以提取剂浓度、料液比、提取时间及提取温度作为自变量,以猕猴桃果肉中叶绿素提取液的吸光值作为响应值,进行4因素3水平的响应面设计试验,各因素的3个水平采用-1、0、1进行编码,如表1。

表1 响应面试验因素水平设计表Table 1 Factor level design of response surface test
1.3 数据处理
2 结果与分析
2.1 检测波长的确定
由图1可知,不同提取剂下提取的色素吸收峰一致,在415和666 nm(图1)有两个吸收峰。叶绿素在蓝紫区(400~450 nm)和红光区(620~700 nm)具有强烈吸收,但类胡萝卜素在蓝紫区(400~450 nm)也有强烈吸收,同时为避免黄酮类和糖类等物质在紫外吸收区域的影响,采用测定波长为666 nm[17-19]。
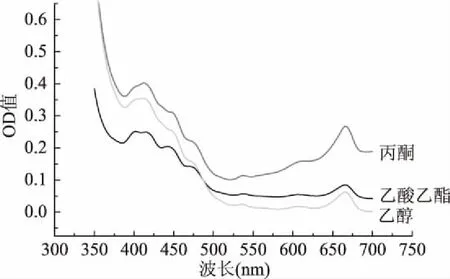
图1 不同提取剂下的紫外全波长扫描Fig.1 UV full-wavelength scanning of different extractants
2.2 单因素实验结果
2.2.1 不同提取溶剂浓度对绿肉猕猴桃中叶绿素提取的影响 由图2可知,不同提取溶剂对绿肉猕猴桃中叶绿素的OD666值及叶绿素提取含量均有显著影响(p<0.05),且其OD666值与叶绿素提取含量变化趋势一致;随乙酸乙酯与乙醇浓度增加,OD666值和叶绿素提取含量先增后减,叶绿素为脂溶性色素,乙酸乙酯微溶于水,叶绿素溶于乙酸乙酯中,与水相分层。叶绿素提取液中含水量对叶绿素提取含量测定和稳定性影响较大[19];随丙酮浓度增加,OD666值和叶绿素提取含量持续增加;乙酸乙酯最佳浓度为60%、丙酮最佳浓度为100%、乙醇最佳浓度为80%;提取效果最好溶剂为乙酸乙酯,显著高于丙酮和乙醇(p<0.05)。
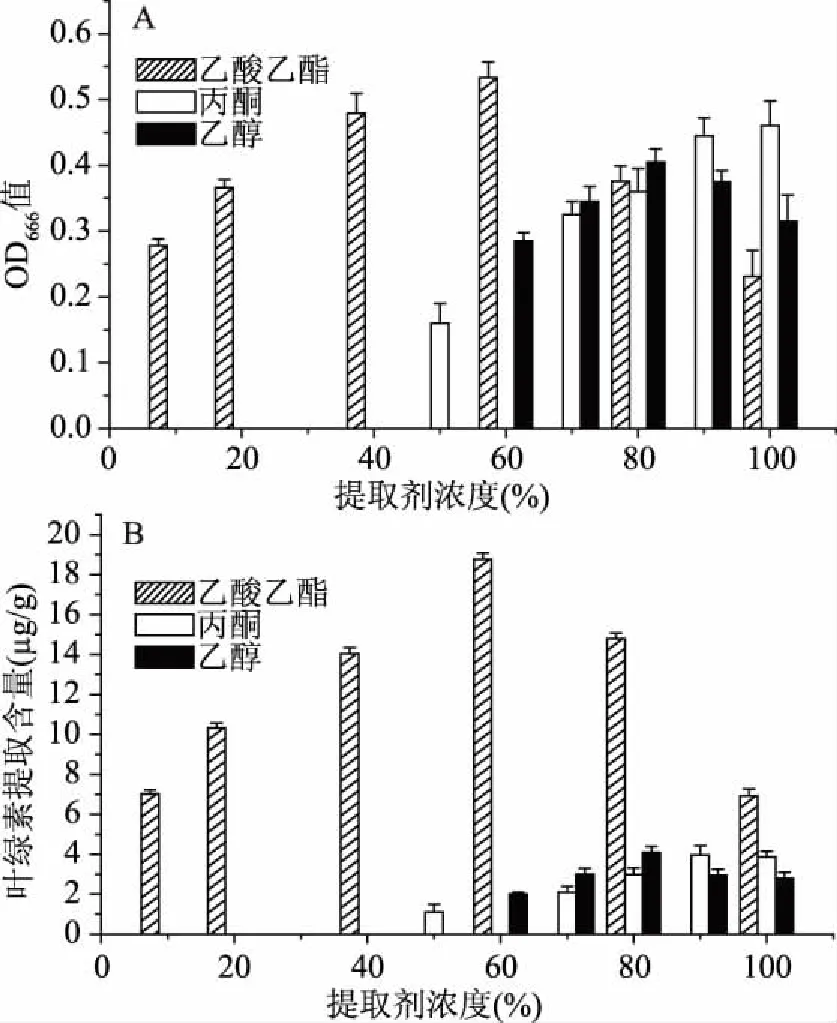
图2 溶剂种类及浓度对叶绿素提取含量的影响Fig.2 Effects of solvent types and concentrations on chlorophyll extraction contents
2.2.2 不同液料比对绿肉猕猴桃中叶绿素提取的影响 由图3可知,不同液料比对绿肉猕猴桃中叶绿素的OD666值及叶绿素提取含量均有显著影响(p<0.05),且其OD666值与叶绿素提取含量变化趋势一致;3种溶剂在固定条件下都随液料比升高,OD值与叶绿素提取含量先升后降。这是因为液料比的增加有利于叶绿素浸出,叶绿素提取含量增加;而液料比过高时,溶剂的增加会影响浸提体系的传热和传质,不利于叶绿素的提取[20]。乙酸乙酯提取最佳液料比为1.2∶1 mL/g、乙醇为2.0∶1 mL/g、丙酮为1.0∶1 mL/g,其中乙酸乙酯提取效果显著差异显著高于丙酮和乙醇提取效果(p<0.05)。
2.2.3 不同提取温度对绿肉猕猴桃中叶绿素提取的影响 由图4可知,不同提取温度对绿肉猕猴桃中叶绿素的OD666值及叶绿素提取含量均有显著影响(p<0.05),且其OD666值与叶绿素提取含量变化趋势一致;三种溶剂在固定条件下都随提取温度升高,OD666值与叶绿素提取含量先升后降。主要是因为,温度升高,分子移动速率加快,使得叶绿素分子与蛋白分离的速率及溶出的速率上升;但在原料一定的情况下,温度差的影响逐渐降低,温度过高之后,猕猴桃果肉中杂质溶出速率超过叶绿素溶出速率,会使吸光度下降[21]。最佳提取温度都在60 ℃,其中乙酸乙酯提取效果最佳,显著高于丙酮和乙醇(p<0.05)。
2.2.4 不同提取时间对绿肉猕猴桃中叶绿素提取的影响 由图5知,不同提取时间对绿肉猕猴桃中叶绿素的OD666值及叶绿素提取含量均有显著影响(p<0.05)。随着提取时间的增加,叶绿素提取含量先升高后下降。这可能是因为随着提取时间的延长,初始提取出的叶绿素部分发生了降解所导致的[22],且其OD666值与叶绿素提取含量变化趋势一致。乙酸乙酯最佳提取时间为4 h、丙酮最佳为3 h、乙醇最佳为5 h。其中乙酸乙酯提取效果最佳,显著高于丙酮和乙醇(p<0.05)。

图5 时间对叶绿素提取含量的影响Fig.5 Effects of time on extraction of chlorophyll
综上所述,在单因素实验中发现,全波长扫描后直接测定的OD666值和Arnon法的公式计算值变化趋势一致,即可用OD值代替Arnon法计算值来作为判断叶绿素提取效果的指标。
2.3 响应面试验对叶绿素提取工艺参数的优化
2.3.1 回归模型的建立 利用响应面方法对叶绿素的提取工艺进行方案分析(表2),利用DesignExpert 8.0.6软件对得到的试验结果进行二次回归拟合。因单因素试验得出OD666值与通过Arnon法得到的叶绿素提取含量变化趋势一致,且乙酸乙酯提取效果最好。此方法能准确地反应出对叶绿素的提取效果,并减少工作量,所以此处直接以OD666值为指标。实验均进行3组平行实验,取其平均值为响应值,与提取时间、提取温度、提取剂浓度、液料比4个因素之间建立的二次多项回归方程:

表2 响应面分析方案及结果Table 2 Analysis scenarios and results of response surface method
Y=-6.594+0.044A+1.295B+0.040C+0.106D-1.450×10-3AB+1.624×10-4AC+4.10×10-4AD-2.50×10-4BC+2.60×10-3BD+1.225×10-3CD-5.403×10-4A2-0.173B2-4.977C2-1.316×10-3D2


表3 回归方程方差分析Table 3 Analysis of variance of regression equation
2.3.3 两因素交互作用分析 由图6可知,响应曲面的走势陡峭,等高线密集且呈椭圆形。提取剂浓度与提取温度交互作用对叶绿素提取液OD值的影响表现为显著水平。叶绿素提取液OD值随乙酸乙酯体积分数的增大和温度的升高呈先上升后下降的趋势,这可能是因为乙酸乙酯极性较弱,体积分数增大反而减小了提取液的极性,使其更接近于叶绿素的极性,从而增加了叶绿素的溶出效果。但部分叶绿素是以和蛋白质结合的形态存在于植物细胞中,适量水分可使叶绿素亲水基团与蛋白分离,利于从内囊体膜游离出来,水份过高对提取不利[23];同时温度过高也会导致部分叶绿素降解。
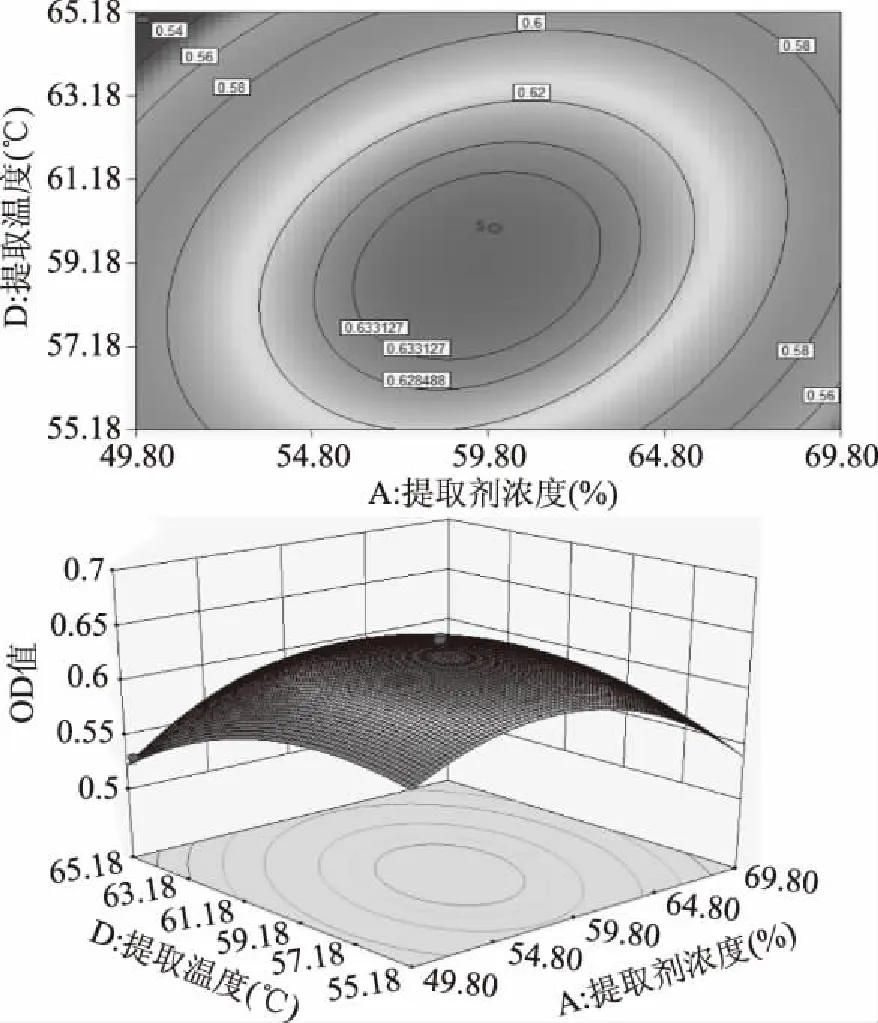
图6 提取温度与提取剂浓度的响应面图及等高线图Fig.6 Response surface map and contour plot of extraction temperature and extractant concentration
图7中,液料比与温度的等高线为椭圆,表明二者交互效应对响应值的影响显著,与方差分析结果一致。叶绿素提取液OD值随液料比的增加呈先增加后降低的趋势。增加液料比可增加传质动力,有助于叶绿素的溶出[24],但当液料比达到一定程度时,已溶出大部分叶绿素,若再增加液料比,则叶绿素提取率增加缓慢,使提取浓度降低,从而导致响应值降低。
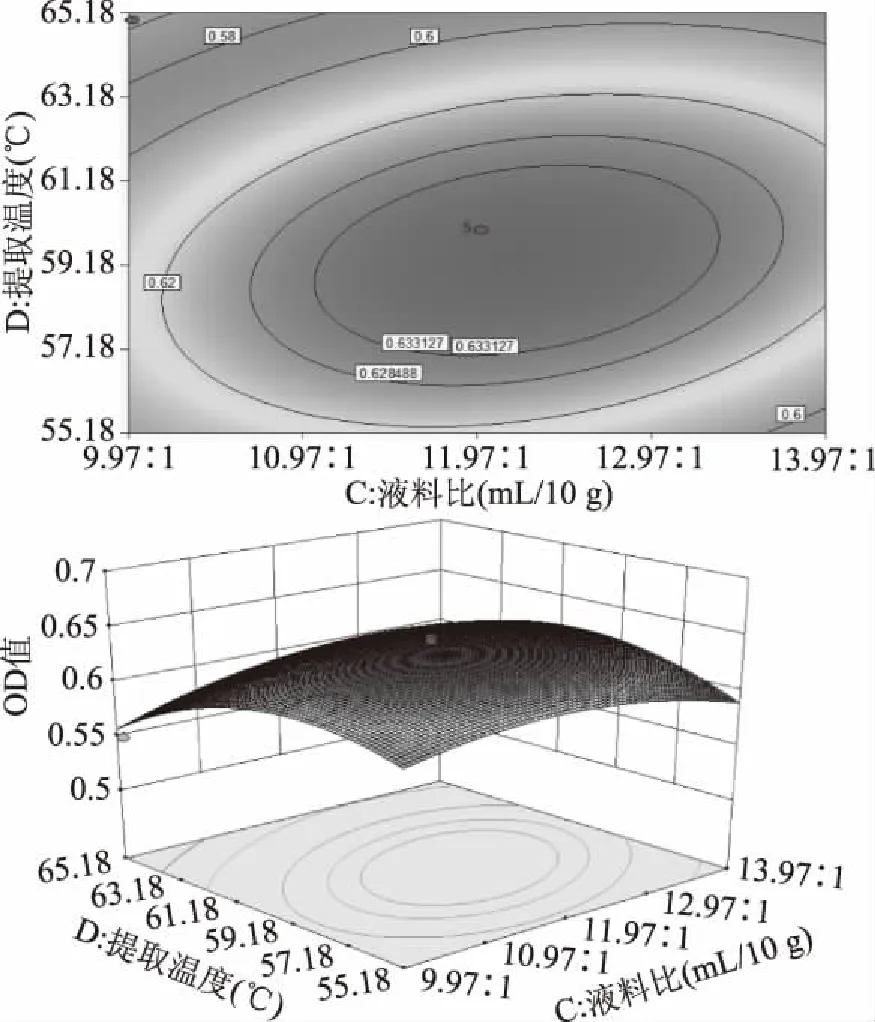
图7 温度与液料比的响应面图及等高线图Fig.7 Response surface diagram and contour plot of temperature to liquid ratio
2.3.4 反应条件的优化与模型验证 通过软件Design Expert 8.0.6分析得出提取绿肉猕猴桃叶绿素的最佳条件为:提取时间3.93 h,乙酸乙酯浓度59.62%,提取温度59.15 ℃,液料比1.218∶1 mL/g。考虑到实际工作的便利,将浸提工艺修正为液料比1.22∶1 mL/g,乙酸乙酯浓度59.6%,提取时间236 min,提取温度59 ℃。采用修正后的工艺参数进行3次平行验证实验,测得叶绿素OD666值为0.636±0.01,与模型预测值0.640相对误差小于5%,此时通过Arnon法测得叶绿素含量为27.73 μg/g,比张丽华等[9]测得“秦美”猕猴桃中叶绿素含量高,证明了采用响应面法优化得到的提取条件参数比较准确,具有使用价值。
3 结论
研究表明,提取剂类型、料液比、提取温度、提取时间和提取剂浓度均对叶绿素提取有不同程度的影响,且本实验中得出猕猴桃叶绿素的最佳提取溶剂为乙酸乙酯。通过Box-Behnken设计,建立了四元二次回归方程,得到猕猴桃叶绿素最佳提取工艺为:液料比1.22∶1 mL/g,乙酸乙酯浓度59.6%,提取时间236 min,提取温度59 ℃,OD666值为0.636,此时通过Arnon法测得叶绿素含量为27.73 μg/g。响应面模型实际值与预测值相对误差小于5%,故该模型能反映绿肉猕猴桃叶绿素提取过程中的内部规律,可较好地预测猕猴桃叶绿素的提取情况,并能为拓宽叶绿素提取原料的来源、进一步提高绿肉猕猴桃资源利用率及绿肉猕猴桃叶绿素工业化生产提供理论参考。
