γ-聚谷氨酸对冷冻面团 和面条的抗冻保护作用
2019-04-12,,,,
,,,,
(华东师范大学生命科学学院,上海 200241)
冷冻面制品是常见的一类速冻食品,其种类繁多,包括冷冻水饺、包子、面条和面包等,由于其便捷性而日益被消费者所喜爱,并在速冻食品行业得到了快速发展。面制品在冻藏过程中,由于温度的波动引起水分的重结晶,从而破坏面筋蛋白的结构,且长时间冻藏导致面团蛋白质组分和结构发生变化,淀粉颗粒分离,出现皱缩、裂纹等现象,最终导致冷冻面制品的品质下降[1-3]。现阶段解决方法主要有对冷冻工艺的优化、添加改良剂如淀粉[4]、蛋白质[5-6]、乳化剂和水体胶[7-9]等。但是如何在保持产品味道和颜色的前提下,选择天然食品添加剂改善冷冻面制品的品质至今仍未得到完全解决。
微生物发酵得到的γ-聚谷氨酸(γ-poly glutamic acid,γ-PGA)由于其良好的吸水性、可生物降解性[10]而得到广泛应用。有文献报导,微生物发酵得到的γ-PGA分子量在6×104Da左右具有一定的抗冻保护作用,进一步研究发现其抗冻活性与其分子量大小呈负相关[11]。γ-PGA通过抑制水溶液中冰晶的生长,减少结构的破坏,从而降低食品的品质恶化,可以改善冷冻食品在低温状态下的品质[12]。而γ-PGA对冷冻面条的抗冻保护效果至今还鲜有报道。
本文旨在研究高、低分子量的γ-PGA对冷冻面团和面条的可冻结水含量、流变特性、面条硬度、咀嚼性等参数以及烹饪吸收的影响,探究γ-PGA对冷冻面制品的抗冻保护作用,为冷冻食品的开发和生产提供参考。
1 材料与方法
1.1 材料与仪器
含γ-PGA发酵原液 华东师范大学生命科学学院微生物实验室提供;高筋小麦粉 克明面业股份有限公司;牛血清白蛋白(bovine serum albumin,BSA) 生工生物工程股份有限公司;6×DNA Loading Buffer 宝日医生物技术有限公司;PGA标品(1.5~5万)、PGA标品(5~10万) Sigma-Aldrich公司;PGA标品(100万左右) 山东福瑞达生物科技有限公司。
Q2000差示扫描量热仪(differential scanning calorimeter,DSC) 美国TA仪器公司;DHR-3 Discovery混合型流变仪 美国TA仪器公司;TA.XT Plus质构仪 英国SMS公司;DMT-5电动家用面条机 龙口市复兴机械有限公司。
1.2 实验方法
1.2.1 高分子量γ-PGA的制备 参考Mitsyik等[11]的实验方法,将含γ-PGA的发酵液加入蒸馏水稀释后,再10000 r/min离心10 min去除菌体,上清液加入3倍体积的无水乙醇,4 ℃沉淀12 h得到γ-PGA,在常温下蒸馏水透析12 h以去除14000 Da小分子的物质,后冷冻干燥以得到未水解的高分子量γ-PGA。
1.2.2 低分子量γ-PGA的制备 上述发酵得到无菌体的上清液在pH为2、温度90 ℃的条件下水解150 min,其余步骤同1.2.1,得到水解后的低分子量γ-PGA。
1.2.3γ-PGA分子量的测定 得到的两种PGA干粉,用蒸馏水制成0.2%的水溶液,用标准的γ-PGA做参照,后用0.8%琼脂糖在120 V下电泳30 min,结束后用亚甲基蓝染色2 h,在室温下蒸馏水脱色12 h后拍照。
1.2.4γ-PGA抗冻活性的测定 将2%高分子量γ-PGA溶液、2%低分子量γ-PGA溶液、2%BSA和纯水(对照)分别装入DSC专用坩埚中,密封。程序设定参照Mitsuiki等[11]的方法,简述如下:取样品10 mg,以5 ℃/min的速度从30 ℃降至-22 ℃,保持10 min,后以3 ℃/min升温至30 ℃。实验重复三次,结果取平均值。抗冻活性(AA)是指降温过程中每克样品能够使溶液中保留的未冻结水的克数,计算公式如下:
式中,w为样品重量占溶液重量的比例;ΔHwater为纯水的热焓值;ΔHPGA为样品溶液的热焓值[13]。
1.2.5 冷冻面团和面条的制备 面团基本配方为:高筋面粉100 g加入50 g蒸馏水,分别加入面粉质量的2%高分子量、0.5%低分子量、2%低分子量的γ-PGA,以不加γ-PGA做对照。揉成均匀的面团,静置10 min,后分成每份10 g。用面条机把面团制成0.2 cm厚、0.5 cm宽、10 cm长的面条。将面团和面条用保鲜膜包覆,在25 ℃培养箱中静置60 min,后在-40 ℃下速冻30 min。然后在-20 ℃分别冷处理0、3、7、14、21 d。
1.2.6 冷冻面团可冻结水含量的测定 冷冻面团在25 ℃下解冻60 min,从面团中心部分取10 mg样品,用DSC进行可冻结水的分析,扫描温度程序设定参照Matuda等[14]的方法,从25 ℃以10 ℃/min降到-90 ℃,保持10 min,然后以5 ℃/min升温至20 ℃,得到面团吸热焓(ΔHdough)。可冻结水含量(freezable water content,Fw)的计算公式[15]如下:
FW(%)=面团冰晶吸热焓(ΔHdough)/[冰晶融化潜热(334 J/g)×面团含水量]
1.2.7 面团流变性能检测 10 g面团样品用模具制成直径2 cm的圆片状,使用旋转流变仪进行变形振荡测量。使用20 mm直径的平板,整个过程使用2 mm的间隔,将样品放在两块平板之间,去除多余部分。25 ℃下在10 rad/s的频率下,应变从0.01%~100%进行扫描,根据得到的储存模量(G′)和损失模量(G″),以确定线性粘弹性范围。然后将样品在25 ℃下放置5 min,在线性粘弹性范围内进行0.01~40 Hz频率扫描。分别计算储能模量(G′)和损耗模量(G″)[16]。
1.2.8 面团质构剖面分析 采用质构剖面分析的模式,将面团解冻后用面条机制成3 cm的厚度,后用模具制成直径3.5 cm的圆片状进行测定,探头型号为P/25,测试前速率1.0 mm/s,测试中速率和测试后速率均为0.8 mm/s,触发力5 g,按压距离6 mm[16]。
1.2.9 面条的烹饪吸收测定 参考Ding等[17]的实验方法,取10 g不同时间冷冻的面条,在250 mL沸水中煮5 min,然后用100 mL蒸馏水洗涤,放在通风橱下吹10 min,称重量。计算烹饪吸收,公式如下:

1.3 数据处理

2 结果与分析
2.1 水解前后γ-PGA分子量变化
对含γ-PGA发酵原液90 ℃下水解150 min,水解前后的样品进行琼脂糖电泳,以确定分子量大小,结果如图1所示。
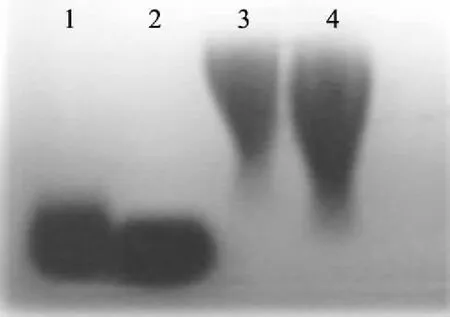
图1 不同水解条件的γ-PGA琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoresis of γ-PGA different hydrolysis conditions注:1:PGA标品(1.5~5万);2:水解后的γ-PGA; 3:未水解γ-PGA;4:100万的高分子量PGA标品。
由图1可知,水解后的γ-PGA的条带位置与PGA标品(1.5~5万)的相近,表明水解后的γ-PGA分子量小于5万,为低分子量的γ-PGA。未水解的γ-PGA的条带位置在已知分子量为100万的γ-PGA条带上方,因此水解前γ-PGA的分子量在100万左右,为高分子量的γ-PGA。本文以上述两种高低分子量的γ-PGA为材料,探究γ-PGA分子量对冷冻面团和面条的抗冻保护效果。
2.2 γ-PGA的吸热焓、可冻结水含量及抗冻活性
对纯水、2% BSA、2%高分子量γ-PGA和2%低分子量γ-PGA用DSC进行温度扫描,检测抗冻活性,所得DSC扫描曲线如图2所示。应用TA Universal Analysis软件对扫描曲线进行分析,得到样品的吸热焓、可冻结水含量和抗冻活性如表1所示。

表1 不同样品的吸热焓、可冻结水含量和抗冻活性Table 1 ΔHm,Fw and AA of different samples
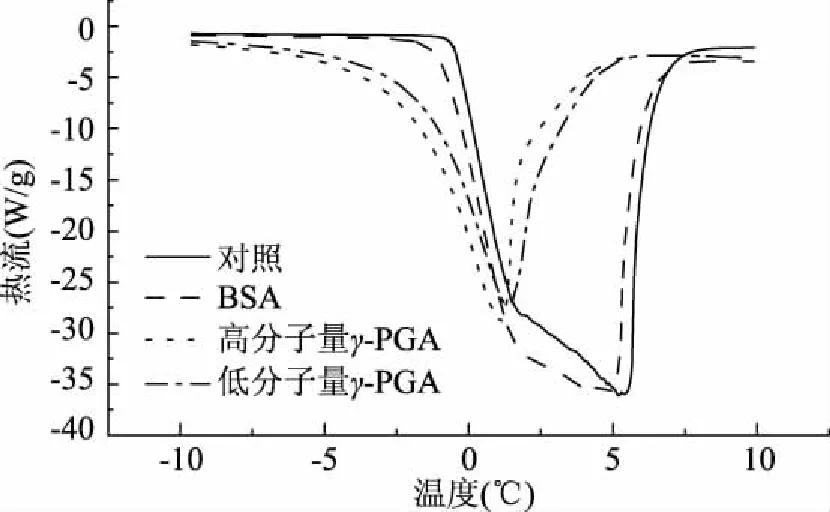
图2 不同样品的DSC曲线Fig.2 DSC curves of different samples
由图1可知,在升温融化过程中,各组样品都出现了较大的吸热峰。由表1可知,纯水的吸热焓为252.2 J/g,2% BSA溶液的吸热焓为248.4 J/g,未水解γ-PGA溶液的吸热焓为211.4 J/g,2%水解γ-PGA溶液的吸热焓为175.7 J/g,γ-PGA的吸热焓明显低于对照和BSA组。从可冻结水含量来说,γ-PGA的Fw值明显低于对照和BSA组,而且水解后γ-PGA的Fw值比未水解的γ-PGA更小。计算后得到的抗冻活性值中未水解和水解γ-PGA也高于BAS。多聚谷氨酸具有较强的水分子吸附能力[11],因此本实验说明γ-PGA具有较好的持水性,易与水分子结合,能够减少游离水的含量而具有良好的抗冻活性。
2.3 γ-PGA对冷冻面团可冻结水含量的影响
面团冷冻储存期间发生的重结晶作用,从而导致的冰晶形成和生长是面团品质恶化的一个非常重要的因素,而可冻结水含量是冻藏过程中面团冰晶数量的一个决定性因素[18]。这里应用DSC来研究冷冻面团中可冻结水的含量。添加不同含量、水解前后的γ-PGA面团在冷冻处理不同时间后可冻结水含量如图3所示。

图3 面团在不同冷处理时间下的可冻结水含量Fig.3 Changes of freezable water content of dough under different freezing treatment time
在冷冻0 d时,各组的可冻结水含量相差不大,均为30%左右。随着冷冻时间的延长,各组的可冻结水含量逐渐增加。冷冻7 d时,对照组可冻结水含量为34.9%,未水解γ-PGA组(2%高分子量γ-PGA)可冻结水含量为32.7%,而加入量0.5%的水解γ-PGA组(0.5%低分子量γ-PGA)可冻结水含量为30.7%。冷冻21 d时,对照组的可冻结水含量达到了40%,未水解γ-PGA组在34%左右,而加入量0.5%和2%的水解γ-PGA的可冻结水含量均为32%。表明长期(21 d)冻藏后,水解后γ-PGA(低分子量γ-PGA)能够极显著(p<0.001)减少冷冻面团中的可冻结水含量。
抗冻活性是基于物质对水分的固定,多聚谷氨酸对水分子具有较强的吸附性能[19],可以明显增加溶液的持水能力。综合以上结果,推测可能是由于γ-PGA限制了自由水在冷冻面团中的迁移,减缓冰晶的生长,使形成的冰晶细小,从而降低了冰晶对活性结构的破坏。如图3所示,冷冻0 d时,各组的可冻结水含量都相差不大,随着冷冻时间延长,各组的Fw都呈现逐渐增大的趋势。
2.4 γ-PGA对不同冷处理时间的冷冻面团储能模量(G′)和损耗模量(G″)的影响
储能模量是材料变形后回弹的指标,表示材料存储弹性变形能量的能力。损耗模量是指材料在发生形变时,由于粘性形变(不可逆)而损耗的能量大小,反映材料粘性大小。通过对不同冷处理时间各组面团的储能模量和损耗模量的测定,来研究冻藏和温度波动对面团中流变学特性的变化,探讨γ-PGA的抗冻保护作用。
2.4.1 确定最适的应变力进行频率扫描 如图4所示,随着应变力的变化,各组的储存模量和损失模量都呈现不断下降的趋势,在应变力变化在0.1%时,各组的模量均没有明显变化,有文献报道[20],在储存模量的下降趋势超过3%的时候,所测样品的结构开始发生变化,由图4可知,在各组的储存模量从起始点下降3%时应变力大约在0.5%左右,故在后续的实验均采用应变力0.5%进行实验。

图4 应变力扫描下面团的储存模量和损失模量图Fig.4 Strain sweeps of G′ and G″ of dough
2.4.2γ-PGA对不同冷处理时间的冷冻面团储能模量的影响 由图5可知,各组的G′值随着冷处理时间的延长而减小,冰晶重结晶作用于面团体系结构中,导致蛋白质网络结构的破坏,使冷冻面团的弹性模量逐渐降低[21-23]。在相同的扫描频率下,低分子量γ-PGA组的G′值明显高于对照组和高分子量γ-PGA组,而且冻藏21 d后,低分子量γ-PGA组的G′值仍保持比对照组高,说明它能长时间有效地减少冰晶对面团中面筋蛋白质网络结构的破坏,并且加入量为0.5%的低分子量γ-PGA相较于2%的高分子量γ-PGA较高,可知低分子量的γ-PGA对面团具有更强的抗冻保护性能。
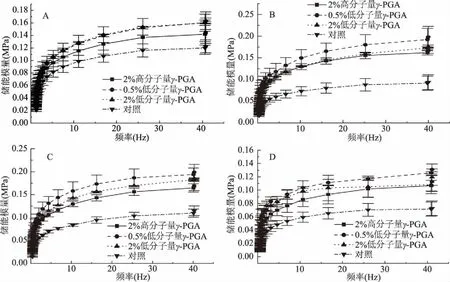
图5 不同冷冻时间面团的储能模量扫描图Fig.5 Frequency sweeps of G′ of dough after different freezing treatment time注:A~D分别冷冻3、7、14、21 d的面团;图6同。
2.4.3γ-PGA对不同冷处理时间的冷冻面团损耗模量的影响 在不同冷冻时间和频率扫描下γ-PGA对冷冻面团损耗模量G″的影响如图6所示,可以看出,随着冷冻时间的延长,冰晶生长形成的压力会导致面筋结构的断裂,造成不可逆的机械损伤,导致各组损耗模量G″整体上呈现下降趋势。从相同的冻藏时间来看,低分子量γ-PGA的G″值比对照组和高分子量γ-PGA组都较高。说明γ-PGA具有良好的吸水性,能够阻碍面团中水分迁移,增强面团持水性,从而增强了面团系统的稳定性[24]。
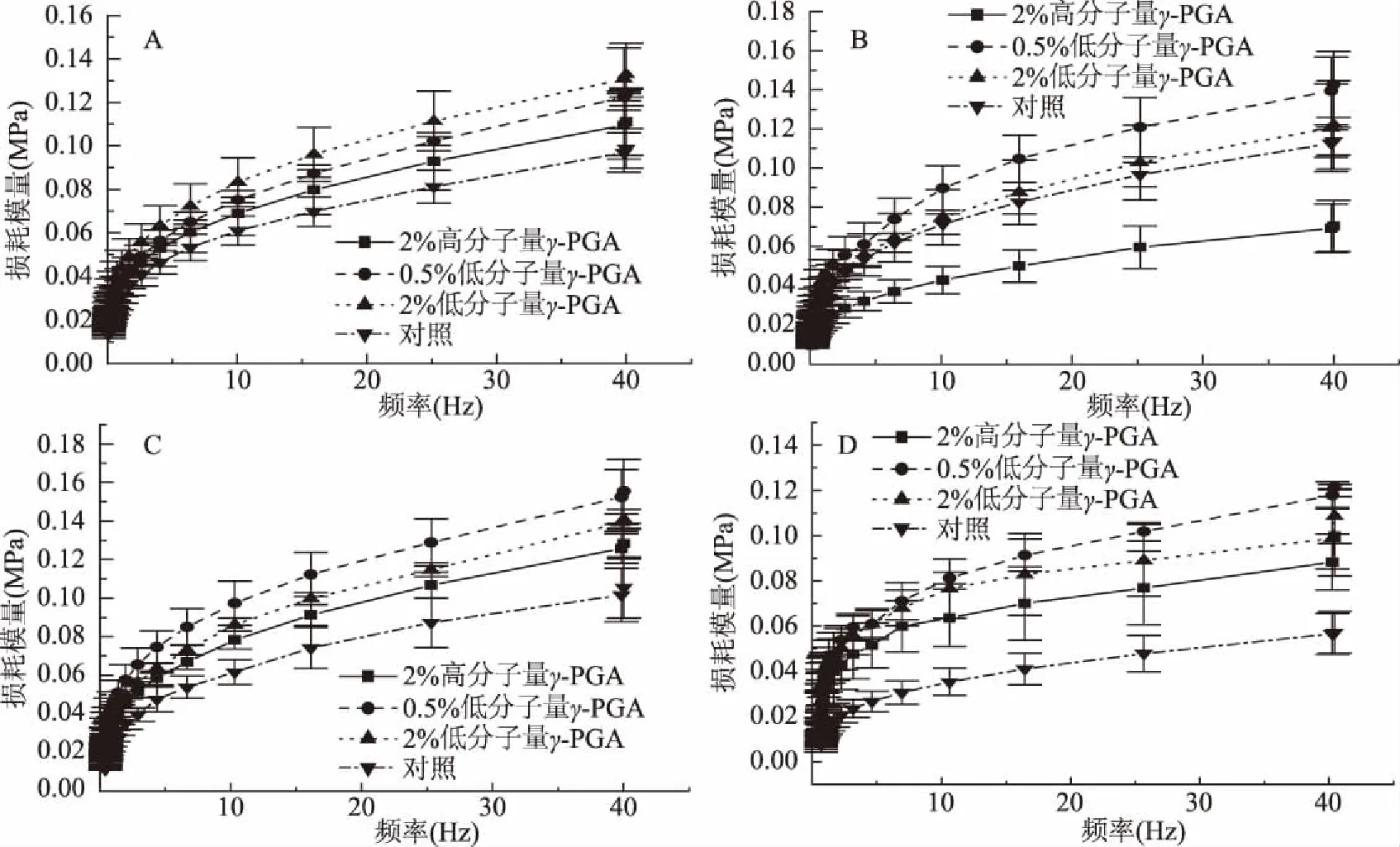
图6 不同冷冻时间面团的耗能模量扫描图Fig.6 Frequency sweeps of G″ of dough after different freezing treatment time
2.5 γ-PGA对冷冻面团质构的影响
对不同冷冻时间面团的硬度、内聚性、胶粘性、弹性、回复性、咀嚼性等指标进行了检测,结果如表2所示。随着冷冻时间的延长,面团内部形成的冰晶量增多,各组的硬度、胶粘性和咀嚼性逐渐增大,面团的质构逐渐变差。从表2可以看出,在相同的冷冻时间内,加入γ-PGA组面团的硬度、胶粘性和咀嚼性都明显低于对照组,且加入2%低分子量γ-PGA的冷冻面团的以上指标均最小。
另外,由于在冷冻储存期间形成的冰晶会破坏面筋网络的完整性[25],因此各组面团的回复性在冷冻储存期间各组均降低。如表2所示,在冷冻21 d时,各组面团的回复性与冷冻3 d相比都有所下降。但在相同的冷处理时间内,加入γ-PGA面团的回复性和内聚性均较高,是因为γ-PGA具有降低可冻结水含量和抑制冰重结晶的能力,从而最大限度地减少冻存对面筋基质的损害[21]。此外,实验数据表明:0.5%和2%的低分子量γ-PGA对冷冻面团质构改善效果没有明显差异,表明γ-PGA分子量是影响抗冻活性的主要因素。
2.6 γ-PGA对不同冷处理时间的冷冻面条烹饪吸收的影响
面条的烹饪吸收受淀粉颗粒吸水量的影响,主要取决于面筋基质结合水的能力[17,26]。面条的结构越完整[27],它在烹煮后吸收的水量就越多。研究了不同分子量的γ-PGA对冷冻面团烹饪吸收的影响,结果如图7所示。

图7 面条在不同冷处理时间下的烹饪吸收Fig.7 Changes of water absorption of noodles after different freezing treatment time
冷冻处理3 d后,随着冷冻处理时间的延长,各组面条的烹饪吸收量逐渐降低。冷冻处理21 d时,对照组面条的烹饪吸收为41.8%,高分子量γ-PGA组为49.3%,而0.5%和2%的低分子量γ-PGA组的面条烹饪吸收分别为58.2%和54%。表明低分子γ-量PGA的具有更强的冰重结晶抑制活性。由于γ-PGA的分子链上有大量的羧基,能够与淀粉颗粒表面上的活性基团结合,在分子内和分子间形成大量的氢键与淀粉颗粒发生相互交联,增大了淀粉的热稳定性。另外,γ-PGA的多羟基基团与淀粉竞争结合自由水,使淀粉可结合的自由水减少,进而减缓冰晶的生长,降低了冰晶对面筋网络结构的破坏,从而增加面制品的耐储藏性。
3 结论
本文探究了高、低分子量的γ-PGA的对冷冻面团及面条的抗冻保护作用。结果表明,γ-PGA具有较强的抗冻活性,将其应用于冷冻面团中,能够减少面团中的可冻结含水量,提高冷冻面团的存储弹性变形能量的能力。γ-PGA能够提高面条的烹饪吸收水平。此外,与高分量的γ-PGA相比,低分子的γ-PGA的具有更强的抗冻保护活性,而且0.5%与2%的添加量对冷冻面条和面团改善效果相差不大,表明在一定的添加范围内,低分子量的γ-PGA对冷冻面制品具有良好的抗冻保护作用。
