苏尼特羊脂肪组织中 脂肪酸沉积机制的研究
2019-04-12,,,,,,
, , ,, , ,
(内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特 010018)
脂肪组织是机体重要的能量代谢器官,分为白色脂肪和棕色脂肪,白色脂肪主要用来储存能量,棕色脂肪则可直接消耗能量产热[1]。皮下脂肪、内脏脂肪和尾部脂肪都属于白色脂肪组织。脂肪组织还可以分泌激素和细胞因子,参与调控机体的生理与病理,包括Ⅱ型糖尿病、肥胖等[2-3]。同时,羊肉特有的膻味还与脂肪组织有关,脂肪中与膻味有关的化合物会在加热过程中释放,产生使人感觉到不愉快的气味[4]。苏尼特羊为内蒙古独特的优良羊种,其蛋白质含量高,富含人体所需的各种氨基酸和脂肪酸,具有较高的营养价值且膻味轻。
目前在肉用家畜研究领域,选择性脂肪沉积是一个较新的思路。在家畜生产过程中,选择性的脂肪沉积可以改善肉品质量,包括多汁性,嫩度,风味等。影响脂肪沉积的因素包括遗传、饲养以及环境等。通过脂肪沉积调控可提高肌肉中脂肪含量,改善肉质。不同脂肪组织间,细胞代谢和遗传机制存在差异。比如猪内脏脂肪细胞增殖速度比其他脂肪细胞慢[5]。LPL和激素敏感性酯酶(HSL)可调控脂肪组织分解产生脂肪酸。有研究发现,猪皮下脂肪组织中LPL基因高表达能够显著增加脂肪酸沉积[6]。SCD是催化饱和脂肪酸合成单不饱和脂肪酸的关键酶,可影响脂肪组织中脂肪酸的构成[7-9]。目前脂肪沉积机制在猪和牛中研究较多,而羊中脂肪部位脂肪酸沉积顺序相关研究较少。
本研究以苏尼特羊不同脂肪组织为实验材料,分析不同脂肪组织中脂肪酸和脂肪代谢相关基因表达的差异性,旨在得到苏尼特羊脂肪沉积规律和脂肪沉积调控机制,提高脂肪的利用率,同时对提高苏尼特羊这一内蒙古特色肉羊品种的保护和利用具有实际意义。
1 材料与方法
1.1 材料与仪器
苏尼特羊 12月龄,共12只,公母各6只,内蒙古乌拉特中旗牧区;三氯甲烷(分析纯)、正己烷(色谱纯)、三氟化硼-乙醚络合物(分析纯)、氯化钠(分析纯)、氢氧化钠(分析纯)、无水硫酸钠(分析纯) 国药集团化学试剂有限公司;37种脂肪酸甲酯的混标 Sigma公司;RNAiso Plus、6×loading buffer、Marker DL2000、Premix Taq® Version2.0、PremeScriPtTMRT reagent Kit with gDNA Eraser、SYBR® Premix Ex TaqTM大连宝生物工程有限公司。
Trace 1300气相色谱质谱联用仪 赛默飞世尔科技公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂;CFX96TMReal-TimePCR仪 美国Bio-rad;普通PCR仪 美国APPlied Biosystems(AB);5810R低温离心机 Eppendorf生物公司。
1.2 实验方法
1.2.1 样品采集 屠宰后,取皮下脂肪,尾部脂肪和肾脏脂肪20 g于-20 ℃保藏,用于脂肪酸分析。采集相同的脂肪组织2 g于2 mL无菌无酶冻存管中,液氮保存,置于-80 ℃冰箱保藏,用于基因表达量分析。
1.2.2 脂肪组织中脂肪酸的测定
1.2.2.1 脂肪酸的提取 根据Folch等[10]的方法进一步调整:称取1 g已均质脂肪组织加入氯仿-甲醇混合液(2∶1)振摇2 h,浸泡8 h后用G3漏斗过滤,滤液中加入5 mL 20%氯化钠溶液,静止分层,下层的氯仿层即为脂肪提取液。通过无水硫酸钠脱水后,40 ℃旋转蒸发浓缩得到脂肪。然后加入0.5 mol/L的氢氧化钠甲醇溶液5 mL,70 ℃下回流5 min,进行脂肪皂化,随后加入5 mL的三氟化硼乙醚溶液,70 ℃下回流2 min,进行脂肪甲酯化。最后加入2 mL色谱纯正己烷,70 ℃下回流1 min后,加入5 mL饱和NaCl溶液,静置10 min,吸取出1 mL正己烷层于进样瓶中,用0.22 μm有机滤膜过滤后,进行气相色谱分析。
1.2.2.2 气相色谱条件 气相色谱条件:色谱柱:反式色谱柱(100 m×0.25 mm×0.20 μm),载气为氦气,载气流速为1 mL/min,进样口温度:240 ℃,进样量为1 μL,分流比为100∶1。采用程序升温,初始温度为60 ℃,保持1 min,然后以20 ℃/min的速度升至120 ℃,保持1 min;然后以5 ℃/min的速度升至240 ℃,保持15 min。
MS条件:离子源温度为300 ℃,传输线温度240 ℃,质量扫描范围50~500 (m/z),溶剂延迟时间:4 min。
样品中脂肪酸根据37种脂肪酸混标来定性,再通过国标(GB/T 9695.2-2008)中定量的方法计算样品中各脂肪酸的含量。
1.2.3 脂肪代谢基因表达量的测定
1.2.3.1 RNA提取与反转录 RNA的提取参照miRNeasy Mini Kit(50)试剂盒说明书进行,进一步用微量紫外分光光度计测定其吸光度(A260 nm/A280 nm)及浓度,并通过1.5%琼脂糖凝胶电泳检测RNA的质量;将RNA 样品稀释为统一浓度500 ng/μL。使用TaKaRa公司的反转录试剂盒(PrimerScript TM RT reagent Kit with gDNA Eraser)两步法将RNA样品反转录为cDNA,在-20 ℃冰箱内保存待用。
1.2.3.2 引物设计 基因引物序列由华大基因设计并合成,β-actin作为管家基因。序列如表1所示。

表1 实时定量引物Table 1 Primers of real-time PCR
1.2.3.3 实时定量PCR 参照TaKaRa SYBR® Premix Ex TaqTMII试剂盒进行实时定量PCR扩增。实时定量PCR 反应体系和扩增反应条件见文献[11]。
1.3 数据处理
实时定量PCR数据分析采用2-ΔΔCt法,数据用SPSS 19.0统计软件单因素方差分析(ANOVA LSD),Duncan多重比较和双变量相关分析。
2 结果与分析
2.1 不同脂肪组织中饱和脂肪酸差异性分析
由表2所示,苏尼特羊脂肪组织中饱和脂肪酸主要以肉豆蔻酸、棕榈酸和硬脂酸为主,约占总脂肪酸的51.9%~62.7%。皮脂中辛酸、癸酸和月桂酸的含量显著高于尾脂和肾脂(p<0.05),这与刚虎军等[12]对南疆多浪羊的结果一致。不同脂肪组织中,肉豆蔻酸的含量差异显著(p<0.05),皮脂最高,尾脂最低。肾脂中硬脂酸的含量显著高于尾脂(p<0.05),且硬脂酸与羊肉膻味有关,特别是当皮脂中硬脂酸含量高时会造成羊肉膻味的加重。李维红等[13]也表明尾部脂肪中硬脂酸最少,膻味最小。
对于反刍动物来说,部分中长链饱和脂肪酸产生可能是瘤胃微生物中一些具有氢化作用的细菌可以将大部分多不饱和脂肪酸(多为12碳以上)氢化所致,并沉积于脂肪组织中,成为脂肪组织的主要成分,并对畜肉产品的风味产生重要影响[14-15]。
2.2 不同脂肪组织中不饱和脂肪酸差异性分析
由表3可知,苏尼特羊脂肪组织中单不饱和脂肪酸主要以棕榈油酸和油酸为主,约占总脂肪酸的27.3%~41.7%。不同脂肪组织中,皮脂中棕榈油酸含量显著高于尾脂和肾脂(p<0.05);尾脂中油酸含量显著高于皮脂和肾脂(p<0.05),这一结果与双金等[16]的研究一致。
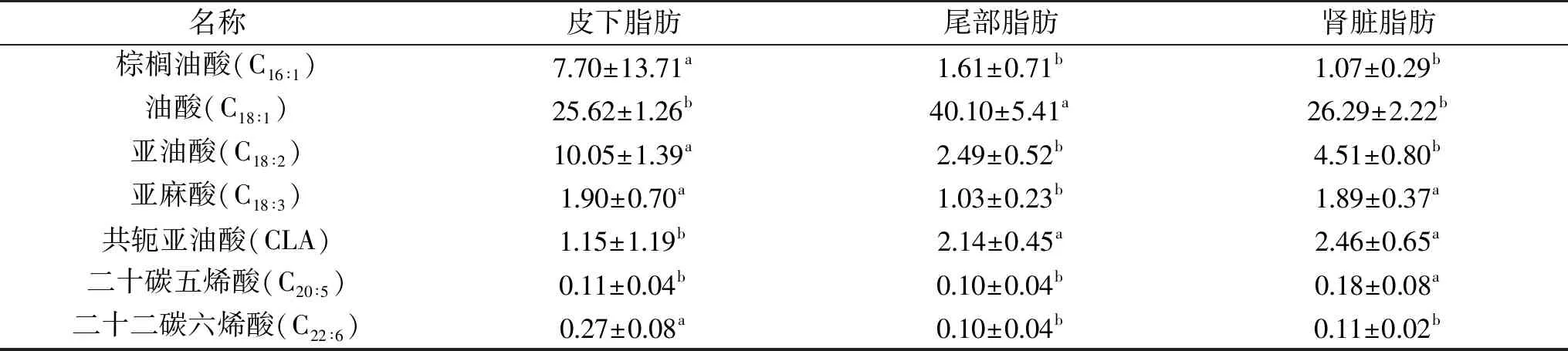
表3 苏尼特羊不同脂肪组织中不饱和脂肪酸的差异分析(g/100 g)Table 3 Variation analysis of the contents of unsaturated fatty acid in different adipose tissue of Sunit sheep(g/100 g)
苏尼特羊脂肪组织中多不饱和脂肪酸主要以亚油酸和亚麻酸为主,约占总脂肪酸的5.6%~13.1%。皮脂的亚油酸的含量显著高于尾脂和肾脂(p<0.05),这与孟影[17]的研究结果不一致;亚麻酸的含量显著高于尾脂(p<0.05)。亚油酸和亚麻酸作为风味前体物可氧化还原生成醛、酮类物质,对羊肉风味的形成起重要作用,比如己醛主要来源于亚油酸的自氧化[18]。但皮脂的共轭亚油酸的含量显著低于尾脂和肾脂(p<0.05)。研究表明共轭亚油酸和亚麻酸具有抗动脉粥样硬化,抗肿瘤等重要生理作用[19]。EPA和DHA属于n-3系脂肪酸,肾脂中EPA的含量显著高于皮脂和尾脂(p<0.05),但皮脂中DHA的含量显著高于尾脂(p<0.05)。
2.3 苏尼特羊脂肪组织中总脂肪酸差异性比较
由表4可知,苏尼特羊脂肪组织中脂肪酸主要以饱和脂肪酸和单不饱和脂肪酸为主,约占88.1%~93.5%。肾脂和皮脂中饱和脂肪酸和多不饱和脂肪酸显著大于尾脂(p<0.05),但单不饱和脂肪酸含量显著小于尾脂(p<0.05),这可能是由于脂肪酸来源部位特异性所致[20]。Alves等[21]研究发现绵羊脂肪组织中脂肪酸的组成以油酸、棕榈酸和硬脂酸为主,占总脂肪酸的66.6%,并参与到甘油三酯的合成。Sebastien等[22]研究发现羔羊脂肪组织饱和脂肪酸和单不饱和脂肪含量占总脂肪酸的87%,本试验与以上研究结果较一致。

表4 苏尼特羊不同脂肪组织中总脂肪酸的差异分析(g/100 g)Table 4 Variation analysis of the contents of fatty acid in different adipose tissue of Sunit sheep(g/100 g)
2.4 不同脂肪组织中脂肪代谢基因表达量差异性分析
动物脂肪中脂肪酸沉积主要来源于脂肪酸的从头合成反应,而脂肪酸合成需要FASN催化乙酰辅酶A和丙二单酰辅酶A来完成,通过调控FASN的表达调控可以用来调控动物脂肪沉积[23]。由表5可知,肾脂中FASN基因表达量显著高于皮脂和尾脂(p<0.05),这表明肾脏脂肪沉积优于皮脂和尾脂沉积。脂肪组织在不同部位沉积的数量存在着差异,可能是调控不同部位脂肪组织的FASN基因在序列的启动时间和空间上存在着差异所致[23]。
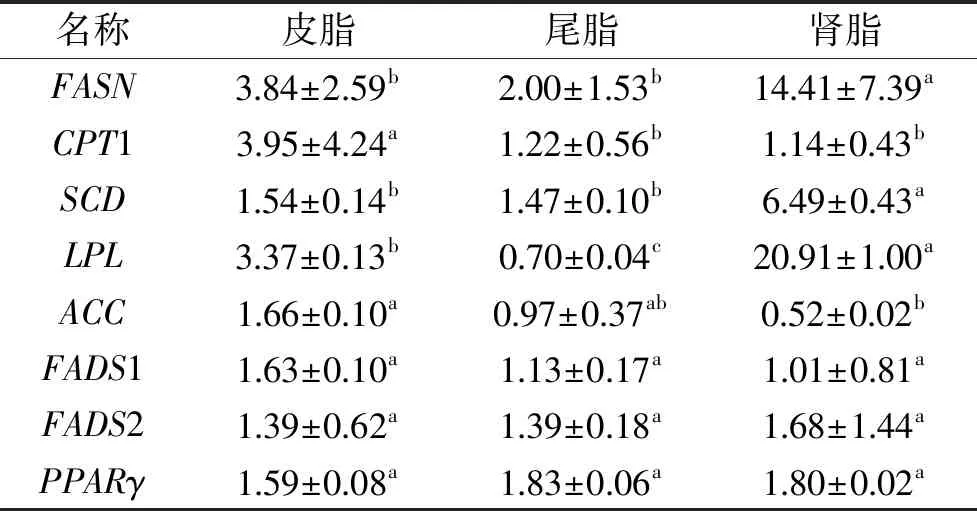
表5 苏尼特羊不同脂肪组织中 脂肪代谢基因表达量的差异性分析Table 5 Analyze differentially of the gene expression of fat metabolismin different adipose tissue of Sunit sheep
LPL能够将血液中乳糜微粒和极低密度脂蛋白所携带的甘油三酯分解成甘油和脂肪酸,向有关组织提供合成甘油三酯所需的原料,对脂肪沉积起着重要的调控作用[24]。由表5可知,不同脂肪组织间LPL基因表达量差异显著(p<0.05),肾脂最高,尾脂最低。Castro等[25]研究发现,LPL基因表达量在不同脂肪组织中存在差异且在脂肪组织中基因表达量高于肌内脂肪并在肾脂中最高,这与本研究结果一致。
ACC是催化动物脂肪合成的限速酶,也是长链脂肪酸合成时的限速酶[26]。由表5可知,皮脂中ACC基因表达量显著高于肾脂(p<0.05)。CPT1作为机体脂肪酸β氧化,转运长链脂肪酸进入线粒体的限速酶,主要依赖丙二酰辅酶A进行调节[27]。皮脂中CPT1基因表达量显著高于尾脂和肾脂(p<0.05)。
由表5可知,肾脂中SCD基因表达量显著高于其他两个部位(p<0.05),而不同脂肪组织间氧化物酶体增殖物激活受体(PPARγ)和脂肪酸脱氢酶(FADS1,FADS2)基因表达量差异不显著(p>0.05)。
总体上,本研究中皮脂中ACC和CPT1基因表达高于肾脂和尾脂,可表明无论脂肪沉积还是脂肪氧化供能都从皮脂开始,进一步说明皮脂可作为羊胴体肥瘦的衡量指标。
2.5 苏尼特羊脂肪组织中脂肪代谢基因间相关性分析
由表6可知,LPL与脂肪酸合成代谢过程中的酶类(FASN、SCD、FADS1和FADS2)呈显著正相关(p<0.05)。LPL作为机体脂质和脂蛋白代谢的关键酶,在脂肪组织中分解产生脂肪酸,通过转运蛋白进入细胞膜被机体吸收。从某种意义上来说,LPL基因的高表达有利于脂肪酸合成过程的进行。FADS1和FADS2间呈极显著正相关(p<0.001),这表明FADS1和FADS2有协同促进的作用,与梅秀丽等[28]的研究一致。FASN酶与脂肪酸脱氢酶(FADS1、FADS2)呈显著正相关,这表明FASN与FADS1、FADS2共同参与脂肪酸的合成。由表6可知,脂肪组织中PPARγ与脂肪代谢相关基因成负相关,说明氧化物酶体增殖物激活受体(PPARγ)参与调控许多启动脂肪合成和沉积基因的表达,从而导致脂肪细胞的分化和脂肪的生成[29]。
2.6 苏尼特羊脂肪组织中脂肪代谢基因与脂肪酸相关性分析
由表7可知,FADS1与共轭亚油酸呈显著正相关(p<0.05),与C20∶5间呈极显著正相关(p<0.01);FADS2与C18∶2,C18∶3和C20∶5之间呈显著正相关(p<0.05);SCD与共轭亚油酸呈显著正相关(p<0.05);LPL与亚麻酸,共轭亚油酸和C20∶5间呈显著正相关(p<0.05)。脂肪酸脱氢酶(FADS1、FADS2)是多不饱和脂肪酸合成过程的关键酶和限速酶,其酶活性直接影响多不饱和脂肪酸的合成[30]。本实验研究表明FADS1和FADS2可能参与C20∶5的合成,这与之前的研究结果一致[31]。
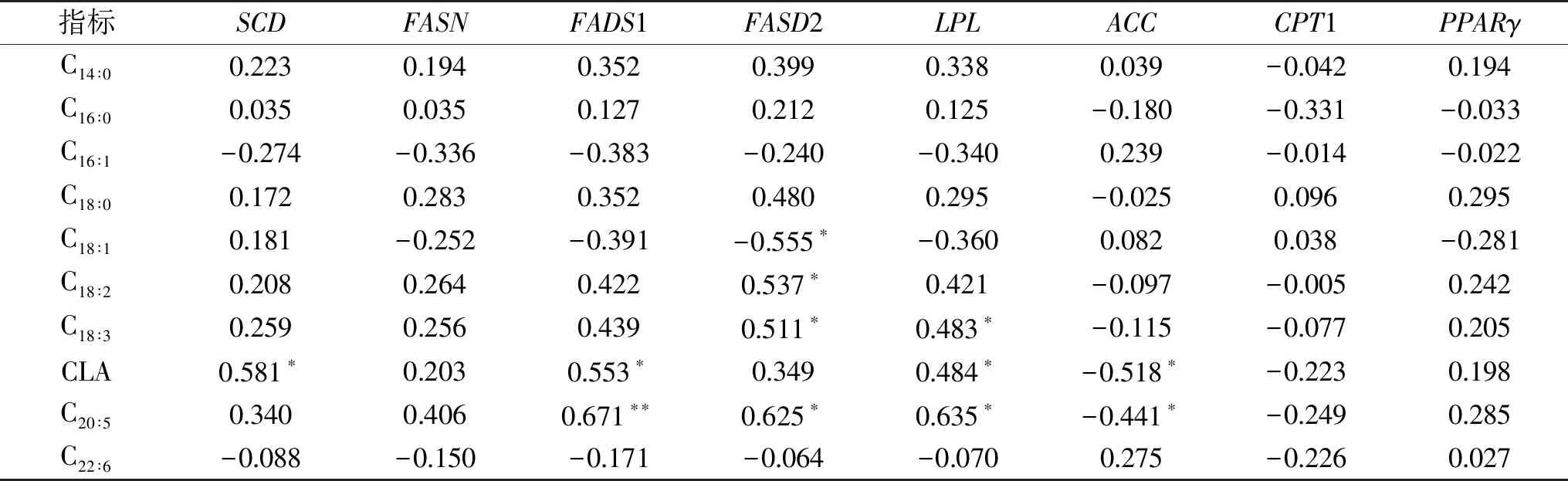
表7 苏尼特羊脂肪组织中脂肪代谢基因与脂肪酸相关性分析Table 7 Analyze correlation between fat metabolism gene and fatty acid in adipose tissue of Sunit sheep
SCD为参与单不饱和脂肪酸的生物合成关键酶[32],且脂肪组织中油酸的含量较高,推测SCD对油酸的合成有一定的促进作用。Madhu等[33]还研究表明SCD在共轭亚油酸的合成过程中起重要作用,实验结果进一步说明SCD基因的高表达有利于共轭亚油酸的合成(r=0.581,p=0.032)。
LPL是脂肪分解的关键酶,这些酶通过调控体内甘油三酯的水解,来降低体脂合成和沉积,本试验结果表明,当LPL基因表达量高时会增加脂肪组织中多不饱和脂肪酸含量。FADS2与C18∶1间呈显著负相关(p<0.05)。
ACC与共轭亚油酸和C20∶5间呈显著负相关(p<0.05)。脂肪组织中FADS2基因表达量高时会抑制C18∶1的生成,而ACC是脂肪酸合成的限速酶,可能会抑制多不饱和脂肪酸(共轭亚油酸、C20∶5)的生成。
3 结论
苏尼特羊脂肪组织中脂肪酸的组成主要以硬脂酸,棕榈酸和油酸为主;肾脂中硬脂酸C18∶0的含量显著高于尾脂(p<0.05);尾脂中C18∶1含量显著高于皮脂和肾脂(p<0.05)。不同脂肪组织间脂肪代谢相关基因表达量差异性分析发现,肾脂中SCD、LPL和FASN基因表达量显著高于皮脂和尾脂(p<0.05);皮脂中CPT1和ACC基因表达量显著高于肾脂(p<0.05)。分析不同脂肪组织中脂肪酸和脂肪代谢基因表达的差异,可推测出调控脂肪代谢基因表达可能是改善脂肪沉积的一个途径。
脂肪酸与脂肪代谢基因表达量相关性分析发现,CLA与FADS1、LPL和SCD呈显著正相关(p<0.05);C20∶5与FADS1和LPL间呈显著正相关(p<0.05),与ACC呈显著负相关(p<0.05)。因此,上调FADS1和LPL基因的表达,有利于CLA和C20∶5的沉积;而下调FADS2和ACC基因的表达,有利于C18∶1和C20∶5的沉积。
