新疆酿酒葡萄表皮醋酸菌的分离鉴定及产酸条件优化
2019-04-11,,,,*
,,,,*
(1.石河子大学 食品学院,新疆 石河子 832000;2.石河子大学信息科学与技术学院,新疆 石河子 832000)
新疆地大物博,气候独特,瓜果品种多、种植面积大、糖度极高、品质优良,但由于加工和销路的问题,每年产生大量的废渣和残次果,造成严重的经济损失。果醋是一种以果蔬或其下脚料为主要原料,通过酒精发酵和醋酸发酵而成的具有多种营养成分和保健功能的液态食品[1,2]。因此,发展新疆特色果醋能够快速、有效地解决新疆果品加工废渣及残次果经济损失的问题。
醋酸菌种是决定果醋产量和质量的主要因素之一。目前,果醋酿造的优良菌株分为醋酸杆菌属(Acetobacter)和葡糖杆菌属(Gluconobacter)2个属。常用的酿造用醋酸菌还有奥尔兰醋杆菌(A.orleanense)、许氏醋杆菌(A.schuegenbachii)、产醋醋酸杆菌(A.acetigenum)、弯曲醋杆菌(A.curvum)、纹膜醋杆菌(A.aceti)、恶臭醋酸杆菌(A.rancens)、攀膜醋杆菌(A.ascendans)、胶膜醋杆菌(A.xylinum)等[3,4]。本文以新疆酿酒葡萄为原料,筛选高产酸醋酸菌,为新疆特色果醋业的发展以及果蔬加工产业链的延伸奠定了一定基础。
1 材料与方法
1.1 材料
1.1.1 采样
从新疆石河子142团采集10例赤霞珠酿酒葡萄。
1.1.2 主要试剂与仪器
葡萄糖、酵母浸粉、琼脂粉、蛋白胨、氢氧化钠、丙三醇、酵母膏、DNA Marker和ddH2O:购自北京奥博星生物技术有限责任公司;碳酸钙、无水乙醇、Easy Taq Supermix:购自天津市致远化学试剂有限公司;Gold View、DNA Kit:购自北京全式金生物技术有限公司,以上试剂均为分析纯。
5810R高速冷冻离心机 德国Eppendorf仪器公司;TC-512PCR扩增仪 英国Techne公司;Power Pac Universal电泳仪、Gel DOC XR凝胶成像系统 美国BioRad公司;CX21FS1光学显微镜 Olympus 公司;LAC-5040S全自动高压灭菌锅 浙江新丰医疗器械有限公司;SW-CJ超净工作台 苏州安泰空气技术有限公司;GNP-9272智能生化培养箱 上海精宏试验设备有限公司。
1.1.3 培养基
筛选培养基:葡萄糖(1%)、酵母膏(1%)、碳酸钙(2%)、无水乙醇(3%)、自然pH,121 ℃高压灭菌20 min,冷却至60 ℃以下再加入无水乙醇[5]。
发酵培养基(GYPE):葡萄糖(0.1%)、蛋白胨(0.2%)、酵母膏(0.5%)、无水乙醇(6%)、121 ℃高压灭菌20 min,冷却至60 ℃以下再加入无水乙醇[6]。
1.2 方法
1.2.1 样品处理
称取20 g葡萄样品,在无菌条件下,将其加入到装有50 mL无菌水的三角瓶中,并放置三角瓶于摇床中,在30 ℃、120 r/min条件下,培养12 h,得菌悬液。
1.2.2 菌株的分离纯化
采用梯度稀释平板涂布法对葡萄样品进行分离,在30 ℃恒温条件下培养48 h。经连续划线培养2~3次后,参考《伯杰细菌鉴定手册》[7],与张纪中的《微生物分类学》进行比对。根据菌落的形态、大小、颜色进行初步分类鉴定,革兰氏染色,将革兰氏染色阴性菌(显微镜下为红色)纯培养物经液体培养基富集之后按600 μL甘油和水混合液(1∶1),将400 μL液体培养物移入1.5 mL离心管中,保藏5份至-20 ℃冰箱中,并做好标记。
1.2.3 醋酸菌的16S rDNA分析及系统发育分析
菌体DNA的提取:试验DNA的提取采用Easy Pure Bacteria Genomic DNA Kit试剂盒,根据试剂盒提供药品和说明书步骤进行DNA的提取。
PCR扩增[8]:
上游引物:27F-5′-AGA GTT TGA TCC TGG CTC AG-3′;
下游引物:1492R-5′-GGT TAC CTT GTT ACG ACT T-3′。
扩增体系:总体积为50 μL,其中包括2 μL的模板DNA,2 μL的上游引物,2 μL的下游引物,25 μL的Easy Taq Supermix,19 μL的ddH2O,并做空白对照。
扩增程序[9]:94 ℃预变性5 min,进行30个循环,每个循环为94 ℃变性45 s,53 ℃退火45 s,72 ℃延伸1 min,然后再延伸10 min。PCR扩增产物经1.0%琼脂糖凝胶电泳检测[10],并置于-20 ℃保藏以备后续试验所用。
将符合标准的16S rDNA扩增产物进行测序。测序结果在NCBI(National Center for Biotechnology Information)BLAST中进行同源序列比对,根据比对的结果,下载相似性在99%以上菌种的16S rDNA序列,连同测序菌株的序列用Claustal X1.83软件进行多序列比对,结果采用MEGA 6.0软件中的邻近法(Neighbor-Joining)进行系统发育树的构建,并用Bootstrap对进化树进行1000次置信度分析[11]。
1.2.4 总酸的测定
取-20 ℃下保存的菌种在液体培养基中活化,加入5%的活化菌液于50 mL液体培养基的250 mL三角瓶中,置于摇床于30 ℃,170 r/min进行培养,待测总酸。
24 h测1次样品相关的数据,对样品摇匀后在无菌操作台中进行,并且用空白培养基作为空白对照,用碱式滴定法测量菌种产酸量,用移液枪吸取2 mL至三角瓶中进行滴定,然后用下式计算出总酸[12]:
产酸量(g/L)=V/V0×CNaOH×60/L。
式中:V为发酵液样品滴定耗用的NaOH的体积数,mL;V0为以空白培养基为对照滴定耗用的NaOH的体积数,mL;CNaOH为NaOH溶液的浓度,mol/L;L为样品的体积数,mL;60为醋酸的分子量。
1.2.5 高产酸菌株的筛选
接种5%的液体培养物于发酵培养基中进行7天发酵实验,每天测其总酸,比较产酸量及产酸能力,筛选出产酸最高的菌株。
1.2.6 培养基优化单因素试验[13]
1.2.6.1 不同浓度无水乙醇对高产菌株产酸能力的影响
活化产酸最高的菌株,按照5%的接种量分别接种于2%,4%,6%,8%,10%乙醇的GYPE培养基中,将其置于30 ℃摇床中发酵24 h,每组3个平行,并做空白对照。
1.2.6.2 不同浓度葡萄糖对高产菌株产酸能力的影响
活化产酸最高的菌株,按照5%的接种量分别接种于0.5%,1%,1.5%,2%,2.5%葡萄糖的GYPE培养基中,将其置于30 ℃摇床中发酵24 h,每组3个平行,并做空白对照。
1.2.6.3 不同浓度酵母膏对高产菌株产酸能力的影响
活化产酸最高的菌株,按照5%的接种量分别接种于0.5%,1%,1.5%,2%,2.5%酵母膏的GYPE培养基中,将其置于30 ℃摇床中发酵24 h,每组3个平行,并做空白对照。
1.2.7 正交试验设计
根据单因素试验的结果,先对微生物生长有重要影响的碳源和氮源,即葡萄糖、酵母膏、无水乙醇的用量,按照L9(33)正交表进行正交试验设计[14],各因素水平见表1。
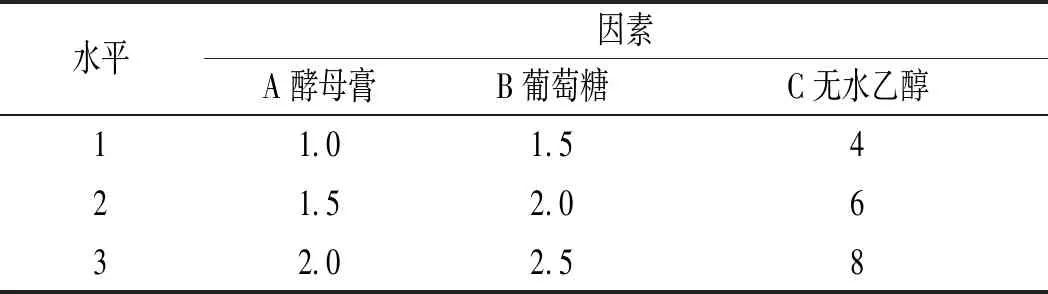
表1 产酸条件优化正交试验因素与水平Table 1 Optimization of orthogonal test factors and levels of acid-producing conditions %
1.2.8 数据处理与分析
采用Origin 8.0数据分析软件进行单因素分析,用SPSS数据分析软件进行正交分析。
2 结果与分析
2.1 醋酸菌的分离
通过初步分离纯化,共筛选得到15株醋酸菌,通过菌落形态和革兰氏染色显微形态比较,将筛选出的醋酸菌初步分为5类,菌落形态特征与显微形态特征见表2和图1。

表2 培养基上醋酸菌的形态特征Table 2 Morphological characteristics of lactic acid bacteria on culture medium

图1 醋酸菌革兰氏染色图Fig.1 Gram staining of acetic acid bacteria
2.2 16S rDNA扩增产物电泳检测结果
选取每种表型中生长活性最好的菌株作为代表菌株,分别标号为K-1、K-2、K-3、K-4、K-5并提取其DNA。将提取的5株醋酸菌的DNA进行PCR扩增后,进行琼脂糖凝胶电泳检测,在1500 bp左右出现了特异性扩增条带,且条带较为明亮,PCR扩增结果符合测序标准。电泳检测结果见图2。

图2 16S rDNA扩增产物电泳检测图Fig.2 The electrophoresis detection map of 16S rDNA amplification products
2.3 醋酸菌株的系统发育分析

图3 醋酸菌16S rDNA系统发育树Fig.3 16S rDNA phylogenetic tree of lactic acid bacteria
由图3可知,K-1、K-2、K-3与AcetobacterperoxydansJMC 25077同源性强,属于Acetobacterperoxydans(过氧化醋杆菌),K-4与AcetobacteroeniLMG 21952同源性强,属于Acetobacteroeni(葡萄酒醋酸杆菌),K-5与GluconobacteralbidusNBRC 3250同源性强,属于Gluconobacteralbidus(白葡糖杆菌)。
2.4 高产酸醋酸菌种的筛选

图4 不同菌株产酸量的比较Fig.4 Comparison of acid production of different strains
由图4可知,在发酵至第5天时不同菌株的产酸量都呈快速上升趋势;发酵5天之后,产酸量呈缓慢上升趋势;当发酵至第7 天时,K-4菌株的产酸量最高,达到了4.2 g/dL。因此,选取K-4菌株作为后期产酸条件优化的供试菌株。
2.5 产酸条件的优化
2.5.1 不同浓度无水乙醇对K-4菌株产酸能力的影响
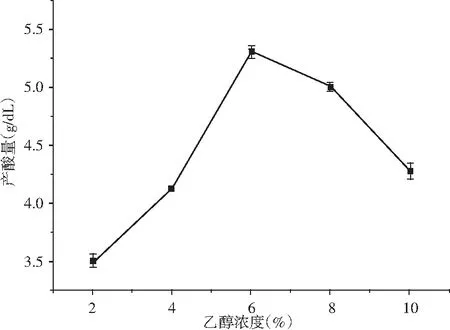
图5 不同浓度无水乙醇对K-4菌株产酸能力的影响Fig.5 Effect of different concentration of absolute ethanol on acid-producing ability of K-4 strain
由图5可知,K-4菌株的乙醇浓度不同,产酸量变化明显,随着浓度的升高,产酸量升高,6%以后逐渐下降。可知6%时产酸量最高,酒精是醋酸菌生长代谢能量的提供者,酒精浓度越高,对醋酸菌生长有抑制作用,所以培养基配制时最佳乙醇浓度为6%。
2.5.2 不同浓度葡萄糖对K-4菌株产酸能力的影响

图6 不同浓度葡萄糖对K-4菌株产酸能力的影响Fig.6 Effect of different concentration of glucose on acid-producing ability of K-4 strain
由图6可知,K-4菌株葡萄糖浓度在2%时产酸量最高,大于2%时产酸量逐渐降低。随着葡萄糖浓度的升高,细菌繁殖能力增强。但是当葡萄糖添加量增加到2.5%时,细菌繁殖能力下降,菌液浓度下降,所以在培养基配制时葡萄糖最佳添加量为2%。
2.5.3 不同浓度酵母膏对K-4菌株产酸能力的影响

图7 不同浓度酵母膏对K-4菌株产酸能力的影响Fig.7 Effect of different concentration of yeast extract on acid-producing ability of K-4 strain
由图7可知,K-4菌株酵母膏浓度在1.5%时最佳,在1.5%之前,随着酵母膏浓度的升高,产酸量增大,但随着酵母膏浓度的升高,细菌产酸能力下降。所以,醋酸菌产酸量在1.5%时高于其他浓度,为最佳浓度。
2.6 K-4菌株产酸正交试验
K-4菌株产酸正交试验结果与分析见表3。
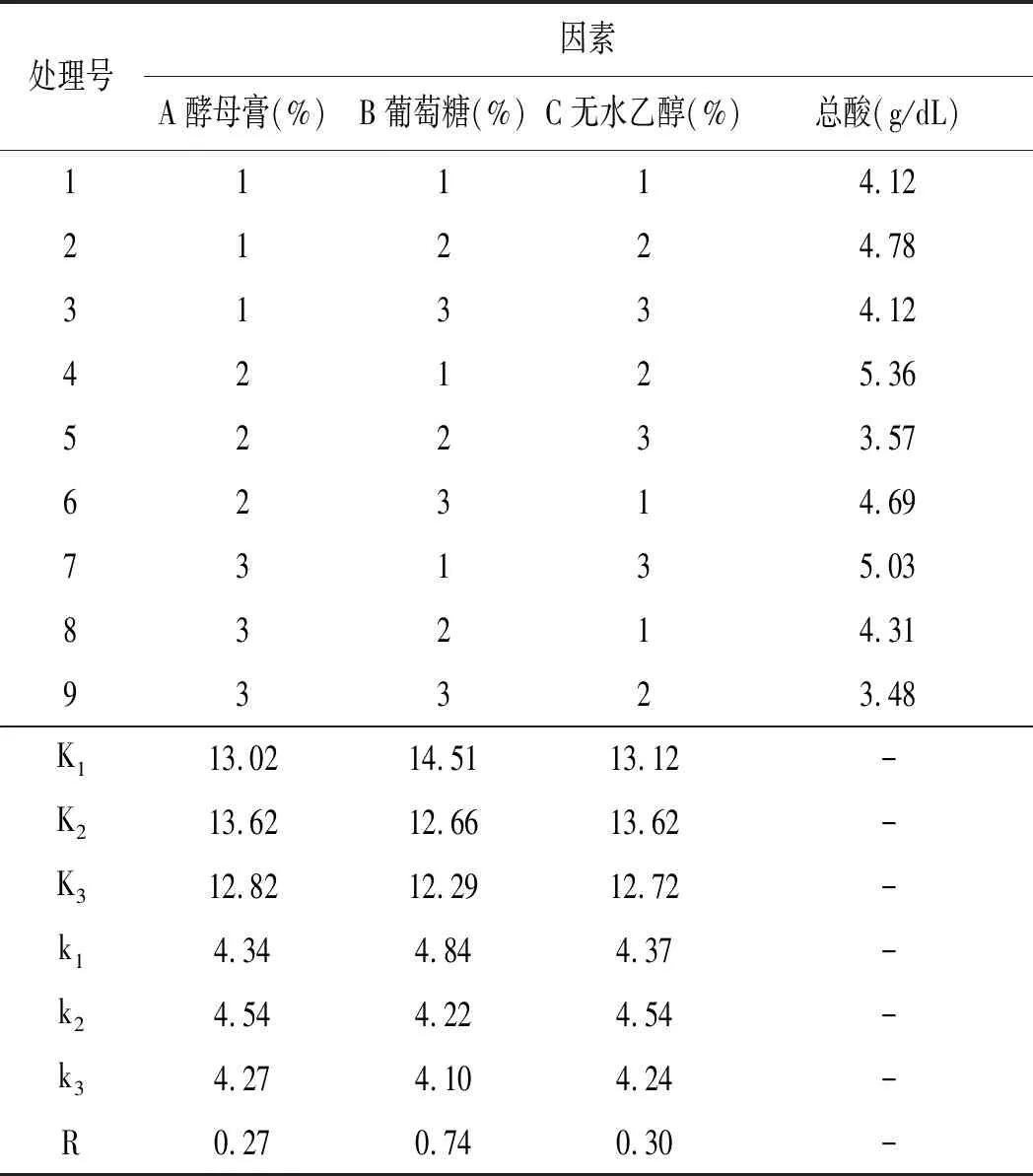
表3 产酸条件优化正交试验结果与分析Table 3 Optimization of orthogonal test results and analysis of acid-producing conditions
由正交表极差分析可知,对K-4菌株产酸影响的重要性为B>C>A,即葡萄糖浓度>无水乙醇浓度>酵母膏浓度。由正交试验结果可知,K-4菌株最佳产酸条件为A2B1C2,即酵母膏1.5%,葡萄糖1.5%,无水乙醇6%。
3 结论
通过对新疆酿酒葡萄赤霞珠表皮的醋酸菌进行不断筛选和纯化,最终初步得到了15株醋酸菌,经过对其镜检以及形态特征的对比,初步将其分成了5种类型,挑取5株活性较好的代表菌株进行DNA提取和16S rDNA序列扩增测序,NCBI序列比对结果表明:K-1、K-2、K-3属于Acetobacterperoxydans(过氧化醋杆菌),K-4属于Acetobacteroeni(葡萄酒醋酸杆菌),K-5属于Gluconobacteralbidus(白葡糖杆菌)。
通过对K-1、K-2、K-3、K-4、K-5进行7天发酵试验,结果表明K-4产酸能力最高,由正交表极差分析得出,对K-4菌株产酸影响的重要性为:B>C>A,即葡萄糖浓度>无水乙醇浓度>酵母膏浓度。所以,由正交试验结果可知,K-4菌株最佳产酸条件为A2B1C2,即酵母膏1.5%,葡萄糖1.5%,无水乙醇6%。
