Cx43 基因修饰对大肠癌细胞的放射增敏作用
2019-04-11王炳杰胡延伟赵叶芳张仕东
王炳杰 胡延伟 赵叶芳 张仕东
(河北医科大学附属邢台市人民医院 1肛肠外科,河北 邢台 054001;2普外科;3妇产科)
西医上大肠癌的传统治疗手段除手术外,还有副作用较明显的放疗、化疗等方法及免疫和内分泌的辅助治疗〔1~3〕,对于中、晚期患者来说,这些手段确实可以缓控病情,改善患者生存情况〔4,5〕,但仍然不能改变大肠癌的高死亡率的现象〔6,7〕。20世纪九十年代初,基因治疗已进入新的研究领域,已从基础实验室研究迈向临床研究,为遗传性疾病、免疫缺陷及恶性肿瘤提供了新的研究手段〔8,9〕,同时还可以通过提高癌细胞的放射增敏性来改善西医放疗的效果〔10〕。即癌细胞受到低于平常剂量的放射剂刺激而死亡,正常细胞受到的射线辐射较小,减少了不良反应的发生〔11〕。细胞之间的生命活动及信号传导是通过缝隙连接建立的〔12〕,缝隙连接有自身独特的信号因子构成缝隙连接的细胞通讯。细胞通讯的异常,往往会导致细胞病变,严重的即形成癌细胞〔13〕。连接子蛋白(Cx)的构成多聚体,并聚集于细胞膜上,形成连接子,即缝隙连接的基本单位。相邻的连接子蛋白多聚体相互嵌合形成缝隙连接〔14〕。Cx43蛋白是众多连接子蛋白之一,对相邻细胞间的连接和通讯起到重要作用,诱导癌细胞表明的Cx 43蛋白表达可建立正常细胞缝隙连接,抑制癌细胞增殖〔15,16〕。本实验通过质粒pBudCE4.1,将Cx43基因转染至大肠癌SW480细胞,探讨转染Cx43基因对大肠癌SW480细胞放射增敏性的影响。
1 材料与方法
1.1设计 随机对照动物实验。
1.2时间及地点 实验于2013年3月至2015年10月在河北医科大学动物实验中心完成。
1.3实验动物及分组 成年健康级BALB/C裸鼠30只,性别不限,由河北医科大学动物实验中心提供,体重约300 g,依照随机数字表,分为3组:转染组、阴性对照组和空白组。所有大鼠的饲养条件为:23~27℃,恒温,湿度为50%~70%,喂养饲料:颗粒型普通大鼠饲料及消毒无菌水,让其自由饮水和进食,实验前1 d禁食不禁水。
1.4实验细胞及主要材料 大肠癌细胞株SW480细胞购自河北生命科学研究院,由本实验室冷冻保存,载体pBudCE4.1购于Novagen公司,RT-PCR试剂盒购于TaKaRa公司,L-DMEM培养基、胎牛血清购自GIBCO公司,Cx43抗体购于Proteintech公司,GAPDH抗体购于Bioworld公司,二抗(辣根过氧化物酶标记的羊抗鼠抗体)购自优维宁生物技术公司,荧光黄燃料和罗丹明染料购于济南龙盛,姬姆萨酚购于美国Sigma公司。原位细胞凋亡检测(TUNEL)购于贝克曼库尔特公司,细胞培养皿、细胞培养瓶购于上海百研生物科技有限公司,二氧化碳培养箱购于上海人和科技有限公司,荧光显微镜购于上海仪器厂,DNA engine opticon PCR 仪购于MJ Research,USA。
1.5方法
1.5.1通过pBudCE4.1-Cx43转染入大肠癌SW480细胞 将大肠癌SW480细胞分为转染组、阴性对照组和空白组。参考Genebank及pBudCE4.1限制性内切酶序列和Cx43引物的序列,由河北生物工程技术有限公司合成引物〔17〕。引物序列为:Cx43的基因序列为5′-AGAGCACGGCAAGGTGAAA-3′,阴性对照物Scrambled的基因序列5′-TTCTCCGAACGTGTCACGT-3′〔18〕。依据转染试剂盒说明书的要求,在转染试剂Lipofectamine 2000下进行转染。接种大肠癌SW480细胞于两块6孔培养板中(转染组和阴性对照组),密度为3×105个/孔,加入不含血清和抗生素的新鲜培养液,培养24 h〔19〕。合成复合物的条件为:转染组为5 μl的pBudCE4.1-Cx43溶液、5 μl的Lipofectamine 2000转染试剂和2 ml的新鲜培养基;阴性对照组为5 μl的Scram bled 溶液、5 μl的Lipofectamine 2000转染试剂和2 ml的新鲜培养基,6 h后更换新鲜培养基。转染组和阴性对照组均多次转染,培养48 h后进行实验〔20〕。
1.5.2RT-PCR检测Cx43 mRNA的表达情况 总RNA从转染48 h后的大肠癌SW480细胞中提取,按说明书进行提取总RNA并以总RNA的mRNA为模板,参照说明书的逆转录酶法反转录合成cDNA,在扩增仪上进行RT-PCR。吸取2 μl的悬浮细胞液,正反向引物各加入1 μl悬浮细胞液。Cx43的上游引物为:5′-AAAGGCGTTAAGGATCGCGTG-3′,下游引物为:5′-GTCATCAGGCCGAGGCCT-3′,扩增目的基因片段长度为209 bp。内参物β-actin的上游序列为:5′-CCCATCTATGAGGGTTACGC-3′,下游序列为:5′-TTTAATGTCACGCACGATTTC-3′,扩增目的基因片段长度为127 bp〔21〕。Cx43反应循环条件如下:94℃变性2 min,94℃ 45 s,58℃退火45 s,72℃ 90 s,32循环,最终72℃延伸5 min。β-actin的反应循环条件为:94℃变性2 min,94℃ 30 s,56℃退火30 s,72℃ 90 s,28个循环,最终72℃延伸5 min。将PCR产物10 μl于1.2%琼脂糖凝胶电泳30 min,采用凝胶自动成像及分析系统,电泳结果用凝胶图像分析系统分析电泳条带光密度值,计算Cx43与β-actin光密度光比值,各组实验均需重复3次。
1.5.3Western印迹检测Cx43蛋白的表达情况 收集被转染48 h的大肠癌SW480细胞,用磷酸盐缓冲液(PBS)溶液洗涤3次,加入100 μl细胞裂解液(预先冰浴10 min),用(BCA)法测定细胞中的蛋白含量,拟合蛋白标准曲线,计算其上样量〔22〕。4%十二烷基硫化硫酸钠-聚丙烯酰胺凝胶电泳(PAGE),15 mA电泳1 h后,取下凝胶,蛋白条带电转膜至聚偏氟乙烯(PVDF)膜,将转移完成的PVDF膜放入培养皿,加入5%脱脂奶粉,浸过PVDF膜即可,封闭1 h。与多克隆兔抗体Cx43(1∶250)反应,阴性对照组与GAPDH(1∶1 000)抗体反应。一抗稀释后放入培养皿中,加入PVDF膜,4℃恒温过夜,过夜振荡孵育后,取出PVDF膜,用TBST液冲洗多次,每次浸润5 min。与二抗反应,常温下振荡孵育2 h,取出PVDF膜,用TBS液冲洗多次,每次浸润5 min。按照电化学发光(ECL)说明书的操作步骤,对PVDF膜进行荧光染色,液体A和液体B等量混合后,将其加入PVDF膜正面,反应1 min,置于暗室10 min,曝光、显影、定影,通过Alpha2200图像分析仪对各组条带扫描拍照,并对其光密度值进行半定量分析〔23,24〕。
1.5.4划痕染料示踪法检测细胞间通讯功能 预先分别将50 mg荧光黄粉末、50 mg罗丹明染料溶于2 ml无水乙醇中,加热超声充分溶解后,并用1 ml PBS液稀释,分别配置0.05%的荧光黄溶液和0.05%的罗丹明染剂。收集被转染48 h的大肠癌SW480细胞及阴性对照组细胞,分别放置于培养皿,用PBS溶液洗涤3次,37℃下,加入荧光黄溶液和罗丹明染剂各1 ml,用手术刀在在培养皿中划痕,静止5 min,除去染料,用PBS溶液洗涤3次,2%多聚甲醛固定0.5 h,室温下自然烘干。荧光显微镜下,每切片随机选取10个视野,观察转染组和阴性对照组的细胞通讯情况,并用Image J对转染组和阴性对照组的细胞情况进行分析。
1.5.5通过6 MV X射线照射后采用集落形成实验检测细胞放射敏感性 收集被转染48 h后的转染组和同时期的阴性对照组大肠癌SW480细胞,分别放置于培养板中,并将培养板倒扣于5 mm厚的补偿膜上,X射线进行照射,照射条件为:37℃,6 MV X射线,源皮距100 cm,剂量率为140 cGy。照射完成后,将细胞于培养板中培养10 d,弃掉培养液,用PBS溶液浸洗多次,用甲醇溶液固定0.5 h,倒掉固定液,滴入姬姆萨染液染色0.5 h,用蒸馏水多洗浸洗,室温下自然烘干。倒置培养板,并放置网格透明片,按照细胞数大于50为1个克隆计数进行计数克隆。采用数学模型进行数据拟合,计算Do和Dq的数值,比较被转染48 h后的转染组和同时期的阴性对照组细胞的放射敏感性〔25〕。
1.5.6流式细胞仪检测各组细胞的凋亡率 转染48 h后,收集转染组和阴性对照组的大肠癌SW480细胞,10 Gy照射。37℃下,两组细胞用的胰蛋白酶(浓度为0.25%)进行消化,1 500 r/min,离心10 min,去上清液,用已配置好的PBS溶液洗涤3次,重悬细胞浓度为1×106/ml。用移液枪移取100 μl的细胞于流式管中,缓慢加入低温细胞固定液即AnnexinV-FITC溶液,4℃下充分振荡,并在4℃下静置24 h。离心10 min,1 000 r/min后,除去细胞固定液,PBS溶液洗涤多次,转染组和阴性对照组分别加入100 μl,200 μg/ml的RNA酶溶液,室温下,静置1 h后,加入染色液50 μg/ml的PI溶液和,进行染色,0.5 h后加入PBS溶液,流式细胞仪被用来测定转染组、阴性对照组的大肠癌SW480细胞,用Light cycel 分析软件分析细胞周期的分布,比较转染组和阴性对照组的大肠癌SW480细胞的凋亡情况。
1.5.7观察10 Gy照射后肿瘤生长状况及Bcl-2基因活性 通过皮下接种的方法构建人大肠癌裸鼠移植瘤模型,给予10 Gy进行照射,通过测定肿瘤大小的方法,来判断照射后肿瘤的生长状况。应用比色法通过添加特异性底物来测定Bcl-2基因活性。对细胞进行观察,待贴壁后将其放入有放射线的环境中过夜。次日将其拿出,向其中添加胰酶对其进行消化,随后进行离心,并将待测细胞进行收集,将细胞进行重悬处理,并进行冲洗。向其中添加裂解液再次重悬细胞,随后将其放于冰上,10 min再次向其中添加裂解液,并进行离心,将其上清取出,放入缓冲液中测定其活性。向其中添加Bcl-2的底物并进行温育,1 h后应用分光光度计测定其吸光值。通过比较转染组和空白组的吸光度值来检测其活性变化。
1.6统计学方法 采用SPSS13.0软件进行t检验及方差分析。
2 结 果
2.1RT-PCR检测Cx43 mRNA的表达情况 与空白组mRNA表达水平(0.93±0.11)相比,阴性对照组Cx43 mRNA表达水平(0.97±0.13)增高,转染了Cx43基因的48 h后转染组的大肠癌SW480细胞中的Cx43 mRNA表达(1.82±0.21)明显高于阴性对照组,差异有统计学意义(P<0.05)。见图1。
2.2Western印迹检测Cx43蛋白的表达情况 转染了Cx43基因48 h后的转染组大肠癌SW480细胞中Cx43蛋白表达(2.06±0.26)与阴性对照组(1.01±0.15)相比较高,差异有统计学意义(P<0.05),空白组Cx43蛋白水平(0.98±0.11)最低。Western印迹检测的蛋白表达水平结果印证了与RT-PCR法检测的mRNA表达结果,见图2。

图1 各组Cx43 mRNA表达水平
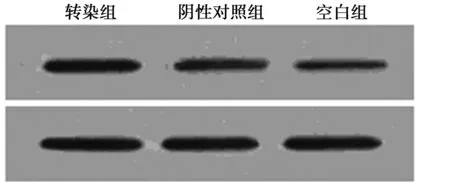
图2 各组Cx43蛋白表达水平
2.3划痕染料示踪法检测细胞间通讯功能 划痕染料示踪法检测细胞间通讯功能转染组()明显升高;细胞显微镜观察各组细胞的染料传递量,统计分析实验组细胞间染料传递2~3层间,明显比空白组(-)和阴性对照组(1)间的传递量高,染料局限于划痕边缘的单层细胞为未传递(-) ,1~2层细胞有染料为(+) ,2~3层细胞有染料为(),故差异有统计学意义(P<0.05)。
2.4细胞放射敏感性 转染组与阴性对照组和空白组相比,经过射线放射处理后,细胞的增殖能力显著降低(P<0.05),可以看出转染组的Do和Dq值小于阴性对照组和空白组,空白组的Do和Dq值最高。因此三组的放射敏感性为转染组最强,阴性对照组次之,空白组的放射敏感性最弱,见表1。

表1 转染组、阴性对照组和空白组的Do和Dq参数比较
与转染组比较:1)P<0.05;与阴性对照组比较:2)P<0.05
2.5细胞的凋亡率 转染组细胞凋亡率〔(19.86±1.53)%〕明显高于阴性对照组〔(6.75±1.20)%〕和空白组〔(6.90±1.17)%〕,差异有统计学意义(P<0.05),而阴性对照组和空白组凋亡率类似,因此可以推测Cx43基因可以促进癌细胞的凋亡。
2.6观察10 Gy照射后肿瘤生长状况及Bcl-2基因活性 对人大肠癌裸鼠移植瘤模型给予10 Gy进行照射,通过测量肿瘤的大小发现,转染组〔(5.40±0.56)mm3〕较阴性对照组〔(9.62±0.52)mm3〕和空白组〔(10.12±0.63)mm3〕的肿瘤明显减小,表明经照射后移植瘤生长受到显著的抑制作(P<0.05);Bcl-2基因表达活性,转染组〔(15.40±2.23)%〕较阴性对照组〔(59.47±4.52)%〕和空白组〔(62.12±5.48)%〕明显降低(P<0.05)。
3 讨 论
缝隙连接的细胞间通信信号传导,是维持机体细胞的生态平衡、细胞分裂分化的重要保障〔26~28〕。异常的缝隙连接将会导致细胞癌变,癌变后的细胞可在血管内皮细胞自由游走,可进入淋巴管、血管〔29〕,为癌症转移提供了条件〔30〕。已有研究证实编码质量数为43 kD,由387个氨基酸组成的Cx43是缝隙连接的重要连接蛋白〔28〕,其主要功能是在细胞膜上形成小分子物质的通道,调节细胞活动〔31〕。研究者发现,诸多癌症的转移都与Cx43表达缺失相关。研究发现,细胞间缝隙连接相对较好的癌细胞,转移能力明显低于缝隙连接相对较差的肿瘤细胞,癌细胞转移受到肿瘤细胞间缝隙连接的影响〔32,33〕。也有研究者发现,正常细胞的Cx43蛋白表达水平很高,Cx43蛋白表达于肿瘤细胞的转移密切相关,且Cx43蛋白表达与肿瘤细胞转移能力呈反比,即Cx43蛋白表达水平越高,肿瘤细胞转移越弱〔34〕。大肠癌细胞SW620细胞株表明同样发现了低表达水平的Cx43蛋白〔35〕。因此可以大胆设想,对大肠癌细胞增加Cx43蛋白的表达,对癌症的恶化有可能起到延缓作用。在癌细胞中,检测Bcl-2基因可反映细胞的凋亡情况〔36,37〕,Bcl-2基因是一种原癌基因,其蛋白表达水平越低,则癌细胞恶化越严重〔38~40〕。对直肠癌采用西医放疗方法治疗,会伴有严重的消化道出血、穿孔等副作用,不仅使患者疼痛难忍,同时也对正常细胞组织造成了一定的损害〔41〕。因此,提高放射的增敏性,减少放射剂量的使用,已成为肿瘤研究者的关注点。
依据本研究可以推测转染Cx43基因在大肠癌细胞SW480中可以得到很好表达,为遏制大肠癌细胞的转移提供了条件。Cx43基因可以增大癌细胞的放射增敏性。Cx43基因可以在一定程度上促进细胞的凋亡。Cx43蛋白的高水平表达进而建立了缝隙连接相关。大肠癌细胞SW480中Bcl-2基因表达同样受到Cx43基因的影响,因此大肠癌细胞的恶化程度最低,由此可推测Cx43基因有可能就是通过Bcl-2表达来发挥作用的。因此,转染Cx43基因能在大肠癌SW480细胞得到很好的表达,能够提高人大肠癌SW480细胞对X射线的敏感性,遏制肿瘤细胞转移,机制有可能是降低了细胞Bcl-2基因表达。
