非洲猪瘟病毒P30-54融合蛋白在杆状病毒表达系统中的表达及反应原性研究
2019-04-11张星星张国武王晓婷才学鹏孟庆玲
李 杰,张星星,郭 晶,张国武,王晓婷,李 妍,才学鹏,孟庆玲 ,乔 军*
(1.石河子大学动物科技学院,新疆 石河子 832003;2.新疆农垦科学院畜牧兽医研究所,新疆 石河子 832000;3.中国农业科学院兰州兽医研究所,甘肃 兰州 730046)
【研究意义】非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)所引起猪的一种烈性传染病[1]。该病毒可感染所有品种和年龄的家猪和野猪,病死率高达80 %~100 %[2]。该病在我国被列为一类动物疫病。ASF最初主要在非洲流行,近年来逐渐扩散到地中海以及东欧等国家或地区[3-4],特别是2017年俄罗斯远东地区发生ASF疫情,使得ASF疫病传入亚洲等国家的风险不断增大[5]。目前,我国虽未发生该病,但该病输入性风险极大。【前人研究进展】在临床上,ASF主要以高热和内脏器官出血为主要特征,与猪瘟(CSF)非常相似,因此无法通过临床症状和病理变化进行鉴别诊断,只有依赖于实验室进行确诊[2,4]。目前,ASF的实验室诊断包括动物接种、病毒分离、病毒核酸DNA 检测和特异性抗体检测等方法[6-8]。然而,动物接种、病毒分离和病毒核酸DNA 等检测方法或需要在生物安全三级以上的实验室,或需要专业的仪器设备和技术人员,或操作繁琐,难以满足基层检疫部门的需要[6-7,9]。目前,血清学检测是诊断和监测猪感染ASFV的重要方法之一[9-10]。然而,现有的血清学诊断用抗原多细胞培养的ASFV全病毒抗原,这种抗原虽然敏感性较高,但培养活病毒会存在生物安全方面的隐患[11-12]。近年来,随着ASFV全基因组测序的完成,国外学者历史基因工程技术表达了ASFV重要的结构蛋白(如P30、P54、P72和P14.5等),并利用表达的重组蛋白用于ASFV血清学诊断用抗原的研发[9-13]。研究发现,单一重组蛋白抗原虽具有较高的特异性,但敏感性不高。因此,研发特异性高和反应原性强的ASFV抗原对于高特异性和敏感性血清学诊断方法的建立至关重要。【本研究切入点】在前期构建ASFV P30-54融合基因基础上,本研究将P30-54融合蛋白基因克隆入杆状病毒转座载体质粒pFastBac1中,在杆状病毒表达系统中进行表达,分析了重组蛋白的反应原性。【拟解决的关键问题】为特异性高和反应原性强的ASFV诊断用抗原的研发奠定了基础。
1 材料与方法
1.1 载体、菌株、培养基及试剂
pT-P30-54重组质粒(含有P30-54融合基因)由本实验室构建;杆状病毒表达系统转移载体pFastBacl、DH10Bac宿主菌、昆虫细胞Sf9购自Invitrogen公司。IPTG、X-gal、限制性核酸内切酶EcoRⅠ和XhoⅠ、基因组DNA提取试剂盒购自TaKaRa生物公司;昆虫细胞培养基、水解乳蛋白购自GIBCO公司。小鼠抗ASFV P30-54融合蛋白多克隆抗体由本实验室制备。HRP标记的兔抗鼠酶标二抗、FITC标记的兔抗鼠IgG荧光抗体购自Sigma公司。
1.2 引物设计与合成
根据 P30-P54融合基因序列设计扩增P30-P54融合基因上游引物FP:5′-GGAATTCATGGATTTTATTTTAAATATATCC-3′(下划线部分为EcoRⅠ酶切位点),下游引物RP:5′-CCTCGAGTTACAAGGAGTTTTCCAGGTCTTT-3′(下划线部分为XhoⅠ酶切位点),由北京华大基因公司合成。
1.3 重组转移载体pFast-P30-P54的构建与鉴定
以pT-P30-54重组载体为模板,用引物FP和RP 扩增P30-P54融合基因。PCR的反应体系为:H2O 9 μl,PCR Mixture 8 μl,上下游引物各0.5 μl,DNA模板2 μl。反应条件为:95 ℃预变性5 min,94 ℃变性40 s,56 ℃退火1 min,72 ℃延伸80 s,30个循环,72 ℃延伸10 min,4 ℃保存。将PCR产物用1 %琼脂糖凝胶电泳,将目的片段用DNA回收试剂盒回。将pFastBac1用EcoRⅠ和XhoⅠ双酶切,回收线性化的pFastBac1载体大片段,将P30-P54融合基因与载体片段用T4 DNA连接酶连接并转化JM109。 挑取单菌落,提取质粒利用PCR和酶切进行鉴定,获得重组质粒pFast-P30-P54。
1.4 重组质粒Bacmid-P30-54的筛选和鉴定
将pFastBac1-P30-54转化含有Bacmid的大肠杆菌DH10Bac,取稀释液100 μl涂布于含有IPTG/X-gal、卡那霉素(50 μg/mL)、庆大霉素(7 μg/mL)和四环素(10 μg/mL)的LB平板,37 ℃培养24 h。挑取重组的白色菌落37 ℃培养24 h,进行表型鉴定,按照Bac-to-Bac杆状病毒表达系统操作步骤提取重组Bacmid-G基因组,用P30-54基因特异性引物进行PCR鉴定。
1.5 重组病毒reAcMNPV-P30-54的制备及鉴定
用LipofectamineTM将重组Bacmid-P30-54转染6孔培养板上Sf9昆虫细胞。将细胞盲传3代后收集病变细胞培养物,反复冻融3次后,离心取上清得到重组病毒reAcMNPV-P30-54。提取接毒细胞基因组DNA,以其为模板,以P30-54融合基因特异性引物进行PCR,分析目的基因是否插入到重组病毒基因组中。
1.6 重组融合蛋白P30-54的间接免疫荧光(IFA)的检测
将1×105个细胞在96孔细胞培养板上培养,用reAcMNPV-P30-54接种细胞,以AcMNPV接毒细胞和正常sf9细胞作对照。在接毒72 h以后,用80 %的丙酮固定细胞,0.1 % PBST洗涤3次后,用10 %犊牛血清封闭,250 μl/孔,37 ℃孵育 1 h。洗涤3次后,加入1∶100稀释的小鼠鼠抗ASFV阳性血清和阴性血清(对照),100 μl/孔。37 ℃作用1 h,洗涤后加入1∶50稀释的FITC标记的兔抗鼠荧光二抗,37 ℃孵育 1 h,洗涤3次后在荧光显微镜下观察。
1.7 重组融合蛋白P30-54的SDS-PAGE和Western blot分析
将5×105个细胞传至24孔板,以reAcMNPV-P30-54接种细胞为试验组,用AcMNPV接毒细胞和正常sf9细胞作对照。在感染后72 h收集病变细胞,用0.01 mol/L pH 7.2 PBS洗涤3次,-20 ℃和37 ℃反复冻融3次,冻融,用离心后的上清进行SDS-PAGE和Western blot检测,分析重组融合蛋白P30-54的反应原性。

M. DNA marker (DL-15000+2000); 1. pFast-P30-54 的 EcoRⅠ+XhoⅠ双酶切; 2. pFast-P30-54 的 EcoRⅠ酶切图1 重组载体pFast-P30-54的酶切鉴定Fig.1 Identification of pFast-P30-54 by enzyme digestion
2 结果与分析
2.1 重组载体pFast-P30-54的构建及鉴定
重组载体pFast-P30-54 双酶切可得到1140 bp的目的基因片段和4775 bp的载体大片段(图1)。PCR扩增得到了与预计大小相符的DNA条带。结果表明,成功构建了P30-54目的基因的重组转座载体pFast-P30-54。
2.2 重组载体Bacmid-P30-54阳性克隆的筛选及鉴定
重组载体pFast-P30-54转化DH10Bac宿主菌后,将转化后的细菌涂布于含有IPTG/X-gal的抗性平板上进行了3轮表型鉴定,在平板上可出现白色菌落和蓝色菌落(图2,见封三)。挑取阳性克隆(白色菌落),用P30-54特异性引物扩增,可以获得与预期大小一致的1140 bp的目的基因片段(图3)。
2.3 细胞转染与重组病毒的制备
将重组质粒Bacmid-P30-54分别转染Sf9昆虫细胞72 h后,细胞出现明显的细胞病变(CPE),主要表现为变大、变圆、脱落等。收集病变细胞,反复冻融3次,离心取上清即得到重组病毒reAcMNPV-P30-54。提取重组病毒基因组,用P30-54特异性引物进行PCR扩增,结果可得到与预期一致扩增产物(图4),表明成功得到了重组病毒。

M. DNA marker (DL-2000);1~2:重组质粒Bacmid-P30-54的PCR扩增图3 重组载体Bacmid-P30-54的PCR鉴定Fig.3 Identification of Bacmid-P30-54 by PCR amplification

M:DNA marker (DL15000+2000); 1~2:重组病毒reAcMNPV-P30-54的PCR鉴定图4 重组病毒reAcMNPV-P30-54的PCR鉴定Fig.4 Identification of recombinant reAcMNPV-P30-54 by PCR
2.4 重组融合蛋白P30-54的间接免疫荧光(IFA)检测
重组Bacmid-P30-54分别转染昆虫细胞Sf9后,用含有目的基因的重组病毒reAcMNPV-P30-54的sf9细胞进行IFA实验,结果发现感染重组病毒reAcMNPV-P30-54的sf9细胞发出黄绿色的荧光,而非重组病毒AcMNPV感染细胞无荧光(图5,见封三)。
2.5 重组融合蛋白P30-54的SDS-PAGE与反应原性分析鉴定
SDS-PAGE检测结果证实,ASFV P30-54融合基因在杆状病毒表达系统中进行了表达,分子量为42.5 kDa,与预期大小相符;接种非重组病毒AcMNPV的sf9细胞中无目的蛋白条带出现。Westernblot分析结果表明,重组融合蛋白P30-54能与小鼠抗ASFV P30-54多克隆抗体发生特异性免疫学反应(图6)。
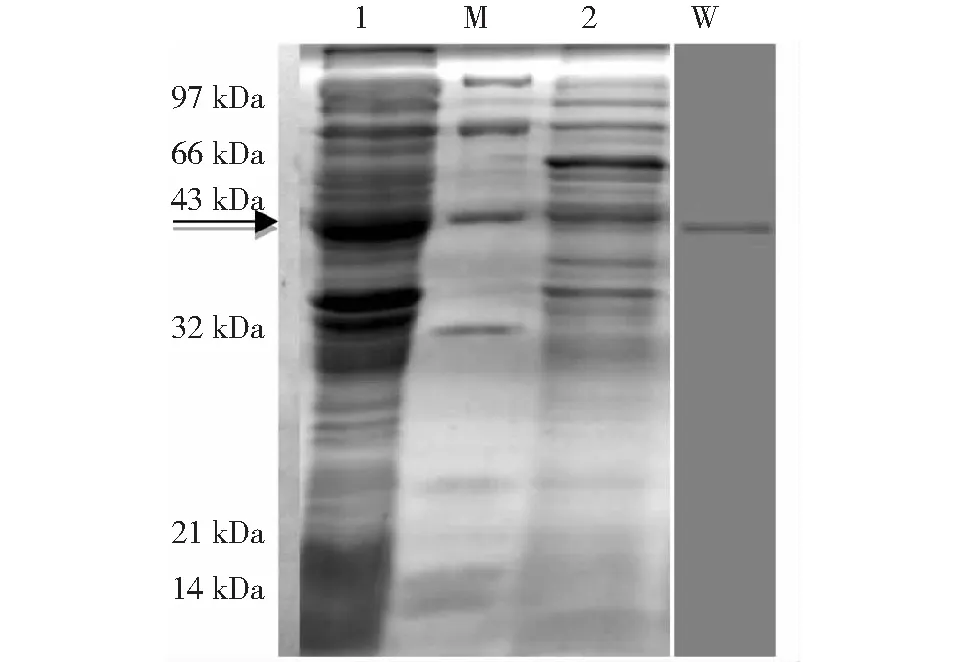
M:标准蛋白marker;1:接种reAcMNPV-P30-54的sf9细胞;2:接种非重组病毒AcMNPV的sf9细胞;W:Western blot 分析图6 重组融合蛋白P30-54的SDS-PAGE和Western blot分析结果Fig.6 Analysis of recombinant fusion P30-54 protein by SDS-PAGE and Western blot
3 讨 论
ASFV属于非洲猪瘟病毒科(Asfarviridae)非洲猪瘟病毒属(Asfarvirus)的成员[3,15],该病毒只有1 个血清型,但不同地域ASFV分离株基因组存在着明显的遗传多样性[16]。根据P72 基因遗传进化分析,目前可将ASFV 至少分为23 个基因型[16,19]。ASFV基因组长度在170~190 kb 之间,可编码150~200个病毒蛋白[3]。目前的研究发现,在ASFV结构蛋白中,P72、P54、P22、P12、P17、P30、P14.5、P150、P37及P34 等蛋白具有较强的抗原性[3,15.20]。
昆虫细胞-杆状病毒表达系统具有真核生物蛋白质翻译后修饰所必需的酶系统,能有效进行蛋白质的翻译后加工(糖基化、磷酸化或脂酰化),表达蛋白的空间结构及抗原性与天然蛋白十分相似,是一种常用的真核基因表达系统。目前,该系统已成功表达了禽流感病毒(AIV)、传染性鸡支气管炎病毒(IBV)、蓝舌病病毒(BTV)、鸡法氏囊病病毒(IBDV)等多种动物病毒的抗原蛋白。Oviedo等(1997)利用昆虫细胞-杆状病毒表达系统表达了ASFV P30和P54蛋白,并且通过间接ELISA评价了两种重组蛋白用于检测ASFV抗体的效力[11]。结果表明,p54重组蛋白表现出更强的反应原性,但p30蛋白具有更高的敏感性。研究结果提示,将2种蛋白组合是研发ASFV特异性强。敏感性高的血清学诊断抗原的重要手段。Barderas等(2001)利用昆虫细胞和粉纹夜蛾(Trichoplusiani)幼虫细胞表达了ASFV p54/30嵌合蛋白,将重组蛋白免疫猪后可诱导机体产生对强毒具有中和活性的高水平抗体,提示该嵌合蛋白具有良好的免疫原性[17]。Giménez-Lirola 等(2016)通过大肠杆菌表达系统表达了ASFV P30和P54和P72蛋白基因[12],利用荧光微珠免疫试验评估了纯化的 P30和P54和P72重组蛋白对人工感染ASFV血清的检测能力,结果表明3种蛋白中P30重组蛋白表现出更高的敏感性和特异性;基于P30重组蛋白的间接ELISA可以检测出人工感染8~12 d的猪血清中ASFV特异性抗体,同时还可用于ASFV感染猪口腔分泌液中抗体的检测。研究结果证实,ASFV 重组蛋白P30具有作为ASFV诊断抗原研发的潜力。曹琛福等(2016)利用成功构建了含ASFV p54基因的重组杆状病毒,并在昆虫细胞中高效表达,通过免疫印迹试验和间接ELISA试验证实其具有良好的反应原性;同时,利用原核表达的ASFVP54蛋白建立了检测ASFV抗体的竞争ELISA方法,通过对血清样品的检测证实其具有较好的特异性和敏感性[21]。
为了研发特异性强、敏感性高的ASFV血清学诊断用抗原,本研究采用Bac-to-Bac杆状病毒表达系统成功表达了ASFV P30-54融合蛋白基因。通过IFA和Western blot证实ASFV P30-54重组融合蛋白在昆虫 sf9细胞的胞内表达,且重组蛋白具有较强的反应原性,为特异性高和敏感性强的ASFV诊断方法的建立提供了一个有潜力的候选诊断用抗原。
