先天性耳前瘘管的诊治进展
2019-04-11朱雅颖李辰龙施宇轩傅窈窈谢友舟
朱雅颖 李辰龙 施宇轩 傅窈窈 谢友舟
(复旦大学附属眼耳鼻喉科医院眼耳鼻整形外科 上海 200031)
先天性耳前瘘管(congenital preauricular fistula,CPF)是临床上常见的先天性外耳疾病,大多数表现为耳轮升支前方的皮肤小凹。CPF绝大多数不合并其他发育异常,不引起听力障碍,但是易发生感染,有时需要反复切开引流,而且很多都是从婴幼儿期开始发病,对儿童的身心健康影响很大。
1 病因
耳前瘘管的形成与耳郭胚胎发育异常有关。胚胎第4周的时候出现6对鳃弓,耳郭由第一、二鳃弓和第一鳃裂的中胚层和外胚层形成[1]。胚胎第6周,间叶细胞扩增成6个耳丘,第1~3耳丘集结于第一鳃弓尾端,第4~6耳丘集结于第二鳃弓的头端。耳丘最终增大并融合成耳郭。第1耳丘演化成耳屏,第2耳丘演化成耳轮脚,第3耳丘发育成耳轮的大部分,第4耳丘演化成对耳轮,第5耳丘形成对耳屏,第6耳丘形成耳垂和耳轮的最下端。异常发育的耳丘可能导致耳郭相应部位的大小出现异常,或缺失,或形成瘘管。耳前瘘管的确切胚胎发育依据尚不清楚,可能与以下3个因素相关,即第一鳃弓耳丘不完全融合、外耳形成过程时外胚层内折或者第一鳃裂背侧部分闭合缺陷[2-4]。
迄今为止,耳前瘘管在分子病因学上的研究进展缓慢,疾病的致病基因始终未知。Zou等[5]和邓文国[6]分别将单纯性CPF定位于染色体8q11.1-q13.3和1q32-q34.3区域,而Sampath等[7]将综合征型CPF定位在染色体14q31.1-q31.3区域。位于8q11.1-q13.3的EYA1基因曾被认为可能是CPF的重要候选基因。遗憾的是,这几位研究者均未能在EYA1上发现任何与疾病相关的遗传变异。宋健文等[8]在西安的一个单纯性CPF家系中,分别对上述已知的3个候选区域开展遗传连锁分析,结果未能重复出此前的任何一项研究结果,进一步的单倍型分析未发现与疾病共传递的单倍型区段。
2 病理
CPF为盲端小管,外口开口于耳郭周围的皮肤上,多见于耳轮升支前缘,少数可开口于耳轮升支的后上边缘、耳轮脚、耳甲、耳屏及耳垂[9-10]。耳前瘘管管腔狭小,深浅、长短不一,部分可见分支。窦道位于颞肌筋膜浅层以及腮腺和面神经的外上,通常与耳郭软骨膜连接[11]。瘘管管壁被覆角化过度或角化不全的复层鳞状上皮,具有毛囊、汗腺、皮脂腺等组织,管腔内常有脱落上皮、细菌等混合而成的鳞屑或豆腐渣样物。
既往感染者和术后复发者的病理切片均可见远端瘘管结构走行不连续,瘘管管腔之间被条索状纤维组织分隔,管腔内含脱落上皮、细菌等混合而成的分泌物。感染期患者的切片远端大面积肉芽组织及瘢痕组织形成的脓腔结构内见散在的瘘管上皮组织,瘘管组织之间为纤维组织分隔,管腔周围见新生的毛细血管及浆细胞、淋巴细胞和中性粒细胞浸润[12]。
3 遗传与流行病学
CPF在不同人群中的患病率存在差别,美国为0.1%~0.9%,英国为0.9%,中国为1.2%~2.5%,韩国为1.6%~2.53%,非洲某些地区为4%~10%。耳前瘘管可以散在发病或者家族遗传,遗传方式为常染色体显性遗传伴外显不全,还表现出高度的遗传异质性。25%~50%为双侧发病,大多有家族史,有隔代遗传现象,以及患病体侧的家族一致性[13-14]。根据患者的表型,通常可分为无耳前瘘管以外表型的单纯性CPF和伴有其他异常表型的综合征型CPF,后者主要见于鳃-耳-肾综合征。
4 诊断
4.1 临床表现 耳前瘘管按照临床表现可分为单纯型、分泌型和感染型。单纯型平时无自觉症状。分泌型是瘘管内皮屑及皮脂腺分泌物堆积导致瘘口经常有白色分泌物,可以引起局部皮肤瘙痒,局部隆起。感染型表现为局部红、肿、痛,瘘口溢脓液;严重者出现周围软组织肿胀,形成脓肿破溃或者肉芽,反复感染经久不愈[15]。感染型占CPF的82.58%,分泌型占3.87%,无症状型占13.15%,其中感染型及分泌型需手术治疗[16]。
王志远等[17]对47例感染性CPF患者的分泌物进行了细菌培养和药敏分析,发现致病菌中革兰阳性菌占81.3%,其中葡萄球菌占68.8%,其他占12.5%;革兰阴性杆菌占12.5%,真菌占3.1%。未成年组革兰阳性球菌构成比显著高于成年组。金黄色葡萄球菌和表皮葡萄球菌为CPF的常见病原菌,对青霉素、红霉素和克林霉素的耐药率高达80%。因此要警惕多重耐药菌及真菌感染。细菌培养结果对CPF感染前期的保守治疗及术后抗生素的选择有指导意义。
4.2 耳前瘘管的解剖 典型的耳前瘘管通常位于耳轮升支的前缘,也有的位于耳轮升支的后上缘、耳屏、耳垂、耳轮脚、耳郭上或后方区域。Choi 等[9]报道了非典型位置的耳前瘘管11例,均为沿耳轮脚向后或后下延伸的瘘管,占所有耳前瘘管的10.9% (11/101) 。Kim等[18]报道了20例非典型耳前瘘管,占所有耳前瘘管的9.4% (20/212),文中介绍了这些瘘管的走行和手术路径。他们沿用了“耳前瘘管的变异”这一说法,因为这些瘘口位置和窦道走行都与耳郭结构相关,始终位于颞肌筋膜和腮腺的外侧,不累及面神经和外耳道。20例中有15例瘘口位于耳轮脚,但是只有5例向后延伸。Yeo等[19]报道了变异耳前瘘管14例,占所有瘘管的6.8% (14/206),瘘管位置与Kim等[18]的报道相同。Kim等[18]认为,耳前瘘管的变异走行,可能进一步证实不同耳丘融合异常导致的先天畸形。耳前瘘管的平均长度为3~22 mm,感染与瘘管的长度和分支都有关联[20]。
4.3 耳前瘘管的定位 耳前瘘管平时没有临床症状,如果发生感染容易反复发作,迁延不愈者导致瘘管周围肉芽肿、纤维组织增生及瘢痕形成,手术难以彻底切除,复发率较高。所以术前定位瘘管的行径对降低复发率有一定的帮助。以往对耳前瘘管的诊断依靠探针、亚甲蓝(美蓝)染色、X线碘油造影等方法[21-22]。金属探针探查瘘管,患者比较痛苦,一般需在麻醉下进行,并且耳前瘘管走行迂曲,部分瘘管在瘢痕处闭塞或中断,探针的作用较为有限。亚甲蓝染色一般也是在术中进行,但是对于反复感染的耳前瘘管,亚甲蓝染色也不能完全显示瘘管的走行,不一定能起到有效的指示作用[23]。X线或CT碘油造影检查,由于软组织分率差,其准确率也较低,并且儿童患者做放射线检查需谨慎。此外,这些诊断方法无法显示耳前瘘管与周围组织结构的关系。
王存强等[24]报道了20例感染性耳前瘘管的MRI表现:T1WI表现为条状等或略低信号;T2WI及T2WI-FS表现为等或高信号;增强扫描瘘管呈管状或双轨状明显强化。散在瘢痕或肉芽组织内断裂瘘管的MRI表现比较复杂,T2WI及T2WI-FS表现为低信号,背景上的点状或短棒状增高信号;增强扫描断裂感染瘘管首先强化,瘢痕组织延迟强化。脓肿MRI表现:圆形或椭圆形、不规则形及马蹄形,T1WI表现为略低信号,T2WI及T2WI-FS表现为高信号;增强扫描脓肿壁呈明显强化,脓液不强化。认为MRI具有较高的软组织分辨率及多序列、多方位成像的优势,可以在感染性耳前瘘管患者术前检查中清晰显示瘘管、瘘管周围脓肿及其与外耳周围组织的位置关系,为外科手术提供详尽的解剖资料,对手术方案的制订有重要意义。
朱霞玲等[25]采用三维超声与二维超声检查耳前瘘管,结果发现三维超声和二维超声对耳前瘘管的主管显示率均可达到100%,对内口盲端的显示率分别为92.1%和80.9%,对分支的显示率达到85.7%和57.1%;三维超声的准确率均高于二维超声。对于反复感染瘢痕形成的断裂分支以及走行弯曲的瘘管,二维超声下很难做出准确判断;而三维超声成像可以观察二维超声不能显示的冠状切面,更能直观展现主支与分支之间的立体空间形态结构、耳前瘘管与周围血管的立体结构关系。但是超声在软骨中声波锐减,软骨后方是超声盲区,所以会出现超声失落。
5 手术治疗
单纯型耳前瘘管不需要治疗,但是当瘘管长期分泌,或者形成脓肿,需要进行手术切除。各家报道的术后复发率不尽相同,为0~43%[26]。
可能影响耳前瘘管手术并发症和复发率的原因有术前的脓肿引流、窦道切排、术中感染表现、术后引流及术中软骨切除等。但是Yeo等[19]和Gan等[27]认为上述因素不影响复发率。尽管Gan等[27]推荐耳前瘘管手术中去除软骨,Gur等[28]和Chavez Delgado等[29]确认软骨切除后复发率降低,但meta分析无法得出这个结论。
5.1 手术时机 临床上一直遵循传统的治疗理念,即耳前瘘管急性感染时,全身应用抗生素,对已形成脓肿者,应先行切开引流,待感染控制后行手术治疗。但是由于瘘管的存在,溃烂处不易愈合,有的可达数周,甚至数月。部分患者愈合不到2周又再度感染复发。反复感染或切排引流愈合后,导致瘘管与周围组织粘连严重,使手术分离困难,易有残留。如何确定手术时机,减轻患者痛苦和降低术后复发率是有待解决的问题。郑顺昌[30]认为只要局部水肿减轻,皮肤颜色从明显充血的红色变为暗红色,就说明感染已经得到控制。这是CPF合并感染或合并脓肿的最佳手术时机,而无需切开脓肿。因为瘢痕组织尚未形成,直视下更易于彻底清除坏死物质,减少复发。Choo等[31]将190例耳前瘘管分成早期干预(53例)和非早期干预(137例)2组,早期干预组在首次就诊后3周内手术切除瘘管,仅进行急性感染控制,不考虑手术当时的感染情况。手术时如果有切排伤口或感染导致的开放伤口,在瘘管切口前方做平行切口。结果发现,早期干预组中需要切排引流或术后复发的患者使用抗生素量高于非早期干预组,但是手术时机并不影响并发症发生率。随访6个月,2组都没有复发。
5.2 手术方法 Bruijnzeel等[32]检索了2015年3月20日前在PubMed 和 Embase发表过的相关文章,对耳前瘘管手术方法进行了系统综述和meta分析。
经典的瘘管切除方法是在瘘口周围做椭圆形切口,随瘘管窦道追踪到盲端,一并切除[33]。术后复发率为5.5%,亚甲蓝染色并没有减少复发率,使用显微镜使复发率减少至1.9%。
其他技术包括如下。
1)耳上入路。由Prasad等[34]首次报道的耳郭上途径,在耳轮升支前瘘口周围做椭圆形切口的同时,沿耳郭根部向后上延长切口,在颞肌筋膜表面切除包括窦道在内的软组织,但切除的边界并不仅限于耳前瘘管。术后复发率为2.2%,较瘘管切除术显著减少。锐器分离较射频刀联合耳上入路的复发率小。耳上入路联合引流可以使复发率降低至零,不放置引流条容易导致术后并发症。再次手术中,单纯瘘管切除术的复发率为42.9%,而耳上入路的复发率为零。
2)Baatenburg de Jong[10]提出从瘘管内部剖开,根据鳞状上皮走行完整切除整个瘘管。该技术一般适用于小瘘管,但需要在显微镜下完成。23例无并发症和复发。
3)应用局部整块切除法治疗感染期耳前瘘管,复发率为22.6%[35]。
4)8字形切口的扩大瘘管切除术治疗感染期耳前瘘管[35],复发率为零。
5)在瘘管切除前方溃破或瘢痕处作平行双切口[31]。
6)耳轮脚瘘管合并耳后脓肿者,行耳后双切口[19,36](图1)。

图1. 瘘口位于耳轮脚的耳前瘘管,手术采用耳前和耳后双切口 A.耳郭前面照片;B.耳郭背面照片;C.耳郭整体照片
Tan等[26]报道,局部广泛的瘘管切除以及术中使用显微镜可以降低瘘管复发的风险。Gan等[27]对11个耳前瘘管相关研究进行了综述,认为切除软骨可以降低复发风险,其中Yeo等[19]认为耳甲软骨切除与否差异无统计学意义。
Bruijnzeel等[32]不推荐耳上入路加术后引流,认为容易引起术后感染和延长术后包扎时间。但是术后并发症鲜有报道,所以不能提供预防术后并发症的方法。
5.3 局部修复 耳前瘘管反复肿胀、流脓或局部红肿隆起,表明病灶中已经有慢性炎症肉芽组织,单纯抗感染治疗很难愈合。近年来,整形美容技术的融合运用,使此类患者手术Ⅰ期修复创面的技术逐渐成熟。郭英[37]报道整形美容技术在复杂性耳前瘘管切除修复术中起到重要作用。根据感染灶和瘘口的不同位置关系,设计不同切口,制作皮瓣修复创面,可以获得良好的手术效果(图2)。为保护皮瓣血供,术中全部使用锐性分离,皮瓣制作时确保切除皮下病灶的同时尽量保留皮瓣的真皮层,皮瓣近端保留皮下组织。可吸收线缝合皮下组织,基本无张力后再行皮肤缝合[37-39]。
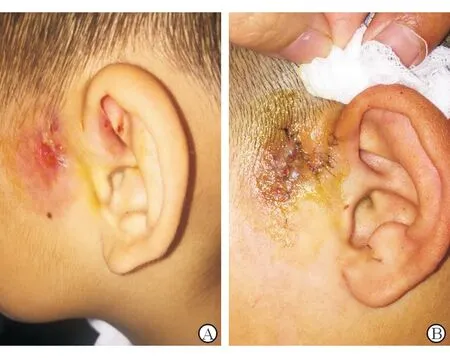
图2. 反复感染的瘘管,去除瘘口前方组织,一期行皮瓣修复 A.术前;B.术后
综上所述,CPF易于反复感染,术后也有较高的复发率,胚胎发生学、病理和解剖加深了外科医师对窦道位置以及与周围组织关系的理解,耳前瘘管的手术时机、切除广度和深度很重要,瘘管切除后的Ⅰ期美容修复也是手术成功的重要保障。
