3D打印PLA﹑PDS及PLGA材料的力学性能及软组织再生潜能
2019-04-10,,,
,,,
东华大学纺织学院,纺织面料技术教育部重点实验室(上海,201620)
0 引言
3D打印技术具有个性化制造、 高效及制造成本低等优点, 近年来得到了快速发展。在生物材料及医疗器械领域, 个性化人工器官及医疗器械的需求日益增加, 3D打印技术在该领域的应用也不断得到拓展。目前, 可3D打印的可降解生物医用高分子材料包括聚乳酸(PLA), 聚对二氧环己酮(PDS)及聚乙交酯丙交酯(PLGA)等。PLA具有良好的组织相容性及生物可降解性, 其中间产物为乳酸、 最终降解产物为二氧化碳和水, 因此在其降解过程对人体无毒[1]。
正由于其良好的生物医用前景, PLA在手术缝合线、 植入性支架、 骨组织再生 、 眼科和药物缓释等生物医疗领域有广泛的应用[2]。受尺寸、 聚合物中异构体含量、 温度和pH等影响, PLA完全降解需6~24个月[3], 其玻璃化转变温度在50~70 ℃之间, 熔融温度为185~190 ℃[4], 因此利用熔融沉积成型技术(FDM)进行3D打印, 操作简便。Chacón等[5]通过改变不同的3D打印参数获得力学性质不一的PLA样条, 其拉伸断裂强度最大可达65 MPa。而文献[6]中通过模压成型的PLA复合材料样条所能达到的最大强度为40~50 MPa。因此, 基于3D打印技术定制PLA医疗器械有获得优异力学性能的可能。PDS可通过二甘醇(DEG)催化并通过开环反应制备而得。PDS的熔点在110 ℃, 玻璃化温度为-10 ℃。PDS单丝在植入体内2周后仍能保持70%的强度, 4周后损失50%的强度, 而在28周后完全降解。PDS具有半结晶化的分子结构, 其降解过程与PLGA类似, 其降解产物可以被人体吸收或以二氧化碳的形式通过呼吸系统排出体外[7]。因此, PDS常被用来制作手术缝合线、 软骨和血管组织工程支架。
由乳酸及乙醇酸单体不规则共聚而成的不同比率(LA:GA)的PGLA, 具有不同的力学性能及降解速率。由CORBION®销售的商品名为PLG 1017的PLGA (90GA/10LA), 其玻璃化温度和熔点分别为28.5 ℃和200.2 ℃, 而组分为18GA/82LA的PLG 8218的玻璃化温度和熔点为60.7 ℃和161.2 ℃。研究表明[8], PGLA(LA/GA=10/90、 25/75、 50/50、 75/25)的降解时间分别为90, 100, 120, 180 d。因此, 已有较多研究利用PLGA制备用于软组织再生的支架[9-10]。
体内软组织再生时, 包括皮肤组织、 皮下组织、 肌肉组织及乳腺组织等, 组织工程支架常处于受拉伸、 压缩以及弯曲载荷作用下。因此, 本研究通过3D打印技术制备PLA、 PDS、 PLGA标准测试样品并测试其拉伸、 压缩、 弯曲等性能, 并通过与文献报道的测试数据进行比较, 探讨力学性能可控的3D打印材料作为软组织再生支架的前景。
1 材料与方法
1.1 材料
本文所用原材料包括PLA、PDS及LA/GA比例分别为10/90、82/18及85/15的PLGA共混高聚物颗粒,分别由法国POLLEN、德国EVONIK及荷兰CORBION提供,产品基本规格参数见表1。
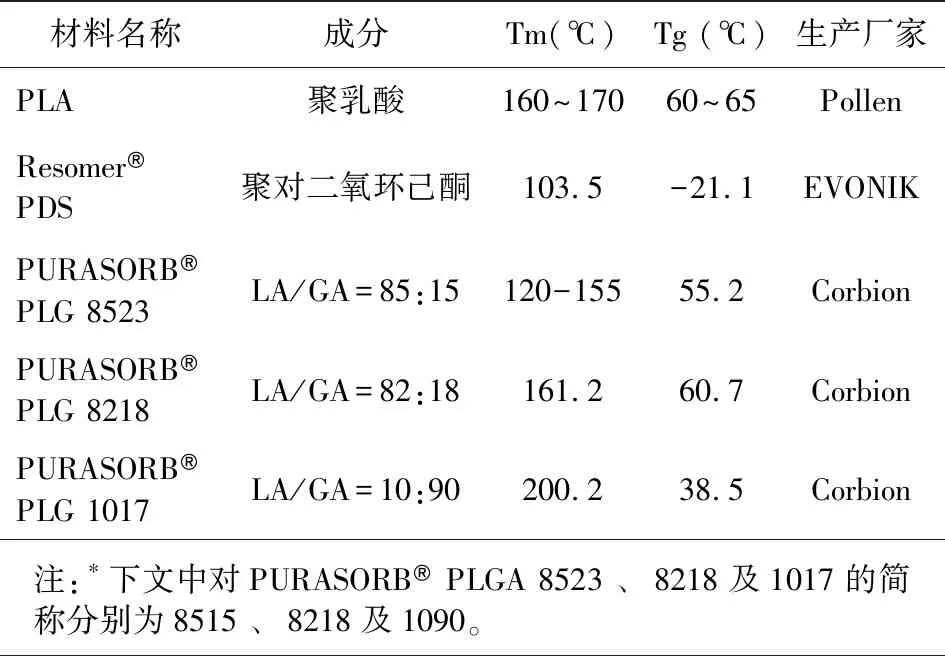
表1 PLA﹑PDS及PLGA高聚物颗粒规格参数Tab.1 Specifications of PLA, PDS and PLGA pellets
1.2 样条制备
本文参考ASTM-D638、ASTM-D695及ASTM-D790分别进行单轴向拉伸及压缩实验的样品制备及测试,试样规格如图1所示。首先,在SolidWorks中画出试样模型,随后将模型保存为stl格式导入3D打印切片软件Ultimaker Cura中,设定打印参数以制备出打印质量统一的样品。最后导出gcode文件上传至多材料3D打印机(Pollen PAM Series P)开始制备实验样品。根据实验种类,样品质量安排见表2。
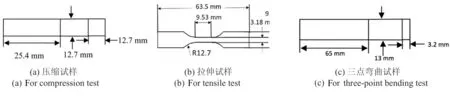
图1 测试试样规格Fig.1 Dimensions of the samples
1.3 力学性能
本文使用Instron(100 kN)多功能力学试验机对所有样品进行单轴向拉伸、压缩及三点弯曲实验。实验分别按照ASTM D638、D695及D790所述进行,实验环境温度为25 ℃、相对湿度为40%。试验机拉伸、压缩及弯曲单元位移速率分别为5 mm/min、1.3 mm/min及2 mm/min,拉伸实验隔距为9.53 mm。在试样破坏后立即停止并记录各项测试数据及实验图像,每组实验测试5个试样(n=5)。
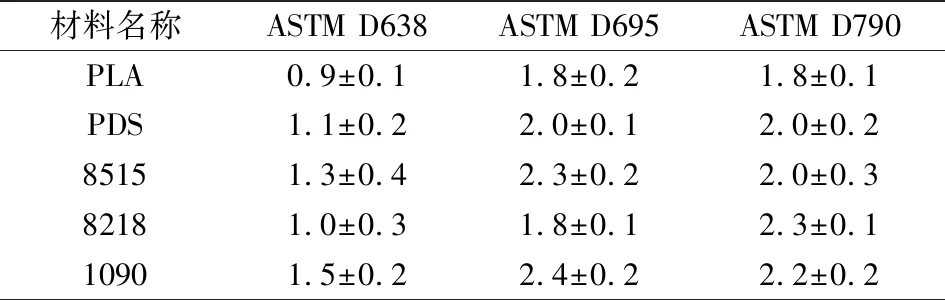
表2 实验样条质量(g)Tab.2 Mass of the samples(g)
2 结果与讨论
2.1 拉伸性能
实验结果见图2~图4所示。用8218所制备的试验样条具有最大的拉伸应力,即161.3±9.0 MPa。从材料硬度的角度来看,8218的弹性模量为1.8±0.1 GPa,比8515低了40.0%±0.2%,意味着8218的抗拉伸能力优于8515而且比后者更为柔顺。1090的拉伸弹性模量与8218相近(P>0.05),然而其最大抗拉伸应力比后者小38.6%±3.5%。
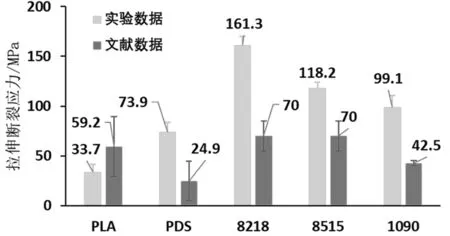
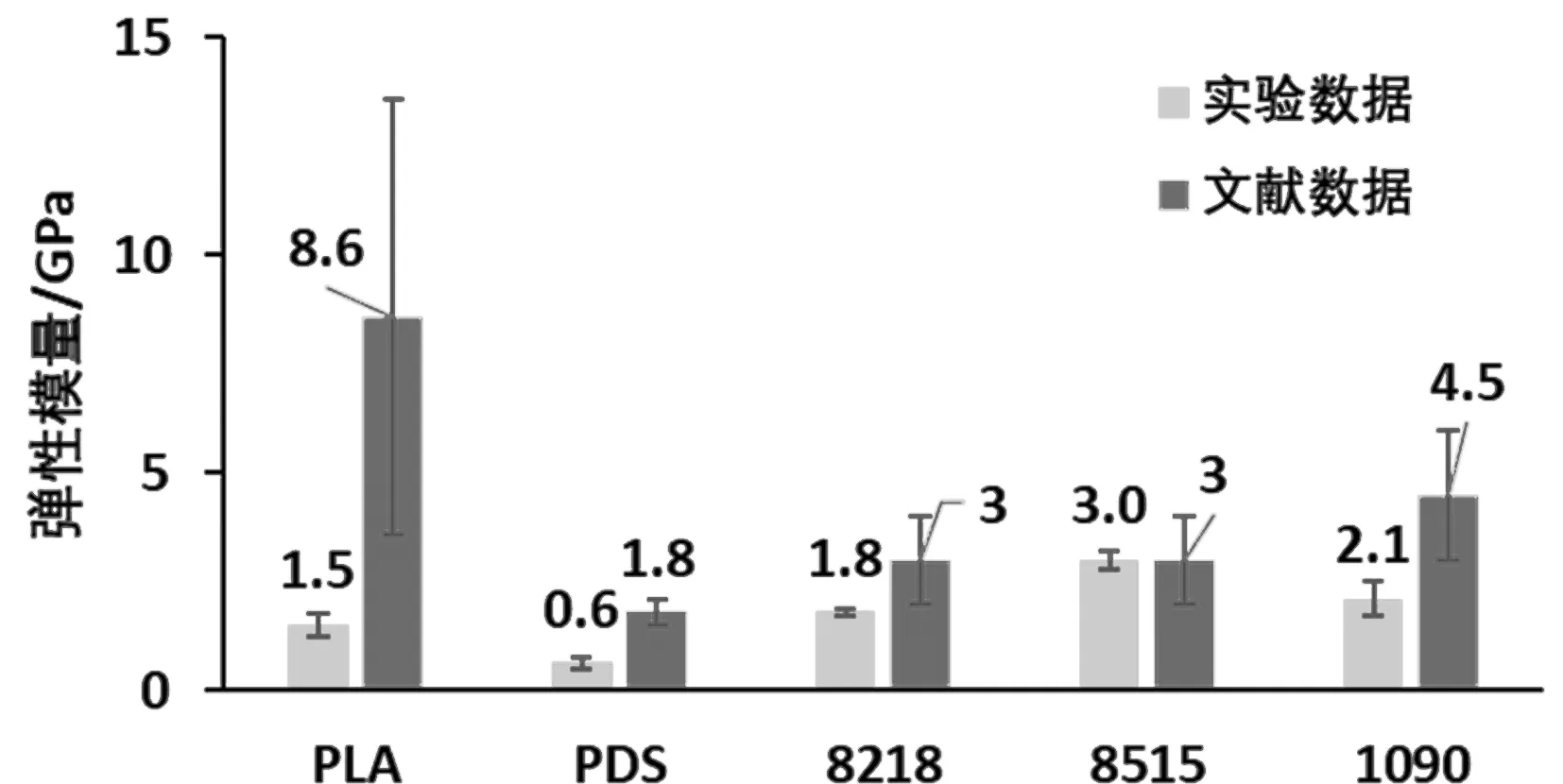
图2 单轴拉伸断裂应力Fig.2 Uni-axialultimate tensile stress图3 拉伸弹性模量Fig.3 Tensile elastic modulus
然而, 就断裂伸长来看,PDS展现了无可替代的优势,是拉伸断裂伸长最小的PLA的近993%。同时,PDS的弹性模量为0.6±0.1 GPa,显示了其高弹性。通过与文献数据[6,11-13]比对后发现,除了PLA样条外,其余材料通过3D打印成型后,在拉伸强度方面普遍高于文献中通过模压成型的实验样条。而3D打印成型的PLA样条也展现了与文献中相近(P>0.05)的拉伸力学表现。
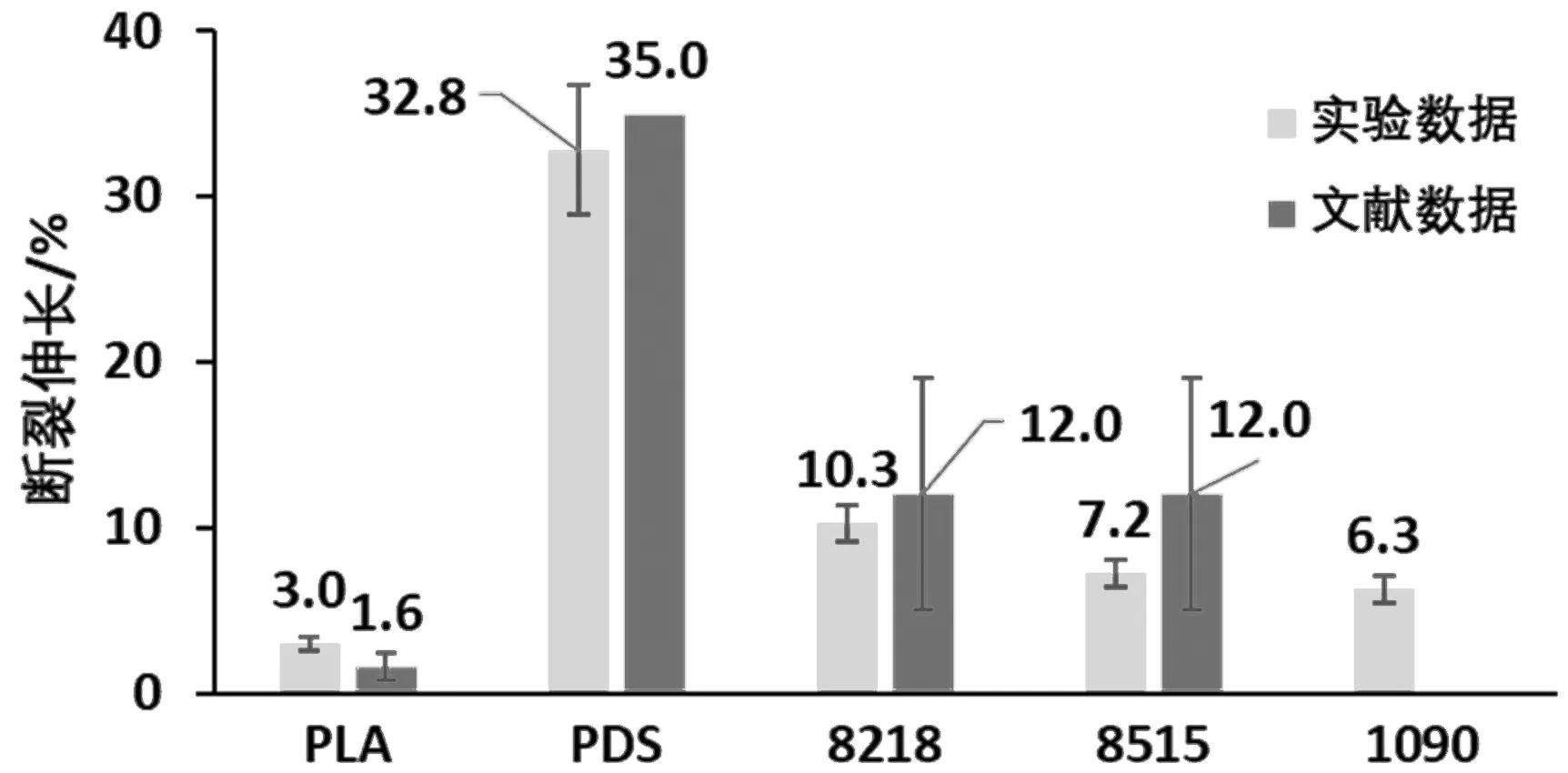
图4 单轴拉伸断裂伸长Fig.4 Uni-axial tensile strains at break
越来越多的研究讨论了组织再生过程中细胞粘附、增殖、迁移与基质刚性、弹性等力学性能的关系。在Zhao等[14]的研究中,人体脂肪细胞对水凝胶的黏附率从水凝胶弹性模量为0.15 kPa时的0.25%增长到4 kPa时的2.5%。对于软组织再生而言,选择合适力学性能的可降解基底材料尤为重要。
2.2 压缩实验
单轴向抗压缩实验结果见图5~图6。PLGA 8515和PLGA 1090显示了最大的抗压缩应力,分别达到37.7±12.6 MPa和37.3±8.2MPa,是抗压缩应力最小的PDS的270%。
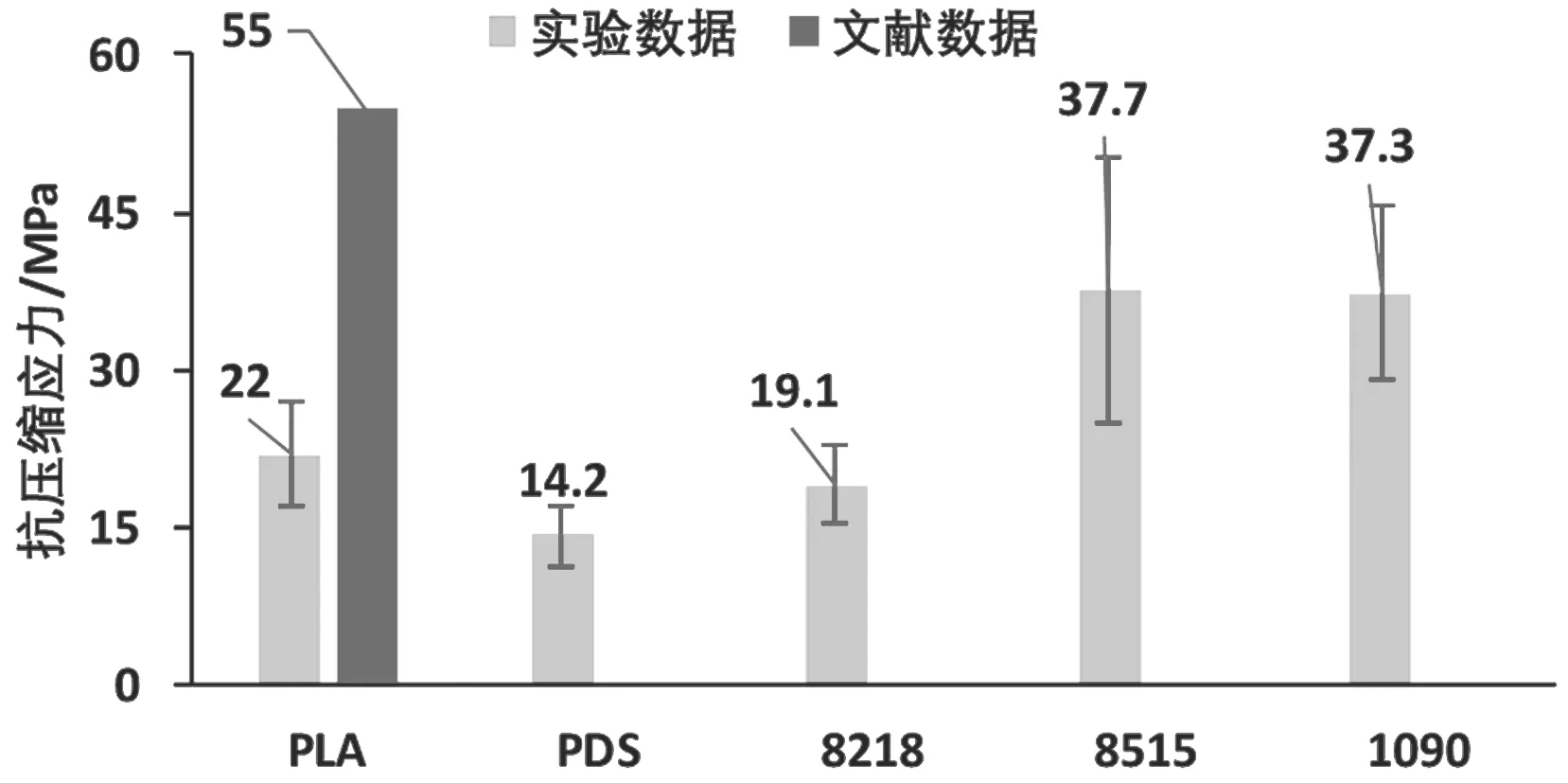
图5 抗压缩应力Fig.5 Ultimate compression stress
同时,PLGA 1090是其中抗压弹性模量最高的试样,其弹性模量达到了0.81±0.30 GPa,而PDS样条的弹性模量最低,为0.26±0.01 GPa(图6),是以上5种生物材料中最容易变形的材料。
PLA的单轴向抗压缩最大应力实验数据与文献数据出现了较大的差异(图5),原因可能在于3D打印时的填充率。因此,测试填充率分别为25%、50%、75%以及100%的PLA试样的静态抗压缩实验,结果如图7所示。可以发现,试样抗压缩应力随填充率增加而增加,在填充率为75%时,PLA试样抗压缩应力达到58.2±3.0MPa,已超过文献数据(55 MPa)。因此,要想获得力学性能可控的可降解高聚物材料,可通过调整3D打印参数而快速实现。

图6 抗压缩弹性模量Fig.6 Compressive elastic moldulus

图7 PLA试样抗压缩应力随填充率变化Fig.7 Compressive stress of PLA samples as a function of the infill rate
另外,从成型工艺来看,文献中多用模压成型的方法来加工实验样条,而本研究采用3D打印熔融层积成型。因此,两种样条内部不同的填充结构造成了样条密度差异,这种差异对材料的力学性能亦有重要影响。可通过调节打印填充率、填充结构及喷头流量等参数来调控其力学性能,以获得预期的抗压缩应力[6]。
2.3 三点弯曲实验
由图8及图9可见,PDS样条的弯曲模量约为8515的2.5%,反映了极佳的抗弯曲形变性能。同时,除PLGA 1090样条外,其余样条都呈现了比文献数据高(P<0.05)的抗弯曲应力,进一步证实了除抗拉伸及抗压缩性能以外,通过3D打印成型的生物可降解材料同样也可以获得优异的抗弯曲性能。由于材料中层(即材料受弯曲作用时不发生形变的纤维层)以上以压应变为主,而中性层以下受拉应变为主,若3D打印制备试样拉伸性能与压缩性能都接近甚至优于文献中模压成型试样,则其抗弯曲性能也将优于文献数据(P<0.05)(如PLA、8218与8515)。
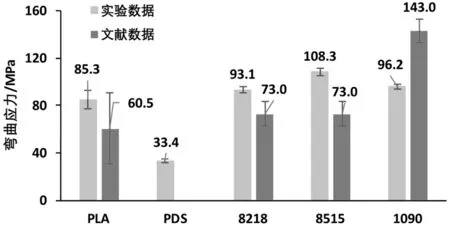
图8 弯曲应力Fig.8 Bending stress
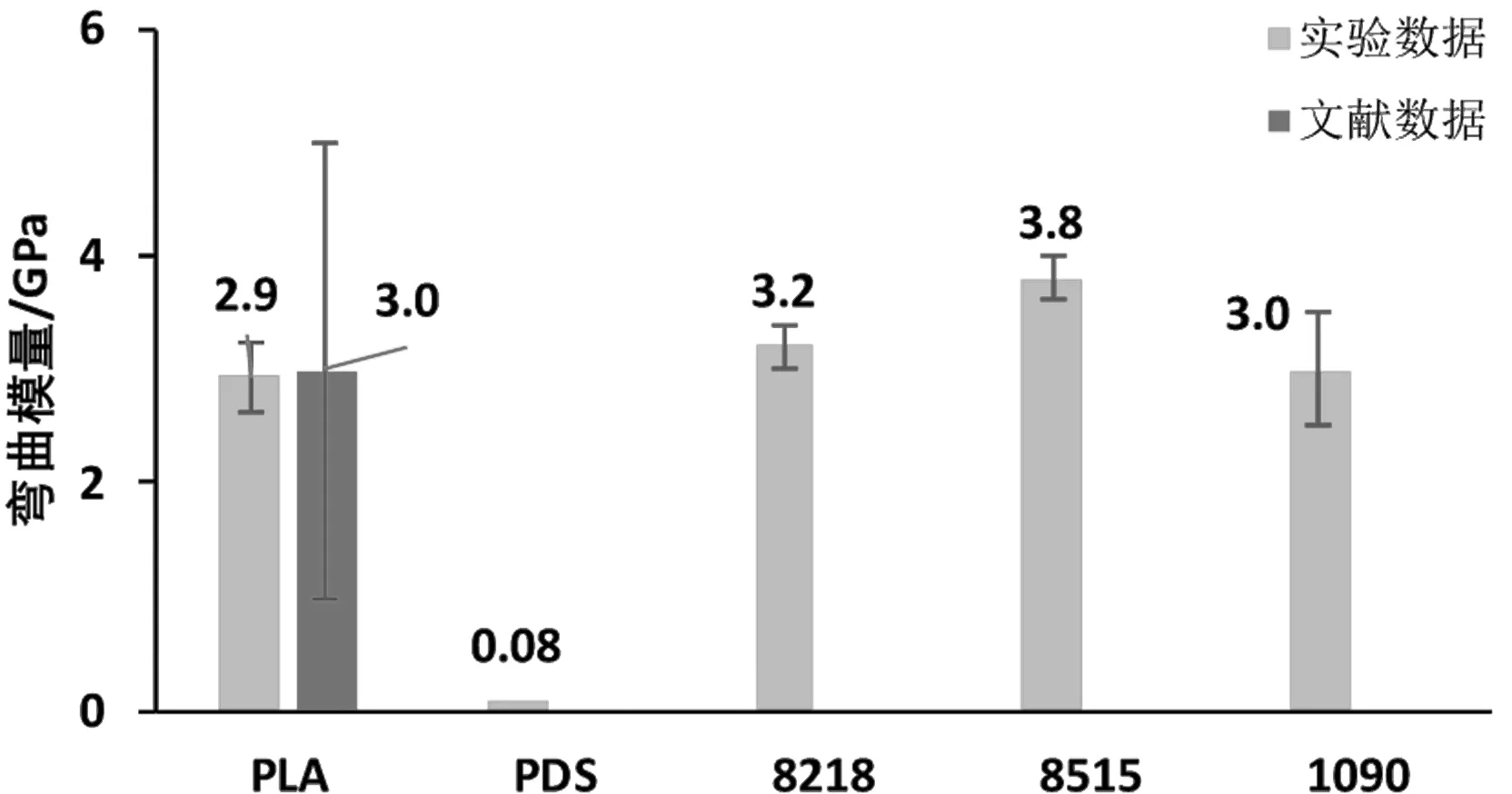
图9 弯曲模量FIG.9 Bending modulus
根据以上结果可见,一般情况下,材料最大弯曲应力大于其最大压缩应力而小于其最大拉伸应力(P<0.05)。由于在弯曲试验中,试样上表面受到压应力,下表面受到拉应力,而试样初次断裂只发生在一个表面,即上或下表面,这造成了材料主要受拉伸影响的下表面断裂应力小于拉伸试验中的断裂应力。然而,材料上表面受到来自多个方向的压缩应力,因此其断裂应力往往大于压缩试验中材料的断裂应力。
总之,与文献中模压成型高聚物材料相比,通过3D打印技术,不但可以快速设计、精确成型所需材料,还可以通过控制相应的打印参数极为方便地获得理想的综合力学性能。国际上,BellaSeno(德国)、Tensive(意大利)及Neopec(澳大利亚)等团队在软组织再生方面做了较多的工作。BellaSeno及Neopec已经分别进入到临床前和临床实验阶段并取得了令人满意的实验结果,脂肪组织生长充分完整,未有明显炎症反应[15]。BellaSeno团队所研究的PDLLA支架上,脂肪组织填充率在15周后上升了25%。Neopec团队采用不可降解的PMMA(聚甲基丙烯酸甲酯)在女性患者身上进行了6~12个月的实验,脂肪组织生长率最高可达150%。而Tensive已发表多项基于软组织再生支架设计的学术成果[16],该团队所使用的PAMAM(聚乙二胺)发泡支架弹性模量为4.5 kPa左右,在重复载荷作用(200次)下其模量保持稳定,且体外培养脂肪细胞结果良好。因此,通过合理设计结构可以获得有利于细胞生长的综合性能,与可降解高聚物相结合,利用3D打印技术精确、快速成型力学性能可控的软组织再生支架,该领域研究将迎来重要进展。
3 结语
本文研究了3D打印标准样品的力学性能,包括抗拉伸、抗压缩及抗弯曲性能,且均能控制在文献报道的范围内,说明 3D打印技术在调控组织工程支架力学性能方面具有明显优势。组织工程支架的结构及力学性能对软组织再生具有重要影响的事实已被证实,因此3D打印技术不仅极大地拓宽了可降解生物医用高分子材料在组织工程领域中的应用。而且,让制备同时具有高伸长、高抗压缩、高拉伸及高抗弯曲强度的可降解生物医用材料支架成为可能,这将在多种软组织再生研究中发挥重要作用。