pH对盐酸胍/Ⅰ型胶原分散体系触变性的影响
2019-04-10狄雯雯吴晓航李艳戴肖南
狄雯雯,吴晓航,李艳,戴肖南
(齐鲁工业大学 化学与制药工程学院,山东济南 250353)
Ⅰ型胶原作为具有三股螺旋结构的棒状生物大分子,在生物学上具有一些优良的特征,如低免疫原性、生物可降解性及止血性等[1-2],目前已成为生物工程材料及组织工程基底材料的首选[3-4]。
在胶原的应用过程中,胶原分子的变性及分散体系的流变性一直是人们关心的问题。本课题组曾研究了盐酸胍(GuHCl)对Ⅰ型胶原的变性作用,以及对胶原分散体系流变性的影响,发现在不同条件下,盐酸胍/Ⅰ型胶原分散体系可分别呈现出正触变性、负触变性及复合触变性特征[5]。为了系统研究胶原分散体系在变性后的流变行为,本文进一步研究了盐酸胍/Ⅰ型胶原分散体系在不同pH条件下的触变性,所得结果将有助于加深对触变性产生机理的认识。
1 实验部分
1.1 主要试剂及仪器
胃蛋白酶(活性1∶3 000)及彩虹245广谱蛋白马克(分子量范围11~245 kD),由上海索莱宝生物科技有限公司提供;GuHCl,由国药集团化学试剂有限公司提供。DHR-2型旋转流变仪(美国TA公司)、LGJ-10D型冷冻干燥机(北京四环)、GL-20G-Ⅱ型高速冷冻离心机(上海安亭)、JY-SCZ2型双垂直电泳槽(北京君毅)。
1.2 胶原的提取
采用胃蛋白酶降解法提取Ⅰ型胶原蛋白[5]。
1.3 GuHCl/胶原体系的配制
用Tris-HCl缓冲溶液(c=0.05 mol/L)配制胶原分散体系,胶原浓度为3 mg/mL;分别调节体系的pH值至酸性(pH=5.0)、中性(pH=7.2)及碱性(pH=9.0,11.0)条件;然后加入盐酸胍,使盐酸胍在分散体系中的浓度分别为0.25 mol/L、1.0 mol/L及2.0 mol/L;加入盐酸胍12 h后开始触变性测定实验。实验温度固定为(25.0±0.1)℃。
1.4 实验方法
体系触变性的测定采用DHR旋转流变仪锥板测量系统(直径40 mm,夹角2°)。先将所有样品放置在测量板上,静置10 min,然后再进行触变性的测定实验。首先,采用高速预剪切(D=1 000 s-1,t=60 s)破坏样品体系内部原有的结构;剪切停止后,采用小幅振荡剪切法,在线性黏弹区(f=1 Hz,τ=1 Pa)考察体系结构的恢复过程:若随时间的延长,体系复合黏度|η*|的数值升高,说明体系为正触变性体系;若|η*|的数值降低,则为负触变性体系;若|η*|先升高,达到最大值后又开始降低,则为复合触变性体系。
2 实验结果与机理探讨
2.1 胶原的结构表征
提取的猪皮胶原凝胶电泳图谱如图1所示。从图谱中可以看出,胶原分子主要由二条α链(α1,α2)和一条β链组成。二条α链的分子量皆为100~135 kDa;并且α1链谱带的宽度约为α2链的2倍,颜色也较α2链深,表明胶原分子中α1链的含量约为α2链的2倍。以上凝胶电泳结果说明,所制备的胶原为典型的Ⅰ型未变性胶原。图1结果还显示,在胶原分子中还存在β链(二聚体)和γ链(三聚体),说明在胶原分子内和分子间还存在多种交联结构。此外,在体系中加入β-巯基乙醇(β-ME)后,胶原的凝胶电泳谱带没有发生改变,与原来的一致,说明胶原中不含有二硫键。

图1 胶原凝胶电泳图
所提取猪皮胶原的红外光谱如图2所示,含有5个特征吸收峰,分别是酰胺A、酰胺B、酰胺Ⅰ、酰胺Ⅱ及酰胺Ⅲ,分别对应于3 315、3 073、1 641、1 552及1 244 cm-1。以上结果与文献一致[6],进一步说明所提取的猪皮胶原为Ⅰ型胶原。

图2 胶原蛋白红外光谱图
2.2 pH对胶原分散体系触变性的影响
不同pH条件下,纯胶原分散体系的触变性测定结果如图3所示。图3显示,在体系结构的恢复过程中,随着时间的延长,体系的|η*|先缓慢升高,当超过500 s(pH=5.0或pH=7.2)或超过1 000 s(pH=9.0或pH=11.0)后,复合黏度|η*|随t迅速上升,最终曲线趋于平缓,均表现为正触变性。
由文献[7]可知,通过自组装,胶原分子之间可以有序地排列成网状、层状或错列的纤维结构,这种纤维的直径和长短都会随着外界因素的改变而改变。在高速预剪切过程中,较高的外加剪切力可以部分破坏这种网络结构,表现为体系的黏度降低。在结构的恢复过程中,胶原分子之间可以重新进行自组装,缓慢形成新的网络结构,表现为体系的|η*|随时间逐渐升高,呈现出正触变性特征。
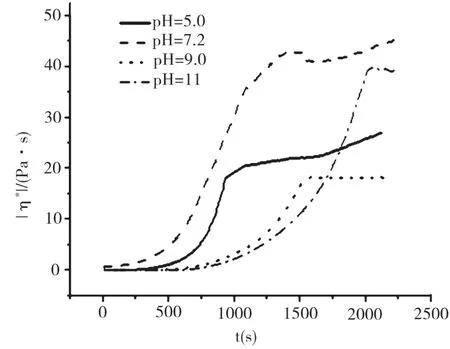
图3 pH对纯胶原分散体系触变性的影响(胶原浓度:3 mg/mL)
当pH=7.2时,3 mg/mL的纯胶原分散体系黏度值最大,酸性或碱性条件均可导致胶原分散体系黏度不同程度的下降,这与汪海波等[8]人的研究结果一致。但在pH=11.0的条件下,结构恢复后的胶原分散体系的黏度又有所升高,这主要归因于在强碱性体系中,胶原表面的净负电荷大量增加,从而形成比较强的排斥力,造成胶原纤维之间各类次级键断裂,二级结构和三级结构也因此遭到毁坏,使得胶原纤维由规则的聚集体转变为松散的无规状态,使得胶原分散体系黏度上升[9]。
盐酸胍浓度为0.25 mol/L时,不同pH条件下胶原体系触变性的测定结果如图4所示。图4结果显示,在体系结构的恢复过程中,4种pH不同的盐酸胍/胶原分散体系的|η*|随t均上升,最终趋于平缓,表现为正触变性特征。

图4 pH对0.25 mol/L的盐酸胍/胶原分散体系触变性的影响
盐酸胍作为一种典型的氢键破坏剂,可以使胶原分子的构象和聚集态结构发生变化。当含量较低时(c=0.25 mol/L),盐酸胍只能削弱胶原分子之间的相互作用力,但无法使胶原变性[10],胶原体系的结构仍以网络结构为主,所以体系的复合黏度|η*|随t均上升,呈现出正触变性特征。
当pH值为7.2、9.0和11.0时,|η*|随t先急剧升高,后趋于平缓,说明与酸性条件(pH=5.0)相比,中性和碱性条件更有利于胶原体系的恢复过程。
盐酸胍浓度为1.0 mol/L时,在不同pH条件下测定的胶原体系的触变性结果如图5所示。由图5可以看出,当pH为7.2时,体系的|η*|在前250 s内迅速升高,达到最大值后又明显降低,表现为复合触变性;而当pH为5.0、9.0和11.0时,体系的|η*|随t降低,表现为负触变性。
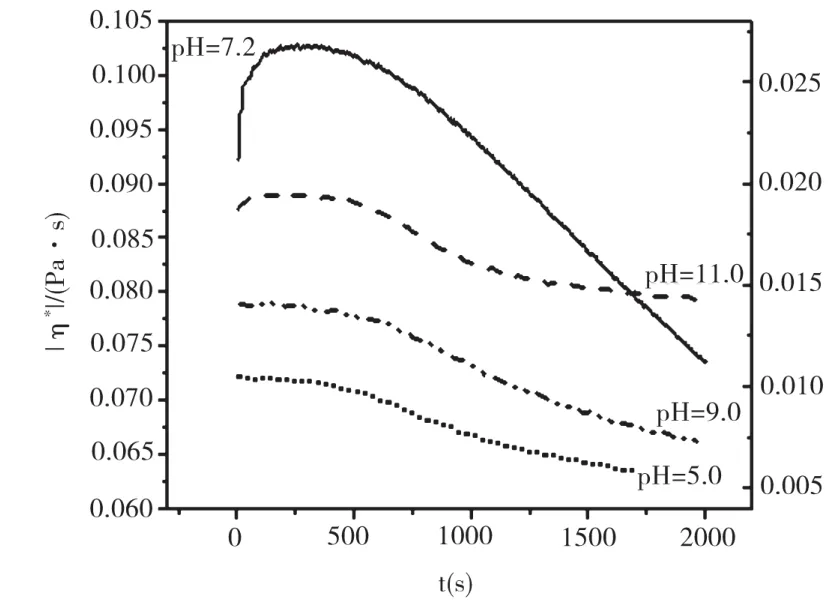
图5 pH对1.0 mol/L的盐酸胍/胶原分散体系触变性的影响
在中性条件下,当浓度增大到1.0 mol/L时,盐酸胍可以使少量胶原分子发生变性,在一定程度上破坏了胶原体系的网络结构;高速预剪切时,较高的外加剪切力进一步破坏了体系的网络结构,形成了一些尺寸较大的聚集体。而在结构恢复过程中的前250 s内,这些尺寸较大的聚集体之间可以相互聚集,从而使体系的黏度升高;但随着测定时间的延长,盐酸胍可以二次破坏胶原分子内和分子间的氢键,使体系的黏度随时间再次降低,整个结构的恢复过程总体表现为复合触变性特征。而当胶原体系的酸性或碱性增加时(pH为5.0、9.0和11.0),使得聚集体之间的相互排斥作用增强,不易相互靠近形成网络结构,因此体系粘度随时间降低,表现出负触变性。
盐酸胍浓度增大至2.0 mol/L时,不同pH条件下胶原体系触变性的测定结果如图6所示。可以看出,当预剪切停止后,在4种pH值条件下,体系的复合黏度随时间的延长迅速降低,约200 s后趋于平缓,呈现出负触变性特征。

图6 pH对2.0 mol/L的盐酸胍/胶原分散体系触变性的影响
当浓度较高时,盐酸胍对胶原的变性作用更为显著,能够使胶原分子解聚集,甚至破坏胶原分子的三螺旋结构,使多肽链发生解离[11]。在结构的恢复过程中,解离出的肽链发生卷缩,致使体系的黏度进一步降低,表现出负触变性特征。而酸性及碱性条件加剧了盐酸胍对胶原的解聚集作用,使体系结构恢复平衡时的粘度值远低于中性胶原体系。
3 结论
盐酸胍作为一种典型的氢键破坏剂,可以使胶原发生构象和聚集态结构的变化,而pH值可以影响这种变化过程。当浓度增加至1.0 mol/L时,盐酸胍可以使少量胶原分子发生变性,体系在中性条件下表现为复合触变性,而在酸性或碱性条件下表现出负触变性。而当盐酸胍浓度增加至2.0 mol/L时,盐酸胍可以诱导胶原分子解聚集直至解螺旋,使得胶原体系在所研究的pH范围内,皆表现为负触变性,酸性及碱性条件能够加剧盐酸胍对胶原的解聚集作用,使结构恢复平衡时体系的黏度值远低于中性胶原体系。
