莲不同药用部位的体外抑菌作用初探
2019-04-09金清
金清
(长江大学动物科学学院,湖北 荆州 434025)
张巍
农业部畜禽细菌病防治制剂创制重点实验室,湖北武汉430064 湖北省农业科学院畜牧兽医研究所,湖北武汉430064
程磊,郭利伟
(长江大学动物科学学院,湖北 荆州 434025)
莲(NelumbonuciferaGaertn.)为睡莲科莲属多年生水生草本植物,是一种常见的药食两用经济作物[1]。我国莲资源充足,利用莲资源开发加工的产品主要有莲子、藕粉、莲饮料、莲脯等。临床上,荷叶、莲房、莲子、莲子心、藕节等莲类药材均可作为药物用来治疗多种疾病[2,3]。莲的相关研究自20世纪60年代开始,主要集中于90年代。长期以来,化学成分的研究重点主要集中在莲子心、荷叶以及莲房上,其中又以莲子心、荷叶的研究较多,但相关研究都不够系统深入,而作为莲非可食部分的莲房却一直被视为废弃物丢弃,利用价值不高[4~6]。对于莲的不同药用部位,无论是化学成分还是药理作用,都值得进行更深入系统的研究,以期获得结构较为完整或生物活性较好的化合物,为莲的研究提供有价值的基础资料,同时还可解决农业废弃物的利用问题,具有显著的经济效益和社会效益。
本研究比较了莲不同药用部位(莲子心、莲房、荷叶)对金黄色葡萄球菌、副溶血弧菌、肺炎克雷伯菌的抑菌作用效果,以期为系统研究利用药用植物莲提供研究思路。
1 材料与方法
1.1 材料
1.1.1 试验菌种
肺炎克雷伯菌、副溶血弧菌、金黄色葡萄球菌均保藏于农业部淡水鱼类种质资源与生物技术重点开放实验室,试验前分别进行增菌培养,调整菌液浓度为1×107CFU/mL。
1.1.2 试验药物的准备
莲子心为安徽友信药业有限公司产品,生产批号150303;莲房为江西顺福堂中药饮片有限公司产品,产品批号150801;荷叶为湖北聚瑞中药饮片有限公司产品,生产批号150401。
称取粉碎好的干莲子心50g,加入30倍量的80%乙醇,85℃回流提取2次,每次提取30min,合并提取液,浓缩,减压干燥,用蒸馏水稀释至相应浓度,121℃灭菌20min,4℃保存备用。
称取粉碎好的莲房50g,加入30倍量的50%乙醇,85℃回流提取2次,每次提取45min,合并提取液,浓缩,减压干燥,用蒸馏水稀释至相应浓度,121℃灭菌20min,4℃保存备用。
称取粉碎好的荷叶50g,加入30倍量的70%乙醇,85℃回流提取2次,每次提取30min,合并提取液,浓缩,减压干燥,用蒸馏水稀释至相应浓度,121℃灭菌20min,4℃保存备用。
1.2 莲不同药用部位的体外抑菌试验
1.2.1 各药物工作液的制备
分别精确称取上述莲不同药用部位干浸膏0.2g,用蒸馏水稀释,将药液浓度调整为20mg/mL,115℃灭菌20min,4℃保存备用。取若干已灭菌试管,以每10支试管为一列并编号,每一列第1个试管中加入1.8mL各自菌株适宜液体培养基,其余试管则加入1.0mL与第1管相同的培养基,然后于第1试管加入各药物200μL,混匀后取出1.0mL放入第2试管中,依次梯度稀释直到第10管。
1.2.2 菌悬液的制备
将3种菌种接种于3mL普通肉汤培养基,于全温振荡器中(37℃、200r/min)扩大培养至对数生长期。然后在营养琼脂固体培养基和肉汤培养基中连续划线接种、接种扩大培养2次,以确保菌株的数量和活力(固体培养基培养条件:37℃、12~24h)。试验前,分别吸取对数生长中期的细菌培养液1.0mL,用二倍稀释菌液浓度法进行细菌计数,调整菌液浓度至1×107CFU/mL备用。
1.2.3 体外抑菌作用的测定
采用平板打孔法[7]。根据文献[8]介绍的标准判定各药物工作液的抑菌作用:抑菌圈直径小于10mm为低度敏感,10~15mm为中度敏感,15mm以上为高度敏感。
1.3 莲不同药用部位对各细菌最小抑菌浓度(MIC)的测定
各药物工作液的制备与1.2.1相同,但以每12支试管为一列并编号,第11和第12管不做处理;菌悬液的制备方法与1.2.2相同。接着将1~11试管中加入已准备好的菌悬液(1×108CFU/mL)5μL,第11个试管为阳性对照,而第12个试管不做处理作为阴性对照。然后将试管置于恒温培养箱中(37℃、12~24h)静置培养。12h和24h后分别在适宜的光线下观察试管中菌液生长情况。从疑似无混浊的试管中吸取50μL菌液涂于营养琼脂平板,培养24h后观察,以菌落数少于5个的平板对应的药物浓度作为该药液对相应细菌的最小抑菌浓度(MIC)。试验重复3次。
1.4 莲不同药用部位的最小杀菌浓度(MBC)测定
取若干已灭菌处理的试管,每7个试管为一列,按照1.2.1中方法制备各药物工作液,每一列第1个试管中加入的药物终浓度为药物对该菌株的16MIC,混匀后试管二倍稀释操作至第5个试管,弃1.0mL培养基。取1.2.2中的菌悬液(1×108CFU/mL)5μL分别加入1~6管,第6个试管为阳性对照,第7个试管不做处理作为阴性对照。然后将试管置于恒温培养箱中(37℃、12~24h)静置培养。12h和24h后分别取样液划线接种于各自适宜的固体培养基上,于37℃孵育48h。观察有无细菌生长。从疑似无混浊的试管中吸取50μL菌液涂于营养琼脂平板,培养24h后观察,以无菌生长的平板对应的最低浓度作为最小杀菌浓度(MBC)。试验重复3次。
1.5 莲不同药用部位抑制细菌生长曲线的测定
将各菌液分别分装于6个50mL的锥形瓶中,每个锥形瓶15mL。然后将各药物加入其中的5个锥形瓶中,使其药物终浓度分别为1/16MIC、1/4MIC、1/2MIC和1MIC,对照组加入相应培养基。
将上述6个50mL锥形瓶置于恒温震荡培养箱中(37℃、200r/min)培养,分别于0、4、8、12、18、24h测量1次其光密度D600nm值,然后绘制光密度-时间曲线。
2 结果与分析
2.1 莲不同药用部位的体外抑菌试验结果
莲子心提取物对3种细菌的抑菌圈直径分别为6、6、9mm;莲房提取物对金黄色葡萄球菌的抑菌圈直径为25mm,对副溶血弧菌的抑菌圈直径为10mm;荷叶提取物对3种供试菌种的抑菌圈直径分别为11、12和8mm(表1)。

表1 莲不同药用部位提取物的体外抑制3种细菌的抑菌圈直径
2.2 莲不同药用部位的最小抑菌浓度(MIC)
通过试管二倍稀释法测得的MIC结果见表2。结果显示,莲子心提取物对副溶血弧菌的最小抑菌浓度(MIC)为15.625mg/mL;莲房提取物对金黄色葡萄球菌的最小抑菌浓度(MIC)为15.625mg/mL,对副溶血弧菌的最小抑菌浓度(MIC)为62.5mg/mL;荷叶提取物对3种供试菌种的最小抑菌浓度(MIC)分别为62.5、125、500mg/mL。

表2 莲子心、莲房、荷叶提取物的最小抑菌浓度MIC和最小杀菌浓度MBC
注:“-”表示没有抑菌作用。
2.3 莲不同药用部位的最小杀菌浓度(MBC)
根据2.2中的试验结果,分别测定莲子心提取物对副溶血弧菌的MBC,莲房提取物对金黄色葡萄球菌和副溶血弧菌的MBC,荷叶提取物对金黄色葡萄球菌、肺炎克雷伯菌和副溶血弧菌的MBC。结果显示,莲子心提取物对副溶血弧菌的MBC为其MIC的4倍,莲房和荷叶提取物对3种供试菌的MBC基本上为其MIC的4~8倍。其中,莲房提取物对金黄色葡萄球菌和副溶血弧菌的MBC分别为62.5mg/mL和500mg/mL,荷叶提取物对金黄色葡萄球菌、肺炎克雷伯菌和副溶血弧菌的MBC分别为250、1000mg/mL和2000mg/mL。
如果MBC≥32MIC,则说明细菌对所试药物产生了耐药性,因此本研究中3种供试菌菌株对莲子心、莲房和荷叶提取物均未产生耐药性。
2.4 莲不同药用部位提取物对细菌生长的影响
2.4.1 莲子心提取物对副溶血弧菌生长的影响
副溶血弧菌在不同浓度莲子心提取物的作用下,其生长曲线如图1所示。图1结果显示,当药物浓度为1/16MIC、1/4MIC和1/2MIC时,莲子心提取物对副溶血弧菌的生长几乎不产生任何影响。当浓度为1MIC时,莲子心提取物基本上能完全抑制副溶血弧菌的生长。

图1 莲子心提取物对副溶血弧菌的生长曲线
2.4.2 莲房提取物对金黄色葡萄球菌和副溶血弧菌生长的影响
金黄色葡萄球菌和副溶血弧菌在不同浓度莲房提取物的作用下的生长曲线分别如图2、图3所示。
图2结果显示,对于金黄色葡萄球菌,当药物浓度为1/16MIC和1/4MIC时,莲房提取物对金黄色葡萄球菌的生长几乎不产生任何影响;当药物浓度为1/2MIC时,莲房提取物对金黄色葡萄球菌的生长产生一定的影响,但是根据其生长趋势,随着时间的延长,金黄色葡萄球菌在这一条件下菌体数也能如不加药的对照组一样;当浓度为1MIC时,莲房提取物基本上能完全抑制金黄色葡萄球菌的生长。
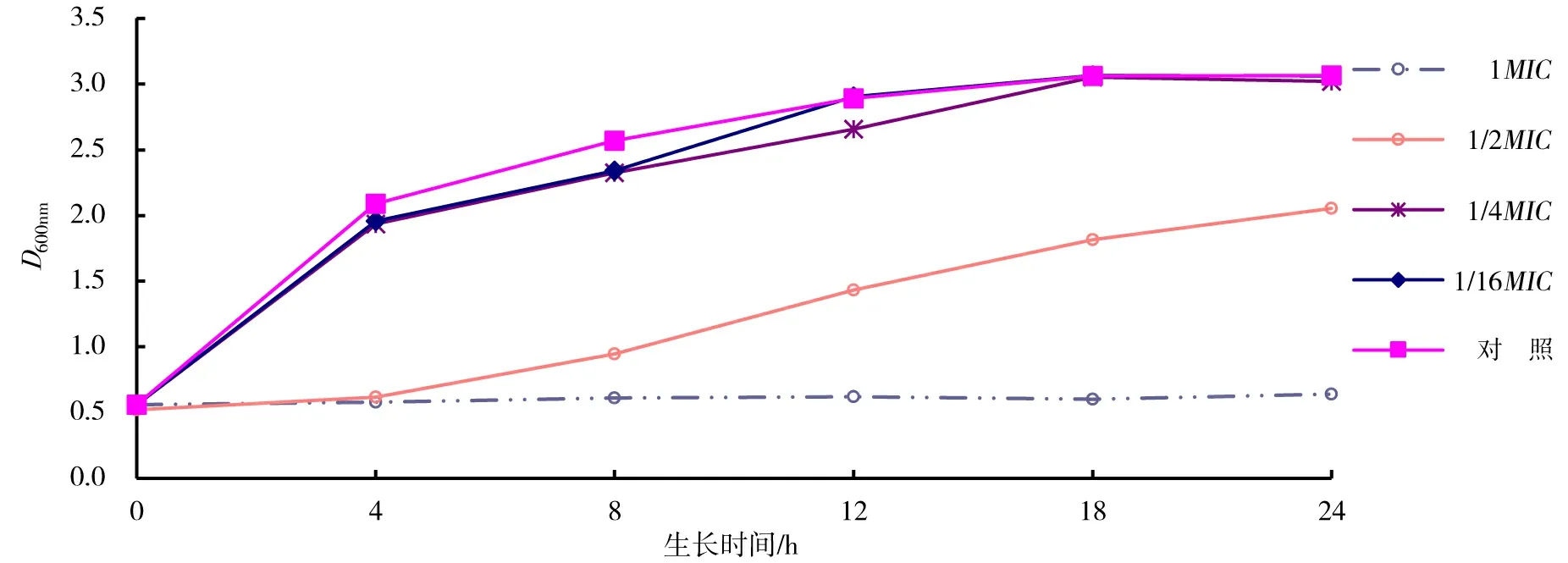
图2 莲房提取物对金黄色葡萄球菌的生长曲线

图3 莲房提取物对副溶血弧菌的生长曲线
图3结果显示,副溶血弧菌不受莲房提取物对其生长影响的药物浓度为1/16MIC、1/4MIC和1/2MIC。当药物浓度为1MIC时,莲房提取物基本上能完全抑制副溶血弧菌的生长。
2.4.2 荷叶提取物对金黄色葡萄球菌、肺炎克雷伯菌和副溶血弧菌生长的影响
金黄色葡萄球菌、肺炎克雷伯菌和副溶血弧菌在不同浓度荷叶提取物的作用下的生长曲线分别如图4~图6所示。
图4结果所示,当药物浓度为1/16MIC、1/4MIC和1/2MIC时,荷叶提取物对金黄色葡萄球菌的生长几乎不产生任何影响。当药物浓度为1/2MIC时,荷叶提取物对金黄色葡萄球菌的生长产生一定的影响,但是根据其生长趋势,随着时间的延长,金黄色葡萄球菌在这一条件下菌体数也能如不加药的对照组一样。当浓度为1MIC时,荷叶提取物基本上能完全抑制金黄色葡萄球菌的生长。
图5结果显示,当药物浓度为1/16MIC和1/4MIC时,荷叶提取物对肺炎克雷伯菌的生长不产生影响。当药物浓度为1/2MIC时,荷叶提取物对肺炎克雷伯菌的生长产生一定的影响,但是根据生长趋势,随着时间的延长,肺炎克雷伯菌在这一条件下菌体数也能如不加药的对照组一样。当药物浓度为1MIC时,荷叶提取物基本上能完全抑制肺炎克雷伯菌的生长。
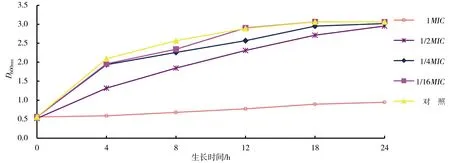
图4 荷叶提取物对金黄色葡萄球菌的生长曲线

图5 荷叶提取物对肺炎克雷伯菌的生长曲线
图6结果显示,药物浓度为1/16MIC、1/4MIC和1/2MIC时,荷叶提取物对副溶血弧菌的生长不产生影响。当药物浓度为1MIC时,莲房提取物基本上能抑制副溶血弧菌的生长。
3 讨论
近年来,滥用抗生素导致的细菌耐药性问题日益突出,严重影响人类的健康和动物性产品的安全,已成为当前和未来养殖业的一个顽症[9]。而我国医药工作者早在20世纪50年代即开始了中药抑菌作用与抑菌成分的研究,并发现许多具有抗菌作用的中药[10],且其药源广泛、价格低廉及作用靶位多,并有增强机体免疫力、不易产生耐药性等优点[11,12]尤其在一些慢性感染过程中和急性感染的后期使用中草药不仅能抗菌消炎,还具有全面的调理作用,因此系统地研究中药的抑菌活性,进一步开发研究新的抗菌药物,成为越来越多学者关注的目标,这对开发和利用我国宝贵的中药植物资源具有十分重要的意义[13]。

图6 荷叶提取物对副溶血弧菌的生长曲线
莲除具有观赏价值外,对Pb2+、Zn2+、Cd2+等重金属离子具有吸附作用,对净化水体中的总磷、总氮有明显的作用[14]。据报道,莲子心总黄酮对沙门氏菌、金黄色葡萄球菌、假单胞菌、大肠埃希菌、枯草芽孢杆菌等细菌有抑菌活性[15,16]。白秀君等[17]发现荷叶乙醇提取物对大肠杆菌有较强的抑制作用。本研究结果也显示,莲子心、莲房、荷叶等莲的不同药用部位对不同细菌的生长有一定的抑制作用,尤其是对水产养殖常见菌副溶血弧菌和肺炎克雷伯菌的抑菌作用效果明显,能够为植物莲在水产养殖中的应用及其研究提供有价值的科学根据,同时还可解决农业废弃物的利用问题,具有显著的经济效益和社会效益。
