产ε-聚赖氨酸白色链霉菌的化学诱变育种
2019-04-09尤丽新胡楠楠
尤丽新,胡楠楠,班 硕
(1.长春科技学院 生命科学学院,吉林 长春 130600;2.吉林农业大学 食品科学与工程学院,吉林 长春 130118)
随着人们对食品安全意识的增强,食品天然防腐剂逐渐出现在大众视野中,其包括植物源、动物源、微生物源天然抗菌防腐剂三大类型。微生物发酵得到有抑菌作用的物质称为微生物源天然抗菌防腐剂。微生物源天然抗菌防腐剂相对于植物源、动物源天然抗菌防腐剂具有数量大、成本低、周期短、抑菌谱广、稳定性强等优点。乳酸链球菌素、纳他霉素及ε-聚赖氨酸为目前主要使用的微生物防腐剂[1]。其中ε-聚赖氨酸易溶于水、耐高温、安全性高,可以抑制真菌、革兰氏阳性菌、革兰氏阴性菌、霉菌以及某些病毒的生长[2]。
化学合成的聚赖氨酸为α型[3]且具有毒性[4],因此,目前普遍采用发酵法来生产ε-聚赖氨酸。ε-聚赖氨酸通常是由白色链霉菌属(Streptomyces albus)合成,然而经过初步筛选得到的野生菌产ε-聚赖氨酸能力有限。为了提高ε-聚赖氨酸产生菌的合成能力,对野生菌进行一定的改造具有重要的意义。KAHAR P等[4]以亚硝基胍为诱变剂对白色链霉菌410进行化学诱变,最终筛选出一株ε-聚赖氨酸摇瓶产量为2.11 g/L的双抗高产突变株,其产量是野生菌的10倍;陈玮玮等[5]使用化学诱变剂硫酸二乙酯对北里孢菌(Kitasatospora)PL6-3进行化学诱变,筛选到一株ε-聚赖氨酸摇瓶产量为1.2g/L的高产菌株,其产量是未诱变前的3倍;李双双等[6]采用物理诱变复合化学诱变对白色链霉菌8号菌株进行诱变,筛选到一株ε-聚赖氨酸摇瓶产量为0.73 g/L的突变菌株,其产量是未诱变前的2.2倍。近年来,还有一些研究团队使用新技术用于筛选ε-聚赖氨酸高产菌。LI S等[7]采用基因重排技术获得了一株禾粟链霉菌(Streptomyces graminearus)F3-4,ε-聚赖氨酸摇瓶产量是出发菌株的1.5倍;ZONGH等[8]利用常压等离子诱变小白链霉菌(Streptomyces albulus)A-29,ε-聚赖氨酸产量是未诱变前的3.8倍。
本试验以白色链霉菌BNCC186223为出发菌株,硫酸二乙酯为诱变剂,采用化学诱变法对其进行诱变,考察最佳诱变条件,并筛选一株高产ε-聚赖氨酸的菌株,为我国规模化生产ε-聚赖氨酸提供有效的方法。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
白色链霉菌(Streptomyces albus)BNCC186223:北纳创联生物技术有限公司。
1.1.2 试剂
甲基橙(分析纯):济南萧试化工有限公司;亚甲基蓝(分析纯):无锡市亚泰联合化工有限公司;硫酸二乙酯(99.7%):天津市富鑫商贸有限公司;ε-聚赖氨酸标准品(纯度99.5%):重庆赛普那斯科技有限公司;其他均为分析纯试剂。
1.1.3 培养基
链霉菌培养基2号(ISP-2)[9-10]:酵母膏4.0 g,麦芽浸粉10.0 g,葡萄糖4.0 g,琼脂20.0 g,蒸馏水定容至1 L,pH为7.0~7.4,121℃灭菌20 min。
贝特纳培养基[11]:葡萄糖10 g,酵母膏1 g,蛋白胨2 g,琼脂18g,蒸馏水定容至1L,调pH至7.5,121℃灭菌20min。
初筛培养基(含亚甲基蓝的贝特纳培养基)[9-10,12]:葡萄糖10 g,酵母膏1 g,蛋白胨2 g,琼脂18 g,亚甲基蓝0.05 g,蒸馏水定容至1 L,调pH至7.5,121℃灭菌20 min。
液体发酵培养基[12-13]:葡萄糖50g,酵母膏5g,(NH)42SO410 g,磷酸氢二钾0.8 g,磷酸二氢钾1.36 g,MgSO4·7H2O 0.5 g,FeSO·47H2O 0.03 g,ZnSO·47H2O 0.04 g,蒸馏水定容至1 L,调pH至6.8,121℃灭菌20 min。
1.2 仪器与设备
SW-CJ-2FD双人单面净化工作台:苏州净化设备有限公司;L5紫外可见分光光度计:上海精密科学仪器有限公司;YXQ-LS-70A高压蒸汽灭菌锅:上海博迅实业有限公司医疗设备厂。
1.3 方法
1.3.1 菌体活化[14-15]
在无菌条件下,打开安瓿瓶,吸取0.5 mL无菌蒸馏水将菌粉溶解,取适量的孢子悬液接种至ISP-2斜面培养基,30℃恒温培养7 d。取活化后的斜面种子一环接种于贝特纳斜面培养基,30℃恒温培养7 d。
1.3.2 诱变育种
单孢子菌悬液的制备[14,16]:待分离纯化的斜面菌种孢子成熟铺满斜面,用生理盐水洗下孢子,倒入装有玻璃珠的三角瓶中振荡,使孢子分散,用八层纱布过滤,得到单孢子悬液,采用血球计数法调整孢子浓度至108CFU/mL[13]。
硫酸二乙酯诱变处理[14,17-18]:分别取硫酸二乙酯原液和体积分数为95%的乙醇等体积混合,加入5mL单孢子悬液,于200 r/min条件下振荡处理,处理后立即添加等量的25%硫代硫酸钠终止反应,静置10 min,10 000 r/min离心5 min,弃上清,采用pH6.9、0.1mol/L的磷酸盐缓冲溶液(phosphate buffer saline,PBS)洗涤两次,再加入10 mL磷酸盐缓冲液于旋涡混合器上混匀。
稀释涂布[17-18]:将诱变后的孢子悬液梯度稀释至10-1、10-2、10-3、10-4,选择10-2、10-3、10-4稀释孢子悬液分别涂布于贝特纳培养基。以未经硫酸二乙酯诱变的孢子稀释液(孢子浓度为108CFU/mL)作对照,30℃条件下恒温培养7 d后进行菌落计数。
存活率和致死率[10]:对培养好的平板进行菌落计数。以对照组平板菌落数为基准,计算经硫酸二乙酯处理后每毫升菌液中的孢子存活率和致死率,计算公式如下:

1.3.3 高产ε-聚赖氨酸诱变菌株的初筛[17-19]
将诱变后的白色链霉菌孢子接种于含亚甲基蓝的贝特纳培养基,于30℃恒温箱中培养7 d。亚甲基蓝是一种碱性染料,当微生物分泌产生带正电产物时,由于静电作用,将排斥亚甲基蓝而形成独特透明圈,菌落周围蓝色较浅。ε-聚赖氨酸是阳离子表面活性物质,含有氨基,在水中带正电。根据ε-聚赖氨酸与菌株间的静电作用使菌落周围产生透明圈的原理,对高产ε-聚赖氨酸菌的诱变菌株进行初步筛选。计算透明圈直径(H)与菌落直径(C)的比值,即H/C值。一般H/C值越大,ε-聚赖氨酸产量越高;H/C值越小,则ε-聚赖氨酸产量越低。因此,根据H/C值作为筛选高产ε-聚赖氨酸诱变菌株的指标。
1.3.4 高产ε-聚赖氨酸诱变菌株的复筛
分别将2 mL出发菌株BNCC186223与经初筛的诱变菌株孢子(108CFU/mL)接种于装有40 mL贝特纳液体培养基的250mL三角瓶中[19],30℃、200r/min条件下培养72h,以其作为种子液。
以6%(V/V)的接种量将种子液接种于装有50 mL发酵培养基的500 mL三角瓶中[19],30℃、200 r/min条件下培养72 h。测定发酵液中的生物碱物质及ε-聚赖氨酸含量。
1.3.5 生物碱物质的测定
采用碘化铋钾(dragendorff)反应测定发酵液中的生物碱物质[14]。ε-聚赖氨酸是由单一L-赖氨酸的α-羧基和ε-氨基形成酰胺键而连接而成的聚氨基酸,是一种生物碱物质。生物碱物质分别与两种Dragendorff试剂(即改良的碘化铋钾试剂和碘化钾碘试剂)发生反应产生沉淀,如果出现桔红色沉淀和棕褐色沉淀,可以证明该菌株发酵后可以产生生物碱物质。
发酵液经6 000r/min离心15 min,取2 mL上清液分别与2 mL改良的碘化铋钾试剂和碘化钾碘试剂反应,然后观察现象[10]。
1.3.6 ε-聚赖氨酸含量的测定
采用甲基橙比色法测定发酵液中ε-聚赖氨酸的含量[20]。
ε-聚赖氨酸标准曲线的绘制:准确称取ε-聚赖氨酸0.05g、0.10 g、0.15 g、0.20 g、0.25 g,采用pH 6.9、0.1 mol/L的磷酸盐缓冲液(phosphate buffered saline,PBS)溶解并定容至1 L。取等量不同质量浓度的ε-聚赖氨酸溶液与等量1 mmol/L的甲基橙溶液混合均匀,于30℃、200r/min条件下反应30min,6 000r/min离心15min,上清液经pH 6.9、0.1 mol/L的PBS适当稀释后,以PBS为基准,于波长465 nm条件下测定吸光度值,以ε-聚赖氨酸质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制ε-聚赖氨酸标准曲线。
发酵液中ε-聚赖氨酸含量的测定:发酵液经6000r/min离心15 min,上清液取代ε-聚赖氨酸溶液后,按照ε-聚赖氨酸标准曲线的测定法进行测定OD465nm值,根据ε-聚赖氨酸标准曲线计算出发酵液中ε-聚赖氨酸的含量。
2 结果与分析
2.1 诱变时间对菌株致死率的影响
出发菌株BNCC186223的孢子悬液经20μL/mL硫酸二乙酯分别诱变处理20 min、25 min、30 min、35 min、40 min、45 min、50 min,诱变时间对菌株致死率的影响结果见图1。
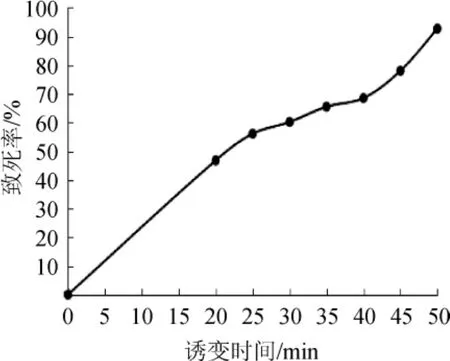
图1 诱变时间对菌株BNCC 186223致死率的影响Fig.1 Effect of mutagenesis time on the lethality of strain BNCC 186223
由图1可知,采用20 μL/mL的硫酸二乙酯对白色链霉菌孢子悬液诱变处理45 min时,菌株的致死率为78.06%。根据遗传育种的经验,诱变菌株的致死率在70%~80%范围内最佳[16]。因此,确定硫酸二乙酯最佳诱变处理时间为45 min。
2.2 硫酸二乙酯含量对菌株致死率的影响

图2 硫酸二乙酯含量对菌株BNCC 186223致死率的影响Fig.2 Effect of diethyl sulfate concentration on the lethality of strain BNCC 186223
出发菌株BNCC 186223的孢子悬液分别经5 μL/mL、10μL/mL、15μL/mL、20μL/mL、25μL/mL硫酸二乙酯诱变处理45 min,硫酸二乙酯含量对菌株致死率的影响见图2。
由图2可见,采用10 μL/mL硫酸二乙酯对白色链霉菌孢子悬液诱变处理45 min时,菌株的致死率为74.81%,在70%~80%范围内。因此,确定硫酸二乙酯最佳诱变含量为10 μL/mL。
2.3 高产ε-聚赖氨酸诱变菌株的初筛
通过初筛共获得48株产ε-聚赖氨酸的突变菌株,编号为DES-1~DES-48,其中5株突变菌株的H/C值比出发菌株BNCC 186223大,具体结果见表1。

表1 5株突变菌株的H/C值Table1 H/C value of 5 mutant strains
由表1可知,出发菌株BNCC186223的H/C值为1.43±0.03,5株突变菌株中,突变菌株DES-27的H/C值最大,为2.25±0.02,突变菌株DES-3的H/C值(2.16±0.03)次之,突变菌株DES-7的H/C值(1.67±0.01)最小。因此,挑选突变菌株DES-27进行碘化铋钾(Dragendorff)反应,验证菌株的发酵代谢产物为生物碱性物质。
2.4 高产ε-聚赖氨酸诱变菌株的复筛
2.4.1 生物碱物质测定结果
出发菌株BNCC 186223、突变菌株DES-27的发酵液上清液与碘化铋钾试剂和碘化钾碘试剂均出现了明显的絮状沉淀,为碘化铋钾(Dragendorff)阳性反应,说明该白色链霉菌诱变前后均具有ε-聚赖氨酸生产能力。
2.4.2 ε-聚赖氨酸标准曲线

图3 ε-聚赖氨酸的标准曲线Fig.3 Standard curve of ε-polylysine
ε-聚赖氨酸的标准曲线见图3。由图3可知,ε-聚赖氨酸的标准曲线方程为y=-1.452x+0.498,相关系数R2=0.995 5,线性关系良好,可用于发酵液中ε-聚赖氨酸含量的测定。
2.4.3 发酵液中ε-聚赖氨酸含量
出发菌株BNCC 186223和突变菌株DES-27发酵液中ε-聚赖氨酸含量的测定结果见表2。

表2 白色链霉菌BNCC 186223诱变前后发酵液中ε-聚赖氨酸的含量Table2 Content of ε-polylysine in fermentation broth byStreptomyces albusBNCC 186223 before and after mutagenesis
由表2可知,白色链霉菌BNCC 186223经10 μL/mL硫酸二乙酯诱变45 min后,发酵液中的ε-聚赖氨酸含量为2.90 g/L,较诱变前(2.10 g/L)提高38.10%。
3 结论
产ε-聚赖氨酸白色链霉菌BNCC 186223经10 μL/mL硫酸二乙酯诱变45 min,菌株致死率为74.81%;在此诱变条件获得一株高产ε-聚赖氨酸的突变菌株,编号为DES-27;其ε-聚赖氨酸的产量为2.90 g/L,较诱变前(2.10 g/L)提高38.10%。结果表明,采用硫酸二乙酯对产ε-聚赖氨酸的白色链霉菌进行化学诱变,可以提高产ε-聚赖氨酸产量。
