拮抗黄曲霉海洋放线菌的筛选及发酵条件优化
2019-04-09车程川刘金锋巩志金梁光杰
曹 利,车程川,刘金锋,巩志金,梁光杰,杨 革*
(曲阜师范大学 生命科学学院,山东 曲阜 273165)
黄曲霉(Aspergillus flavus)属于腐生真菌,是一种在自然界中普遍存在的霉菌,多寄生于粮食、食品和饲料中并产生黄曲霉毒素。由于黄曲霉污染粮食和饲料所导致的人畜曲霉病病例越来越多[1-3],1993年,世界卫生组织(world health organization,WHO)将其认定为一种天然致癌物,并且毒性极强。目前,抑制黄曲霉采用的主要方法有物理法、化学法和生物法。其中生物法具有安全、高效、耗能少,对产品无污染,不影响其营养价值的优点,因此,黄曲霉的生物脱毒法具有广泛的应用前景。
放线菌(Actinomycetes)一直以来就是天然抗菌活性物质的主要来源,随着深海探测技术的提高,人们将探索的范围延伸到了深海,从海样沉积物中发现了大量的海洋放线菌。目前已发现的1000多种微生物来源的生物活性物质中,大约有2/3的活性物质来自于放线菌的次生代谢物[4],如新生霉素、中生菌素、抑霉菌素[5-7]等。目前,已知很多放线菌代谢产物能够很好地抑制黄曲霉的生长或对黄曲霉毒素进行降解,SCHUMACHER R W等[8]从链霉菌(Streptomycessp.)BD21-2中分离得到一种聚酯醚类化合物Bonactin,该物质具有广谱的抗真菌作用;KLICH M A[9]从低海拔沙漠棉花地分离到多种能抑制黄曲霉的真菌;ONO M等[10]从链霉菌中提取到一种称为aflastatin的物质,质量浓度为0.5μg/mL时就能完全抑制寄生曲霉产生黄曲霉毒素;刘姝等[11]研究发现,放线菌GB-2产生的一种广谱、高活性抗菌物质对黄曲霉具有明显的抑制作用,这对农业的生物防治具有重大的研究价值。但目前为止,国内外还未见将拮抗菌应用于生物防治黄曲霉的报道。
本研究从黄海海域沉积物中筛选出一株能够抑制黄曲霉的海洋放线菌,通过形态观察、生理生化试验及分子生物学技术对其进行鉴定,并通过Plackett-Burman试验、最陡爬坡试验以及响应面试验对其产抗菌物质的发酵条件进行优化。本研究拓展了粮食生产与加工工业中黄曲霉污染的防治途径,为后续该菌株的生产应用开发提供实验来源。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌种
黄曲霉(A.flavus):由中国普通微生物菌种保藏管理中心(Chinageneralmicrobiologicalculturecollectioncenter,CGMCC)提供,保藏号为CGMCC3.3950。
1.1.2 培养基
腐植酸固体培养基(humic acid,HA)[12]:腐植酸1 g,CaCO30.02 g,Na2HPO40.5 g,MgSO·47H2O 0.5 g,KCl 1.7 g,FeSO·47H2O0.01g,维生素B(vitaminB,VB)母液(2μL/mL)1 mL,海水1 L,琼脂20 g,pH 7.4~7.6,115 ℃灭菌30 min,倒板前添加终质量浓度为50 μg/mL的萘啶酮酸抑制细菌的生长,添加终质量浓度为50 μg/mL的重铬酸钾溶液抑制细菌和真菌的生长[13]。
高氏一号固体培养基[14]:可溶性淀粉20 g,KNO31 g,K2HPO40.5 g,FeSO·47H2O 0.01 g,MgSO·47H2O 0.5 g,NaCl 0.5 g,海水1 L,琼脂20 g,pH 7.4~7.6,121 ℃灭菌20 min。液体培养基中不添加琼脂。
发酵基础培养基:麦芽浸粉10 g,葡萄糖4 g,酵母浸粉4 g,海水1 L,pH 7.4~7.6,115 ℃灭菌30 min。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 L,pH自然,115℃灭菌30 min。
1.1.3 试剂
阳性细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒、聚合酶链式反应(polymerase chain reaction,PCR)产物纯化试剂盒:美国Sigma公司;酵母浸粉、麦芽浸粉、琼脂(均为生化试剂):北京奥博星生物技术有限责任公司;其他试剂为国产分析纯。
1.2 仪器与设备
HNY-1102型摇床:天津欧诺仪器股份有限公司;DK-8D型水浴锅、GNP-9080型恒温培养箱:上海精宏实验设备有限公司;3-18K型台式高速冷冻离心机:美国Sigma公司;T100型PCR仪:美国BioRad公司;DYY-6C型核酸电泳仪:北京六一仪器厂;PHS-3C pH计:上海仪电科学仪器股份有限公司。
1.3 方法
1.3.1 放线菌菌株的分离筛选
采用分散和差速离心法(dispersion and differential centrifugation,DDC)[15]对样品进行梯度稀释,分别取稀释度为10-2~10-4的稀释液0.2 mL涂布于腐植酸固体培养基上,30℃条件下静置培养7~14 d。采用高氏一号固体培养基进行分离、纯化。
1.3.2 抑菌活性的测定
种子液的制备:取斜面保藏的菌株B11接种到高氏一号固体培养基上,28℃培养2 d,用打孔器取两菌块接种到高氏一号液体培养基中,200 r/min、28℃振荡培养36 h。
发酵液制备:以2%(V/V)的接种量将种子液接种到装液量为50 mL/250 mL的发酵基础培养基中,200 r/min、28℃条件下振荡培养7d。发酵液经12000r/min离心20min,取上清液备用。
生测平板的制备:待PDA培养基熔化后,温度降至50~55℃时,加入黄曲霉孢子悬液,使孢子浓度为2×104~4×104CFU/mL,混匀,倒入培养皿。
抑菌活性的测定:在生测平板两端各置一直径为8 mm的牛津杯,在牛津杯中各加入200 μL发酵上清液。28℃条件下培养72 h,观察是否出现抑菌圈,并利用十字交叉法测量抑菌圈直径[16],当抑菌圈直径>牛津杯直径(8 mm)时说明有抑菌活性[17]。
1.3.3 菌株的鉴定
形态观察:取少量菌株B11接种到高氏一号固体培养基上,28℃条件下培养7 d,对菌株的菌落形态和细胞形态进行观察[18-19]。
生理生化试验:参照《链霉菌鉴定手册》[20]对筛选菌株进行生理生化试验。
分子生物学鉴定:采用阳性细菌基因组试剂盒提取筛选菌株的基因组DNA,以其为模板对菌株的16SrDNA进行PCR扩增。引物为1(5′-AGAGTTTGATCCTGGCTCAG-3′)和2(5′-AAGGAGGTGATCCAGCCGCA-3′)[21]。PCR扩增体系:模板2μL,2×TaqMix25μL,引物12μL,引物22μL,双蒸水(ddH2O)19 μL。PCR扩增条件:95℃预变性5 min;95℃变性40 s,55℃退火45 s,72℃延伸75 s,共30个循环;72℃再延伸10 min。PCR扩增产物经琼脂糖凝胶电泳检验后,切胶回收,送往上海生工生物工程有限公司测序。测序结果在美国国立生物技术信息中心(national center for biotechnology information)上进行BLAST比对搜索,选取同源性较高的菌株,采用MEGA 6.0中的邻接(neighbor joining,NJ)法构建系统发育树。
1.3.4 菌株产抑菌活性物质发酵条件优化
Plackett-Burman(PB)试验:在单因素的基础上,利用Plackett-Burman设计法从发酵温度(A)、接种量(B)、初始pH值(C)、发酵时间(D)4个影响因素中筛选影响筛选菌株产抑菌活性物质的主要影响因素,每个因素分别取2个水平,Plackett-Burman试验因素与水平见表1。

表1 Plackett-Burman试验因素与水平Table1 Factors and levels of Plackett-Burman tests
最陡爬坡试验:在单因素试验的基础上确定初始pH值为7.0。通过最陡爬坡试验对Plackett-Burman试验设计的各因素结果进行分析,使所选的各个因素水平趋近最大抑菌区域[22],再根据各因素效应值大小确定变化的步长,找出峰值,使其快速地逼近最佳值。
Box-Behnken试验:根据最陡爬坡试验确定的关键因素与水平,以主要影响因素为自变量,以抑菌圈直径为响应值,采用响应面分析法中的Box-Behnken法[23-24]设计响应面试验,拟合得到自变量与响应值之间的回归方程,并绘制因素间相互作用对抑菌圈直径影响的响应面和相应的等高线[16]。
回归模型验证试验:为验证响应面优化建立模型的准确性,对预测的最佳发酵条件和初始发酵条件分别进行摇瓶发酵试验,平行试验3次,结果取平均值[16]。
2 结果与分析
2.1 拮抗黄曲霉菌株的分离与筛选
通过初筛共筛选到105株海洋放线菌,通过牛津杯法对分离出的海洋放线菌的抑黄曲霉活性进行测定,从中分离出4株对黄曲霉具有较强抑制作用的海洋放线菌,编号为B11、C、Y6、M21,各菌株的抑制效果见图1,抑菌圈直径见表2。
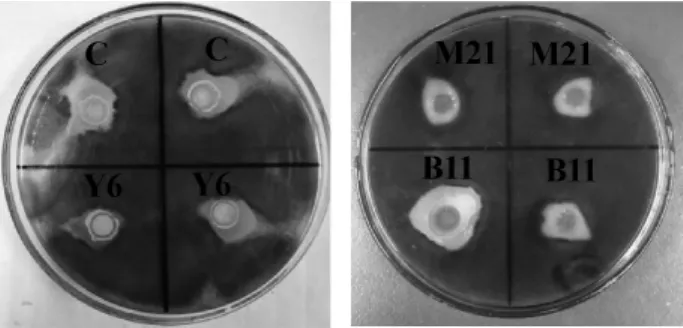
图1 各菌株对黄曲霉的抑制作用Fig.1 Inhibition effect of each strain onAspergillus flavus

表2 各菌株对黄曲霉的抑制作用Table2 Inhibition effect of each strain onAspergillus flavus
由图1及表1可知,菌株B11、C、Y6、M21对黄曲霉均具有抑制作用,其中,菌株B11的抑菌圈直径最大,为(1.4±0.15)cm,抑制效果最好。
2.2 菌株B11的鉴定
2.2.1 形态观察结果
菌株B11的形态观察结果见图2。

图2 菌株B11的菌落形态(a)、显微结构(10×100)(b)和扫描电镜(c)结果Fig.2 Colonial morphology(a),microscopic structure(b)and scanning electron microscope(C)result of strain B11
由图2a可知,菌株B11在高氏一号培养基上生长良好,菌落呈椭圆形、淡黄色,表面呈绒状凸起。由图2b可知,该菌株气生菌丝发达,菌丝纤细,形状多弯曲;成熟后生成了微曲的孢子丝,并有孢子生成。由图2c可知,该菌株基内菌丝丰富,多分支,中间有横隔,不断裂;气生菌丝灰白色,基丝淡黄色,孢子呈长圆形,表面光滑。
2.2.2 生理生化试验结果
菌株B11的生理生化试验结果见表3。由表3可知,菌株B11可利用D-葡萄糖、乳糖、麦芽糖和D-甘露醇作为碳源,不能利用蔗糖、D-核糖、D-木糖、L-阿拉伯糖和肌醇,能液化明胶、利用纤维素、还原硝酸盐、不水解淀粉、不产生类黑色素、酪氨酸酶和H2S、也不能使牛奶凝固或胨化。结合菌株B11的形态观察结果,初步判定其为链霉菌属(Streptomycessp.)。

表3 菌株B11的生理生化试验结果Table3 Results of physiological and biochemical tests of strain B11
2.2.3 分子生物学鉴定结果
菌株B11的系统发育树见图3。由图3可知,菌株B11与锈赤蜡黄链霉菌(Streptomycesrubiginosohelvolus)YJ-RT10聚于一支,亲缘关系最近。结合形态特征及生理生化试验结果,鉴定菌株B11为锈赤蜡黄链霉菌(Streptomyces rubiginosohelvolus)。

图3 基于16S rDNA序列分析菌株B11的系统发育树Fig.3 Phylogenetic tree of strain B11 based 16S rDNA sequences analysis
2.3 菌株B11产抑菌活性物质发酵条件的优化
2.3.1 Plackett-Burman试验结果
Plackett-Burman试验结果与分析见表4,各因素效应分析结果见表5。
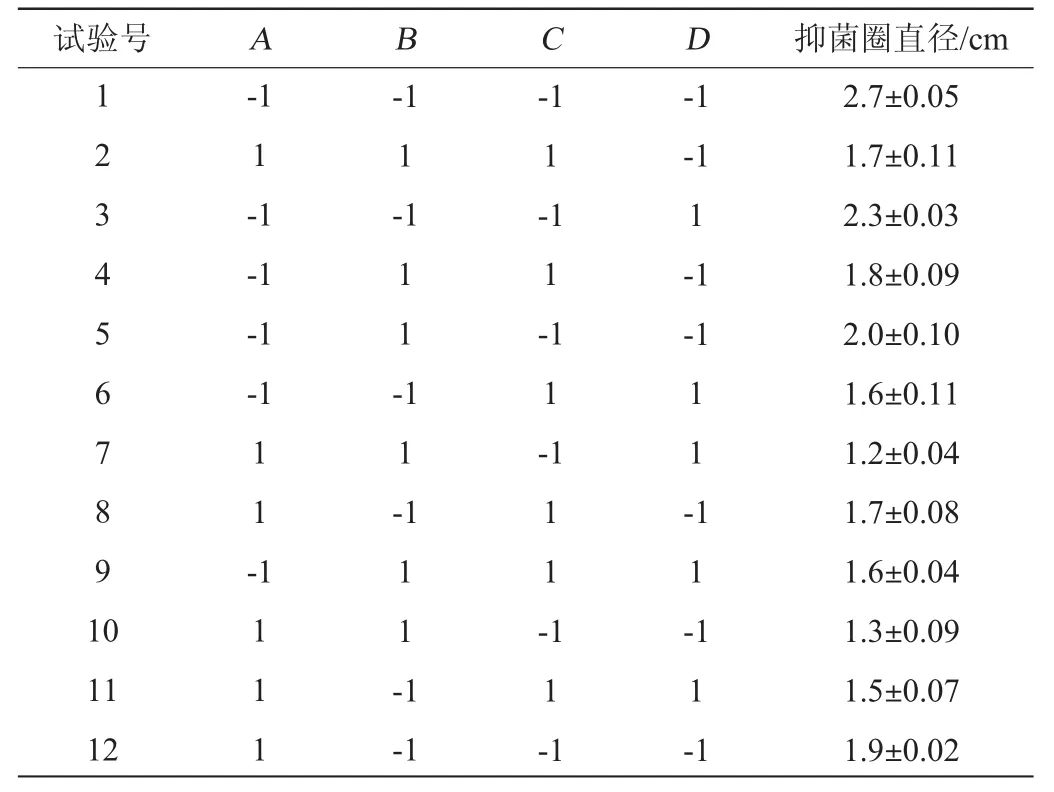
表4 Plackett-Burman试验结果与分析Table4 Results and analysis of Plackett-Burman tests

表5 Plackett-Burman试验各因素效应分析Table5 Effect analysis of each factor of Plackett-Burman tests
由表5可知,该模型结果显著(P<0.05),发酵温度(A)对结果影响极显著(P<0.01),接种量(B)和发酵时间(D)对结果影响显著(P<0.05),而初始pH值(C)对结果影响不显著(P>0.05),因此,可以确定发酵温度、接种量和发酵时间为其主要影响因子。
通过Plackett-Burman试验获得回归方程:抑菌圈直径=1.745 3-0.254 7A-0.204 7B-0.095 3C-0.178 1D。由回归方程可知,发酵温度(A)、接种量(B)、发酵时间(D)的系数均为负数,说明对抑菌圈直径的影响呈负效应。
2.3.2 最陡爬坡试验结果
在PB试验的基础上,将发酵温度、接种量和发酵时间的步长分别定为5℃、1%、2 d,然后以抑菌圈直径(Y)为响应值,发酵温度(A)、接种量(B)及发酵时间(D)为主要影响因素进行最陡爬坡试验,结果见表6。

表6 最陡爬坡试验设计及结果Table6 Design and results of the steepest ascent tests
由表6可知,各因素在第4组试验附近取值时,发酵液的抑菌活性最高,为(2.8±0.09)cm,可知最优发酵条件在第4组附近。因此,选择第4组试验的各因素为Box-Behnken试验的中心点,即发酵温度30℃、接种量5%、发酵时间11d。
2.3.3 Box-Behnken试验结果
根据Plackett-Burman试验和最陡爬坡试验结果以发酵温度(X1)、发酵时间(X2)、接种量(X3)为自变量,抑菌圈直径(Y)为响应值,进行3因素3水平的响应面分析试验。试验因素与水平见表7,试验结果与分析见表8,方差分析结果见表9。

表7 Box-Behnken试验的因素与水平Table7 Factors and levels of Box-Behnken tests
运用Desigin-Expertversion8.0.6设计软件对表8试验结果拟合后得到二次响应面回归方程:Y=2.88-0.12X1-0.10X2+。
由表9可知,模型的P值<0.01,极显著,失拟项的P值为0.728 4,影响不显著(P>0.05),表明该模型可靠,能较好地分析和预测响应值。其中回归方程系数R2=0.981 8,说明该方程与实际情况拟合较好,可信度高,因此,可选用该模型进行放线菌B11产抑菌活性物质发酵条件的预测和分析。其中一次项X1、X3和交互项X2X3对结果影响显著(P<0.05);交互项X1X2、二次项对结果影响极显著(P<0.01);其他项对结果影响不显著(P>0.05)。
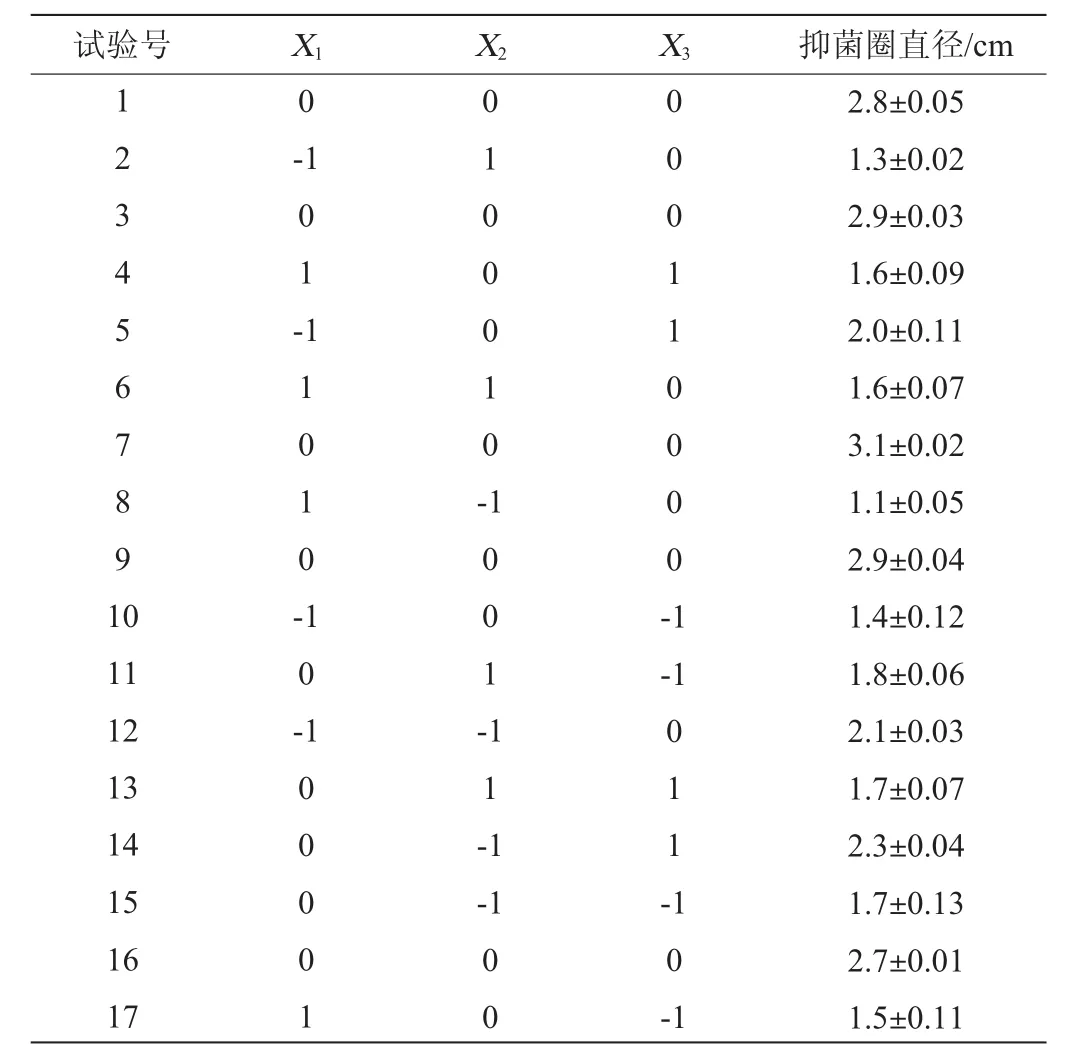
表8 Box-Behnken试验结果与分析Table8 Results and analysis of Box-Behnkentests
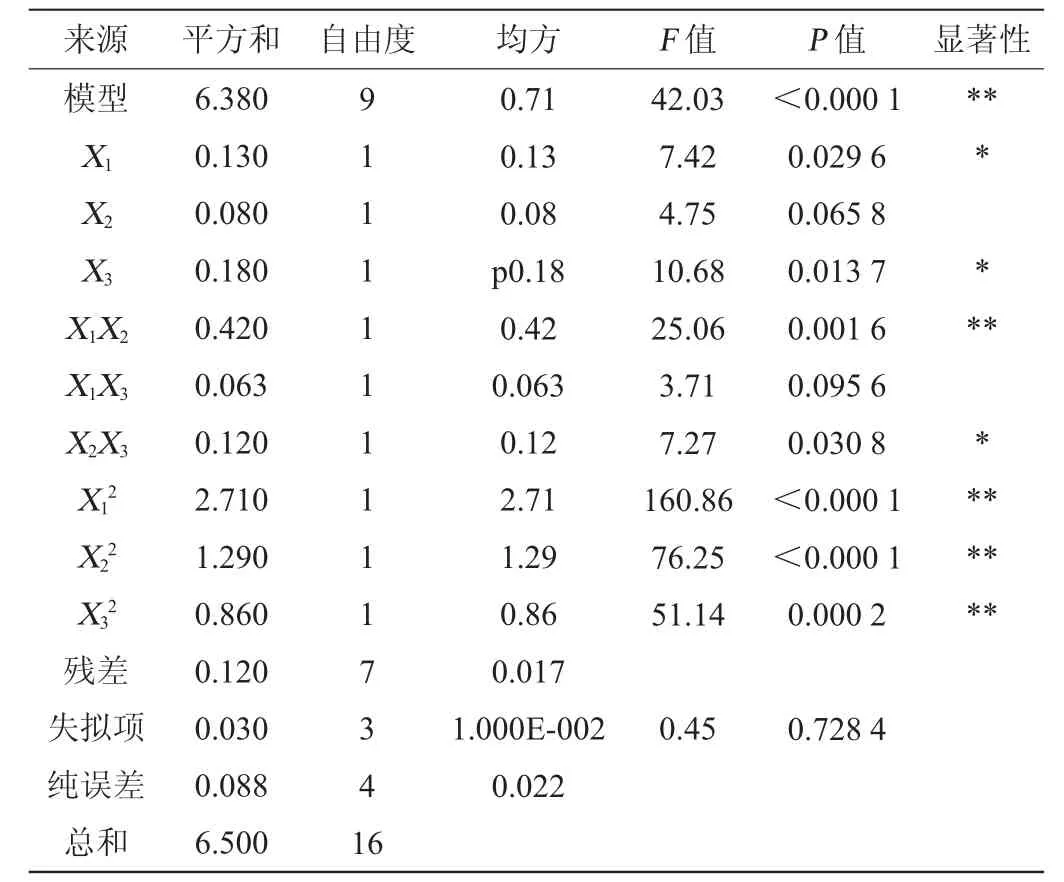
表9 回归模型方差分析Table9 Variance analysis of regression model
2.3.4 响应面分析
交互作用对放线菌B11产抑菌活性物质的影响结果见图4。
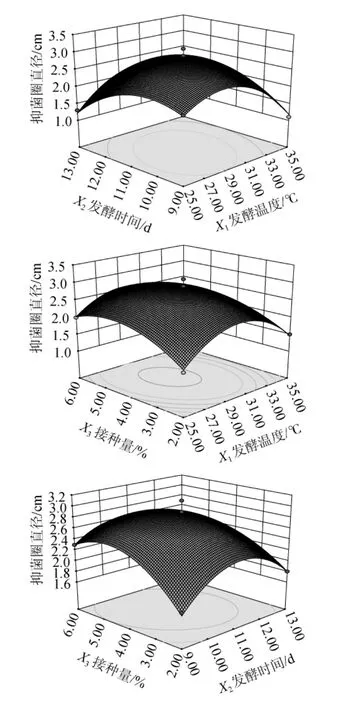
图4 发酵温度、发酵时间及接种量间交互作用对放线菌B11产抑菌活性物质影响的响应面和等高线Fig.4 Response surface plots and contour lines of the effects of interaction between fermentation temperature,time and inoculum on the inhibiting activity substance production byActinomycetesB11
由图4可知,发酵温度和发酵时间、发酵时间和接种量之间的等高线图形为椭圆形,响应面开口向下呈凸型曲面,表明两因素之间交互作用是显著的。而发酵温度和接种量之间的等高线图形为近圆形,响应面开口向下呈凸型曲面,表明两因素之间交互作用是不显著的,且其存在最大值。根据试验结果分析得出,放线菌B11产抑菌活性物质的最优发酵条件:发酵温度29℃、发酵时间11 d、接种量5%。
2.3.5 回归模型的验证
为验证模型的真实性与可靠性,对优化后的发酵条件和初始发酵条件分别进行摇瓶发酵试验,3次重复试验,取平均值。经优化后,菌株B11的抑菌圈直径为(2.9±0.15)cm,与预测值2.91cm接近,抑菌圈直径比优化前(1.4±0.15)cm增大51.72%。说明其优化后的条件能明显提高菌株抑菌活性。
3 结论
本研究从海洋沉积物中筛选出一株能够抑制黄曲霉生长的海洋放线菌B11,经形态观察、生理生化试验及分子生物学鉴定为锈赤蜡黄链霉菌(Streptomyces rubiginosohelvolus);通过PB试验得出影响放线菌B11产抑菌活性物质的主要因素为发酵温度、发酵时间及接种量,通过最陡爬坡试验及响应面试验优化得出其产抑菌活性物质的最优发酵条件:温度29℃、培养时间11 d、接种量5%,在此最优条件下,抑菌圈直径达到(2.9±0.15)cm,较优化前增大51.72%。本研究为生物防治粮食种植与贮藏过程中受到黄曲霉侵染提供了广阔的应用前景。
