hAPOB的克隆、原核表达及抗体效价分析
2019-04-09徐志伟徐一然陈永霞徐小波于建宁
徐志伟,王 期,徐一然,陈永霞,徐小波,于建宁*
(1.江苏丘陵地区镇江农业科学研究所,江苏 句容 212400;2.南京师范大学生命科学学院 江苏 南京 210023;3.江苏大学土木工程与力学学院,江苏 镇江 212013;4.江苏省句容市动物疫病预防控制中心,江苏 句容 212400;5.江苏省农业科学院畜牧研究所,江苏 南京 210014)
【研究意义】载脂蛋白(APOlipoprotein,APO)是指来源于血浆脂蛋白中的蛋白部分[1],APO既是脂蛋白的构成组分,又具有稳定脂蛋白的功能,同时能通过修饰与脂代谢有关的酶活性影响脂肪代谢[2-4]。人载脂蛋白B(hAPOB)在人体脂蛋白代谢中具有重要的生理功能,APOB是低密度脂蛋白(LDL)胆固醇的主要结构蛋白,能够识别LDL受体,参与LDL代谢过程[5-8],由此可见,hAPOB对人体保持体内恒定的血脂水平和介导体内脂类代谢必不可少。基于hAPOB在人体中的重要功能,检测hAPOB对于诊断急性冠状动脉综合症、糖尿病等心血管疾病以及后期临床治疗等方面具有重要的医疗应用价值[9-10]。【前人研究进展】在动物生物技术中,免疫血清制备是一项常用的技术。通过制备高效价、高特异性的免疫血清可以为免疫学诊断提供试剂,亦可用于医学上特异性免疫治疗或者相关医疗研究。要制备免疫血清,抗原是第一位,抗原的纯度、质量好坏直接关系到免疫血清的效价与特异性;另一方面,由于采用大动物生产免疫血清需要的抗原量较大,目前多采用商业化的抗原,成本较高。因此通过免疫大动物获得免疫血清时,如何在提高抗体效价的同时降低抗原成本,是拓宽免疫血清应用的主要限制因素之一。【本研究切入点】本研究中创新性的采用原核质粒表达生产hAPOB抗原,构建了hAPOB的原核表达载体,将大肠杆菌原核表达的hAPOB的蛋白进行纯化后,通过免疫湖羊原核表达的APOB抗原,分析湖羊产生羊抗人血清的效果,通过抗体效价、抗体产生规律和hAPOB产品性能检测,鉴定原核生产hAPOB抗原的性能,【拟解决的关键问题】为后续大规模制备抗hAPOB抗体奠定基础,同时为开发相关免疫检测试剂盒提供了有力保障,更为增加传统畜牧养殖的经济收益提供科学参考。
1 材料与方法
1.1 供试材料
1.1.1 菌种和质粒E.coliDH5α、E.coliBL21(DE3)均由本实验室保存。表达质粒pGEX-4T-1-hAPOB(97-526AA)由南京基诺美生物科技有限公司通过密码子优化全基因合成方法合成hAPOB(97-526AA)片段并成功构建至pGEX-4T-1原核表达载体。
1.1.2 试剂 限制性内切酶XhoⅠ,EcoRⅠ、T4 DNA连接酶、TaqDNA聚合酶、核酸标准相对分子质量购自TaKaRa公司;蛋白质分子量标准购自MBI公司;蛋白胨和酵母粉购自OXOID公司;氨苄青霉素购于Ameresco公司;IPTG购自Merck公司;丙烯酰胺及甲叉双丙烯酰胺购自Promega公司;四甲基乙二胺购自BioRad公司;考马斯亮蓝R-250 购自Sanland公司;胶回收试剂盒及质粒提取试剂盒购自Axygen公司;弗氏完全佐剂和不完全佐剂为Sigma公司产品;其余试剂均为国产分析纯。
1.1.3 试验动物与分组 选用30只健康青年湖羊,体重约35 kg,全部打上耳标,采用群养放牧饲养方式,白天放牧4 h,上午、下午各2 h,晚上添加少量精料,自动饮水,每天早晚各观察1次羊的健康状况。将30只湖羊随机分成3组,每组 10 只,抗原量分别为组1每次0.2 mg,组 2 每次0.4 mg,组3每次1.0 mg。
1.2 试验方法
1.2.1 pGEX-4T-1-hAPOB(97-526AA)原核表达质粒的构建 根据人源的APOB蛋白的全长氨基酸序列(Uniprot ID∶P04114),考虑到全长APOB蛋白序列太长,故利用抗原表位分析软件Dnastar,预测出hAPOB在97-526AA此序列段的氨基酸亲水性、抗原性等参数值最高,于是通过密码子优化全基因合成hAPOB(97-526AA)的DNA序列做为原核表达质粒构建的模板。设计引物, 5′和3′端分别加入EcoRⅠ和XhoⅠ酶切位点。上游引物:5′ CCGGAATTCTGTACCTTAAAAGAAGTTTACG3′;下游引物:5′AAACTCGAGTGCTTTTTGAATCATTAAGCTC 3′。以上述全基因合成的hAPOB的97-526AA序列为模板做PCR:95 ℃5 min,30 ×(94 ℃ 30 s,59 ℃30 s,72 ℃1 min 30 s),72 ℃10 min。对PCR产物和pGEX-4T-1载体分别进行EcoRⅠ和XhoⅠ双酶切,T4 DNA连接酶连接后转化E.coliDH5α感受态细胞。筛选重组质粒阳性克隆进行DNA测序,该重组质粒命名为pGEX-4T-1-hAPOB(97-526AA)。
1.2.2 Gst-hAPOB(97-526AA)融合蛋白的小试诱导表达及鉴定 将上述重组质粒pGEX-4T-1-hAPOB(97-526AA)转化宿主菌E.coliBL21(DE3),平板上挑取3个克隆,接种于含100 mg·L-1氨苄青霉素的LB液体培养基,37 ℃振荡培养使OD600达到0.8~1,加IPTG至终浓度为1 mM,离心收集菌体进行SDS-PAGE结合考马斯亮蓝染色,分析融合蛋白的表达情况。
1.2.3 Gst-hAPOB(97-526AA)融合蛋白的大量表达及表达产物分布 将上述鉴定正确表达的pGEX-4T-1-hAPOB(97-526AA)菌株接种于含100 mg·L-1氨苄青霉素的LB液体培养基,扩大培养至OD600达到0.8~1时,加IPTG至终浓度0.5 mM,20 ℃继续振荡培养12 h,12 500 g 离心收集菌体,PBS缓冲液重悬菌体沉淀,经超声破碎后,12 500 g,4 ℃离心15 min后取上清和沉淀留样,进行SDS-PAGE分析gst-hAPOB(97-526AA)融合蛋白表达情况。
1.2.4 Gst-hAPOB(97-526AA)融合蛋白的纯化 上述蛋白沉淀分别经2、3、4、6、8 mol·L-1的尿素溶液对沉淀进行梯度重悬、洗涤处理,每次洗涤完后4 ℃、12 500 g 离心20 min重新收集沉淀。透析袋中加入洗脱下的目的蛋白,放入PBS溶液中透析过夜。SDS-PAGE电泳结合western-blot检验洗脱后的蛋白;采用BCA法测定纯化后蛋白浓度,-80 ℃保存。
1.2.5 hAPOB多克隆抗体的制备 首免:每只羊接种 4 mL免疫原乳剂,采用皮下与皮内注射。一共16个注射点,分别为颌下、背部皮下各2个点;后足窝皮下共2个点;前腹股沟皮内各2个点;后腹股沟皮内各3个点注射。二免:首次后第15天进行二免,采用皮下与淋巴结注射。一共18个注射点,分别为颌下、背部皮下各2个点;前腹股沟皮下各2个点;后腹股沟皮下各3个点;前后腹股沟淋巴结共计4个点。三免:二免后第10天进行三免,采用皮下注射。共计14个注射点,分别为颌下、背部皮下各2个点;前腹股沟皮下各2个点;后腹股沟皮下各3个点。四免:三免后第10天进行四免,免疫方式同三免。五免:四免后第10天进行五免,免疫方式同三免。
1.2.6 hAPOB血清制备及效价测定 双向琼脂扩散法检测抗血清效价:在免疫前、二免前、三免前、五免后 5 d 分别采血,设定标准阳性血清孔和阴性孔,主要步骤为琼脂板的配制、打孔、补底和加样。
ID-ELISA(Indirect enzyme-linked immunosorbent assay):5 次免疫注射后分别采集静脉血5~10 mL进行血清分离,以免疫前湖羊血清作为阴性对照,以hAPOB纯化融合蛋白(2 μg·mL-1)为抗原进行ID-ELISA测定[11],PBS作为空白对照。
效价检测合格后将所有血采完。将采得的全血于38 ℃水浴中静置1.5~2 h,使血清充分析出后置于4 ℃冰箱中保存过夜。
1.3 数据分析
数据采用分析软件SPSS 17.0进行ANVOA分析,统计作图采用SigmaPlot绘图软件。
2 结果与分析
2.1 pGEX-4T-1-hAPOB(97-526AA)原核表达质粒的构建
利用上述设计的引物对hAPOB(97-526AA)段序列进行PCR扩增,PCR产物在1 %琼脂糖凝胶电泳结果如图1所示,扩增出一个特异性的DNA条带,与理论值1287 bp相符。EcoRⅠ和XhoⅠ双酶切重组质粒后,获得4969、1287 bp 2个条带,初步说明重组成功。重组质粒经测序,结果正确,可以确定pGEX-4T-1-hAPOB(97-526AA)原核表达质粒构建成功。
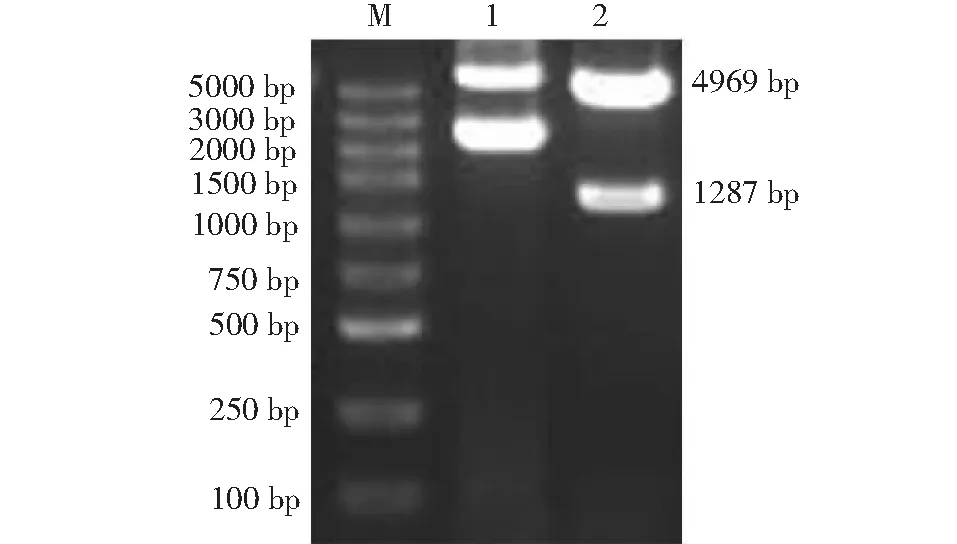
1:pGEX-4T-1-hAPOB(97-526AA)重组质粒未经酶切;2:pGEX-4T-1-hAPOB(97-526AA)重组质粒经EcoR I/Xho I双酶切图1 pGEX-4T-1-hAPOB(97-526AA)重组质粒双酶切的琼脂糖凝胶电泳验证Fig.1 Double digestion of pGEX-4T-1-hAPOB (97-526AA) recombinant plasmid by agarose gel electrophoresis
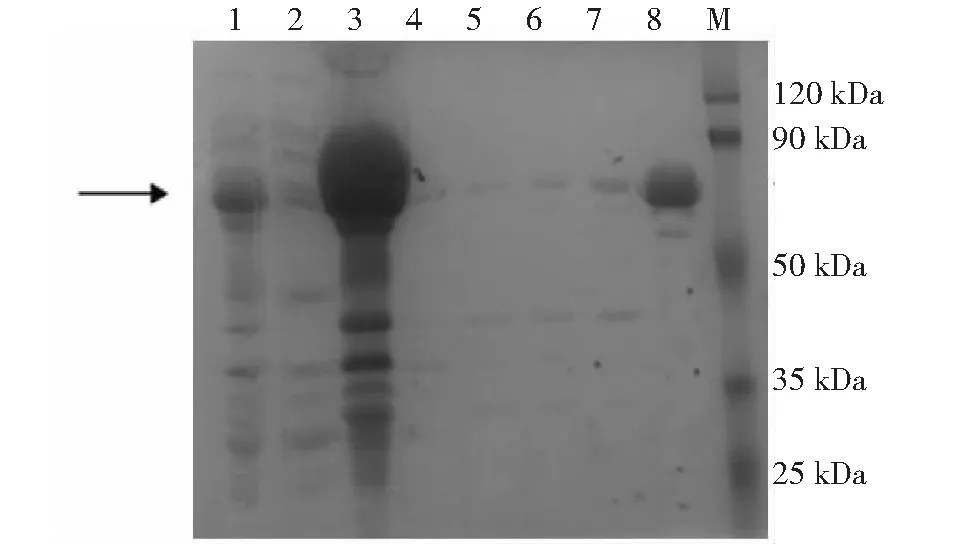
泳道1:全菌蛋白;泳道2:上清蛋白;泳道3:沉淀蛋白;泳道4~8:沉淀蛋白分别经2M、3M、4M、6M、8M尿素洗脱纯化;M:蛋白分子量标准。箭头所示为目的蛋白图2 pGEX-4T-1-hAPOB(97-526AA)-BL21(DE3)放大诱导后的蛋白SDS-PAGE检测Fig.2 SDS-PAGE detection of protein of pGEX-4T-1-hAPOB(97-526AA)-BL21(DE3) after magnification
2.2 Gst-hAPOB(97-526AA)融合蛋白的诱导表达产物分布及纯化
重组原核表达质粒pGEX-4T-1-hAPOB(97-526AA)转化大肠杆菌感受态后SDS-PAGE分析,结果显示,在80 kDa位置出现特征蛋白条带,与预期分子量相一致。
将pGEX-4T-1-hAPOB(97-526AA)冻存菌放大诱导培养,取上清和沉淀分别进行SDS-PAGE,图2显示,上清中几乎无融合蛋白gst-hAPOB(97-526AA)表达;8 M的尿素溶液洗脱后获得的融合蛋白的纯度及产量最佳。
对包涵体纯化后,收集的蛋白经SDS-PAGE分析和Western blot检测并经BCA法计算其浓度为1.45 mg·mL-1,纯度约为90 %。
2.3 原核表达抗原hAPOB免疫羊只后抗血清产生规律
从图3中可以看出,随着免疫次数的增加,血清中抗体效价逐步升高,到五免后抗体效价到达最高;而且图中显示 0.4 mg 组从二免前一直到五免后的抗体效价都要显著高于其他两组,提示最佳的免疫原注射量为0.4 mg/次。注射量较少(0.2 mg)或者较多(1.0 mg)都不利于血清中抗体浓度的升高。
2.4 hAPOB抗血清效价测定
采用最佳的免疫原注射量为 0.4 mg/次,多点注射免疫湖羊,检测抗血清的效价。以蛋白溶液(2μg·mL-1)为抗原进行ID-ELISA测定(图4),以表达的gst-hAPOB(97-526AA)融合蛋白作抗原,抗血清稀释40 000倍后仍明显地呈阳性反应。效价判断标准为大于最大D450 nm的一半的最小D450 nm所对应的稀释度,即为1︰40000。
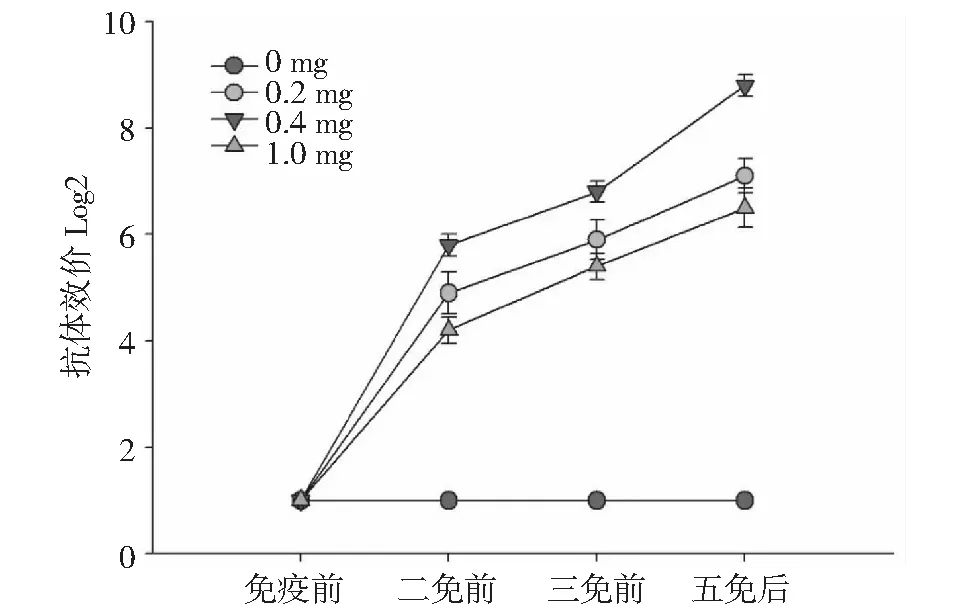
图3 不同免疫抗原浓度的抗体效价趋势图Fig.3 Antibody titer trend with different immune antigen concentrations
3 讨 论
诸多研究表明,APOB对于医学诊断及疾病治疗具有重要作用。在临床上,检测载脂蛋白A与载脂蛋白B对血脂的判断具有重要意义[8-9, 12]。由于APOB在体内脂类转运、代谢以及维持血脂水平的恒定中所起的核心作用,所以APOB的基因变异可能与动脉粥样硬化、冠心病等心血管疾病有必然联系[8,13-14]。另一方面,测定脂蛋白及载脂蛋白对这些疾病发生状态的跟踪与分析意义重大[9,16]。但目前用于检测APOB的试剂盒尚不成熟。
目前抗血清的商业生产主要应用马、绵羊和山羊等大型家畜,这类家畜具有寿命长、易管理、静脉采集血液方便等优点[10,16]。制备高效价的免疫血清的主要影响因素有抗原自身性质、抗原的注射剂量、注射次数、间隔时间、注射途径及抗原佐剂等[17-19]。本实验首次采用原核表达hAPOB作为抗原,并采用不同剂量进行免疫。目前生产大量APOB抗血清所采用的纯化方法主要是高密度脂蛋白纯化法,该方法的缺点是分离纯化过程中会混入一些血清蛋白等杂蛋白,若要去除这些杂蛋白成份提高纯度,会导致生产成本的提高。若这些杂蛋白不加以去除又会影响抗体的质量,导致非特异性抗体的产生,而APOB的临床精确检测会大打折扣。所以我们实验中创新性采用原核表达抗原,一方面可以使表达蛋白更纯,另一方面降低成本。从结果看,原核表达的hAPOB抗原纯度高,抗血清的效价足以满足商用标准,可以替代商业购买的抗原。
有研究表明,免疫剂量的不同导致对免疫系统的刺激强弱存在差异,从而产生不同水平的抗体,进而影响免疫血清的效价[20-22]。本试验在原核表达抗原的免疫剂量方面亦进行了有效探索。从免疫原的注射剂量入手,对免疫剂量进行优化,不但进一步增高了抗体的效价,而且节省了抗原用量,降低了生产成本。
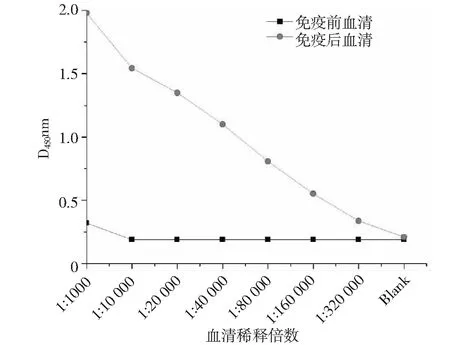
图4 ID-ELISA测定hAPOB抗血清效价Fig.4 hAPOB antibody titer detected by ID-ELISA
综上所述,本实验成功选取了APOB蛋白的抗原表位,进而构建了载体表达APOB的重组蛋白抗原,成功避开了血清中杂蛋白残留的问题,降低生产成本的同时提高抗体的特异性及效价,是一种经济高效的抗体制备方法,为后续的抗体应用奠定了良好的基础。
