悬浮固化液相微萃取-高效液相色谱联用测定水样中甲硝唑和氯霉素
2019-04-04
(1.浙江树人大学生物与环境工程学院 杭州 310015;2.杭州师范大学钱江学院理工分院 杭州 310018)
自1959年甲硝唑(metronidazole)被合成出来后,起初是治疗滴虫病的首选药物,其后又发现可抑制阿米巴原虫氧化还原反应,使原虫氮链发生断裂,具有抗菌和消炎的作用[1],现在已是临床常用的硝基咪唑类抗微生物药物[2]。氯霉素是一种广谱抗生素,由于价廉及优良的抗菌性和稳定的药效常用于动物的各种传染病的治疗中。但是,氯霉素有严重毒副作用,水中氯霉素残留不仅对动物和人体有直接危害,而且还会诱发致病菌的耐药性,易引起人体血中毒,导致不可逆的再生障碍性贫血,对人体健康构成巨大的威胁[3]。甲硝唑则存在致遗传变异和致癌性等毒副作用[4]。
随着水产养殖业兽药的滥用,以及人民生活水平的提高,各种个人护理用品的广泛使用,导致目前水中甲硝唑、氯霉素等残留污染越来越严重[5]。甲硝唑和氯霉素的测定有液相色谱法、液相色谱-质谱联用等[6,7]。在测定过程中,样品前处理所占时间约占整个测定环节的61%。传统的样品前处理存在操作繁琐,需要使用大量对人体和环境有害的有机溶剂等缺点。针对这一问题,近年来,已经发展了多种微萃取技术,如固相微萃取、液相微萃取、膜萃取等[8]。悬浮固化液相微萃取技术( solidification of floating organic drop with liquid phase microextraction, SFO-LPME)自2007年提出后[9],因其具有集样品采集、萃取、浓缩于一体功能,而且操作简单、成本低、富集倍率高等优点,是一种环境友好型样品前处理新技术,可与HPLC、GC、AAS等仪器联用,在环境污染、药物代谢、农药残留、重金属测定等痕量分析领域具有广阔的应用前景[10]。在样品溶液中加入几十微升有机溶剂,分散混匀后,萃取溶剂可直接进样分析。微萃取法集采样、萃取和浓缩于一体,操作简单、快速、成本低、对环境友好且富集效率高[11]。本实验采用液相色谱法,以甲硝唑、氯霉素为研究目标,建立了以悬浮固化液相微萃取技术对水样中甲硝唑、氯霉素含量的测定方法,该法简便、准确、专属性强,可用于测定水样中甲硝唑和氯霉素。
1 实验部分
1.1 仪器和试剂
P230II高效液相色谱仪,包括UV230II紫外-可见检测器、P230II高压恒流泵、LU230II低压梯度混合器(大连依利特分析仪器有限公司);AB204-N电子分析天平(梅特勒-托利多国际贸易(上海)有限公司);07HWS-2数显恒温磁力搅拌器(杭州仪表电机有限公司);KQ-300GVDV型三频恒温数控超声波清洗器(昆山市超声仪器有限公司);GM-0.33A隔膜真空泵(天津市津腾实验设备有限公司);DGG-9140A型电热恒温鼓风干燥箱(上海森信实验仪器有限公司);UPWS超纯水器(杭州永洁达净化科技有限公司)。
甲硝唑、氯霉素(纯度≥99%,购至阿拉丁);磷酸为分析纯(国药集团化学试剂有限公司);甲醇为一级色谱纯(天津四友);水为超纯水,正十一醇、正十二醇(上海麦克林生化科技有限公司)。
1.2 水样悬浮固化液相微萃取方法
取20mL水样加入100mL小烧杯中加入0.49 g十二醇,在一定温度、pH、搅拌速度下搅拌10min,然后冰浴5min取出上浮物,融化上浮物,进行滤膜过滤,即得液相色谱进样溶液。
2 方法
2.1 模拟水样的制备
精确称取甲硝唑和氯霉素适量,加水制成10μg/mL甲硝唑、20μg/mL氯霉素混合溶液,摇匀,即得。
2.2 标准贮备溶液的制备
称取甲硝唑和氯霉素标准品用甲醇配置成1mg/mL贮备液,4℃贮存,用前逐级稀释。
2.3 色谱条件
色谱柱:WondaCract ODS-2柱(4.6 mm×250 mm,5 μm,岛津技迩(上海)商贸有限公司公司);流动相:0.1%磷酸水溶液∶甲醇(80∶20);流速:1mL/min;柱温:45℃;波长:280nm。该色谱条件下,果糖与葡萄糖的色谱峰完全达到基线分离(R>2)。
3 结果
3.1 线性关系考察
在2.3色谱条件下,将配制好的10、20、50、80、100μg/mL的甲硝唑和50、80、100、200、400μg/mL氯霉素标准工作溶液分别用所建方法进行测定,以甲硝唑,氯霉素的色谱峰面积(Y)为纵坐标,质量浓度(X,μg/mL)为横坐标,进行线性绘制,得到甲硝唑标准曲线回归方程为:Y=16.83x-5.869,r=0.995;氯霉素标准曲线回归方程为:Y=16.86x+134.7,r=0.997。并根据信噪比(S/N)=3计算出方法检出限,结果见表1,对照品与水样的HPLC色谱图见图1。

表1 甲硝唑和氯霉素的线性方程、相关系数以及检出限
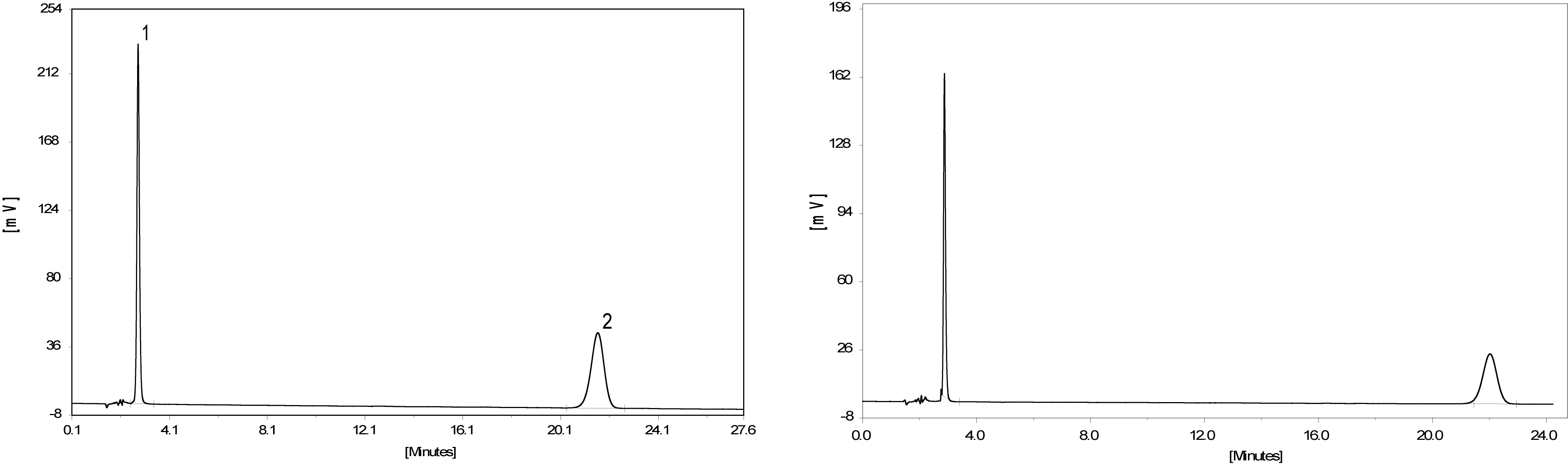
图1 对照品与水样的HPLC色谱图1.甲硝唑 2.氯霉素
3.2 精密度试验
取50μg/mL的甲硝唑、氯霉素混合标准溶液适量,按2.3项下色谱条件进行5次含量测定,记录峰面积,计算峰面积测定结果的相对标准偏差,结果见表2、表3。结果表明,该方法具有良好的精密度和准确度。

表2 甲硝唑精密度试验结果

表3 氯霉素精密度试验结果
3.3 稳定性试验
取50μg/mL、100μg/mL的甲硝唑和氯霉素混合标准溶液适量,按2.3项下色谱条件下分别在0、2、4、6、8h下进行含量测定,记录峰面积,计算峰面积测定结果的相对标准偏差,结果见表4、表5。结果表明,该方法具有良好的稳定性。

表4 甲硝唑稳定性试验结果

表5 氯霉素稳定性试验结果
3.4 加样回收率试验
取10mL的浓度分别为5μg/mL、10μg/mL、20μg/mL的甲硝唑溶液和10mL的浓度分别为10μg/mL、20μg/mL、40μg/mL的氯霉素溶液按2.1项制备进样溶液后按2.3项下色谱条件下进行含量测定,记录峰面积,用峰面积换算十二醇中的试样含量,计算回收率,结果见表6、表7。
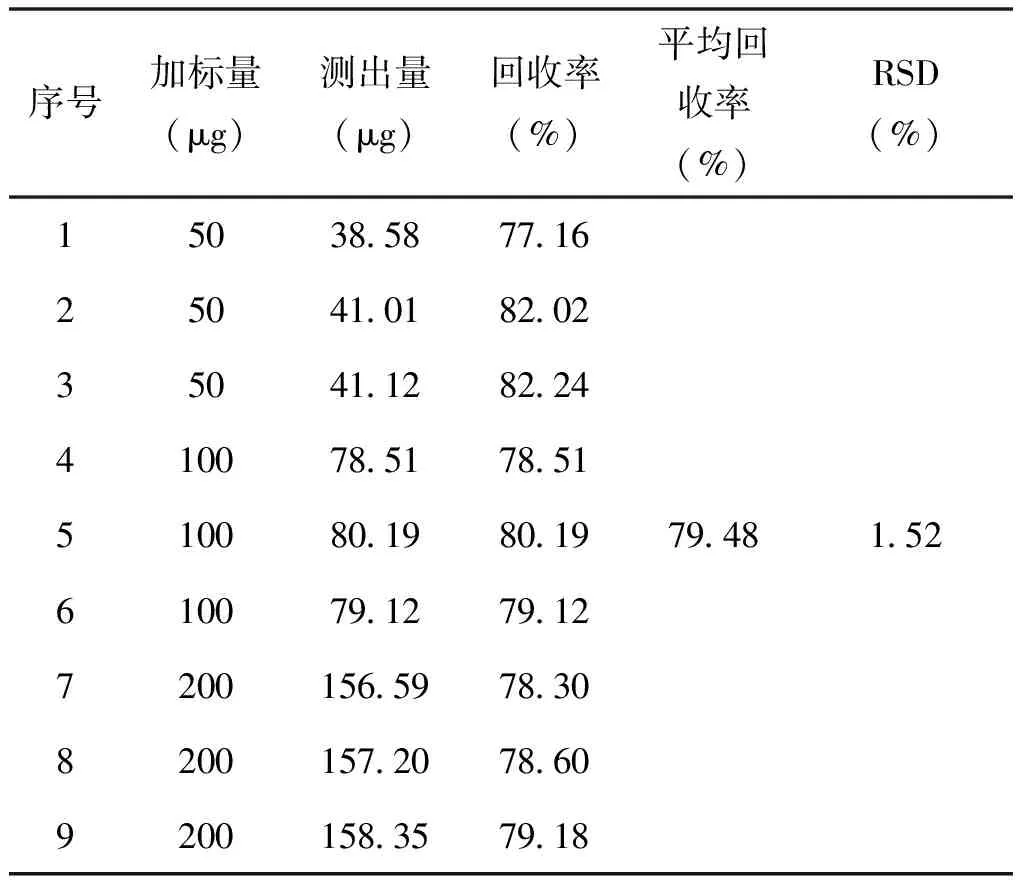
表6 甲硝唑回收试验结果

表7 氯霉素回收试验结果
3.5 萃取条件优化
卢巧梅等人[12]在采用悬浮固化液相微萃取对食品中的两种生长素进行方法优化时,发现萃取温度A、十二醇用量B、盐浓度C、pH值D、搅拌速度E等因素对体系的萃取效果都有相互影响。因此,本实验在参考该文的萃取条件,采用5因素4平行正交试验(表8、表9)。
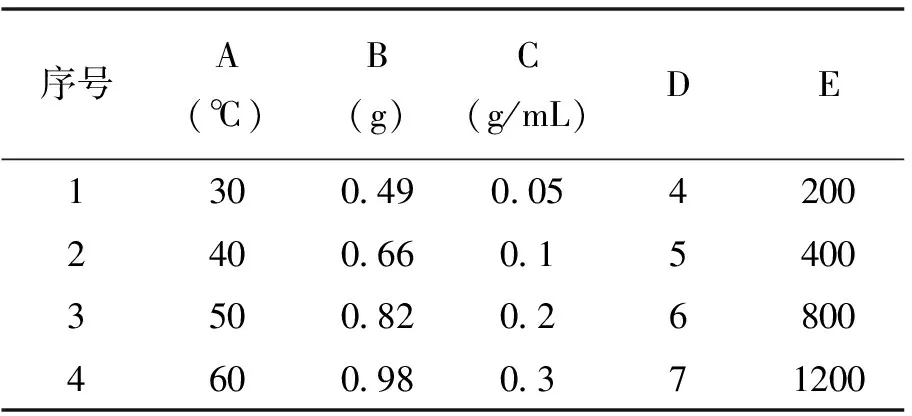
表8 因素水平表

表9 正交试验结果
表10、11的极差分析中,极差越大表明该因素对结果的影响越显著。试验表明pH值对水中甲硝唑的萃取效果的影响最大,然后依次是搅拌速度、NaCl浓度、提取温度,影响最小的是十二醇的用量。搅拌速度对水中氯霉素的萃取效果的影响最大,然后依次是pH值、NaCl浓度、十二醇用量,影响最小的是温度。甲硝唑的最佳提取条件是温度30℃,十二醇用量为0.49g,NaCl浓度为0.1g/ml,pH为7,搅拌速度为1200r/min。氯霉素的最佳提取条件是温度60℃,十二醇用量为0.49g,NaCl浓度为0.3g/mL,pH为5,搅拌速度为1200r/min。
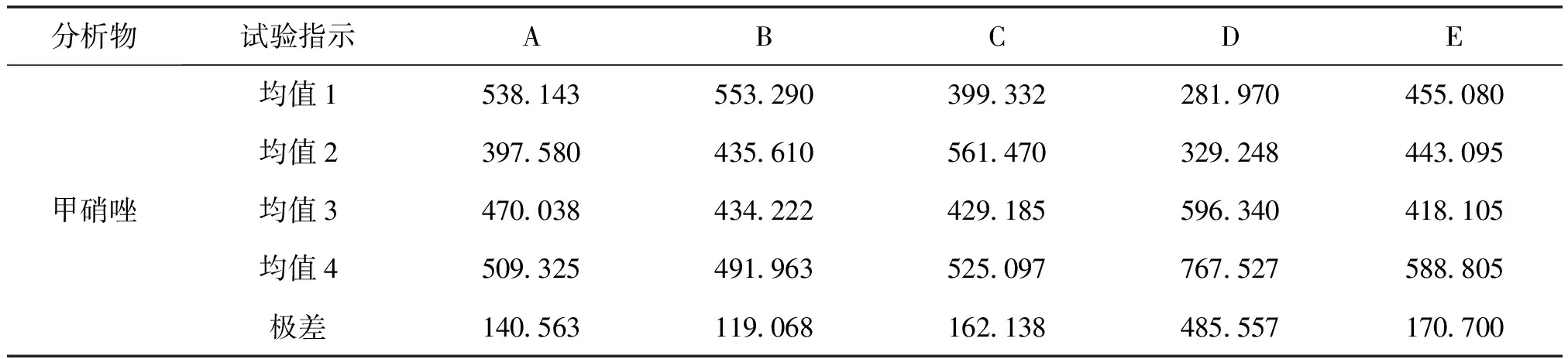
表10 甲硝唑正交试验极差分析
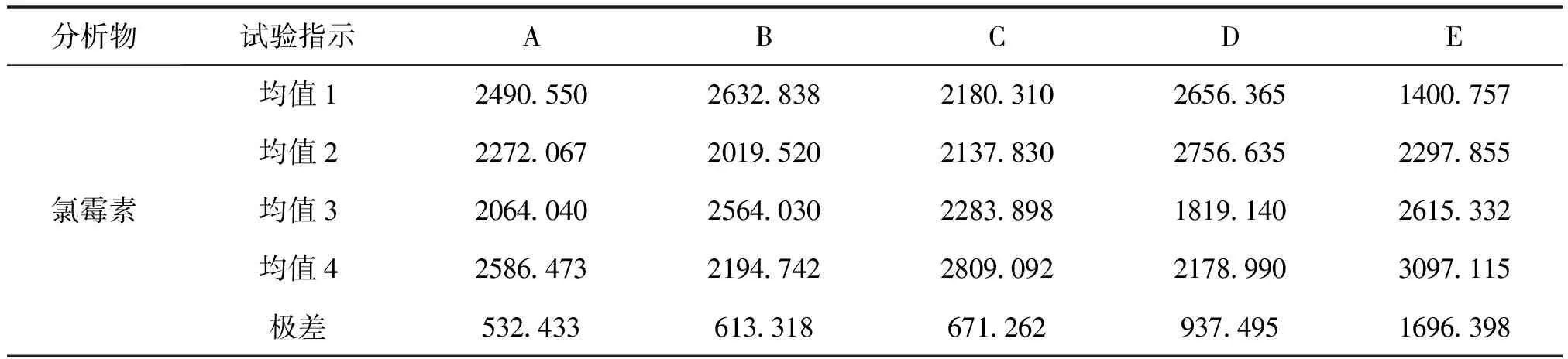
表11 氯霉素正交试验极差分析
4 结论
本实验对水样中的甲硝唑和氯霉素建立了微萃取测定方法。得到了较佳的测定色谱条件为:WondaCract ODS-2柱(4.6 mm×250 mm,5 μm,岛津技迩(上海)商贸有限公司公司);流动相:0.1%磷酸水溶液∶甲醇(80:20);流速:1mL/min;柱温:45℃;波长:280nm。本方法前处理较为简便,测定准确度高、重现性好、专属性强,可作为后续研究水中甲硝唑和氯霉素的常规测定方法。
