抗血小板活性肽及其作用机制研究进展
2019-04-03田淇,李博
田 淇,李 博
中国农业大学食品科学与营养工程学院,北京 100083
随着社会经济的发展及老龄化人口的增加,血栓性疾病的发病率和死亡率逐年上升,包括肺栓塞、脑卒中、心肌梗塞等常见病,已严重威胁中老年人的身体健康。心脑血管疾病的病理基础是血栓形成,而诱导血栓形成的关键因素是血小板的活化和聚集。因此,目前抗血小板治疗已成为防治血栓类疾病的重要策略。然而,现有抗血小板药物虽能有效缓解血栓的形成,但由于存在药物抵抗或低应答,并不适合所有患者,部分药物还存在严重的并发症(如脑出血、消化道大出血等)[1]。所以,寻求来源更广泛更安全可靠的抗血小板活性物质,对预防或延缓血栓性疾病具有重大意义。本文就近年来发现的多种存在抗血小板激活、聚集等作用的生物活性肽及其作用机制进行综述。
1 血小板激活机制
血小板是哺乳动物血液中特有的成分之一,它是从骨髓中巨核细胞上脱落下的具有生物活性的胞质成分[2]。正常状态下,血小板均以无活性的形式存在,而在胶原、二磷酸腺苷(Adenosine diphosphate,ADP)、凝血酶、血栓素A2(Thromboxane A2,TXA2)等激动剂诱导下,血小板膜表面相应受体被激活,发生内信号转导后血小板通过粘附、聚集、释放等过程,参与机体内的止血反应,同时也在组织修复、炎症反应、器官移植排斥、血栓形成等病理过程中发挥着相当重要的作用[3]。血小板活化信号通路呈网状,多种激动剂可通过不同通路激活血小板,且通路之间相互影响。其受体如图1所示。
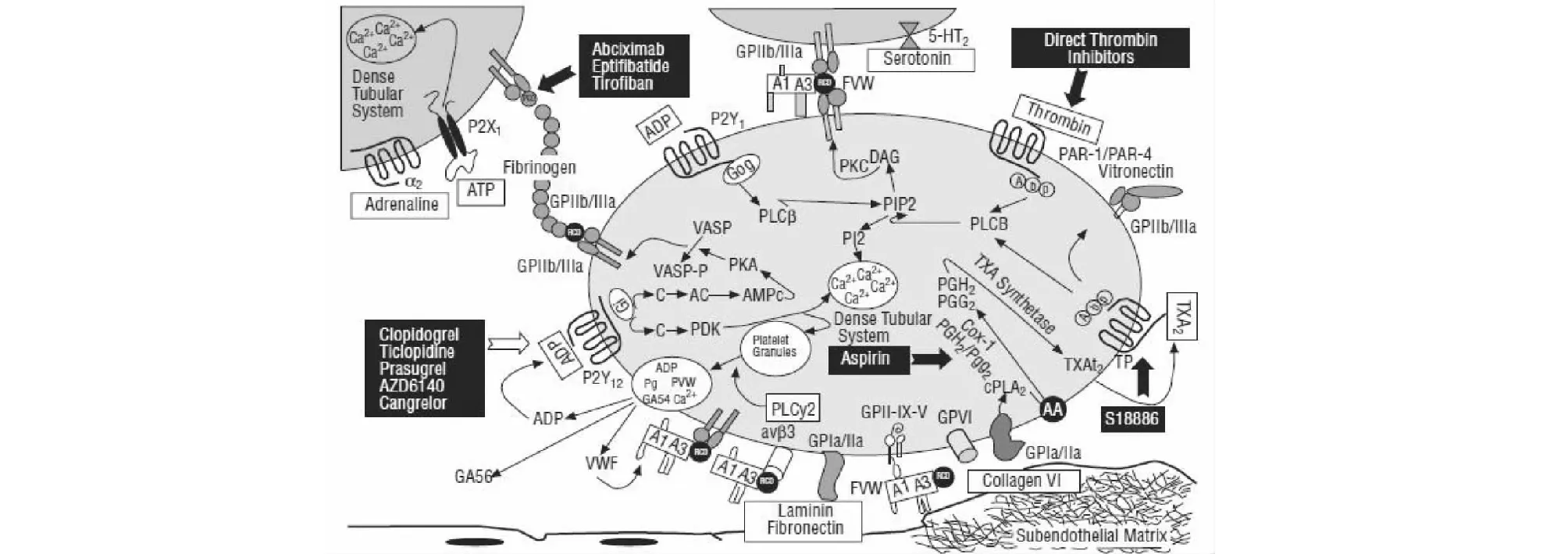
图1 几种主要的血小板受体及其信号通路[4]Fig.1 Several major platelet receptors and their signaling pathways
1.1 胶原
血小板膜上多种受体会通过血管性血友病因子(von Willebrand factor,vWF)与胶原发生间接作用,包括整合素αⅡβ1、GPⅡb-Ⅲa、GPⅠb、GPⅥ等。血小板粘附到胶原后,GPⅥ会产生由内到外的信号,从而刺激整合素的前激活,随后释放的第二波介质如ADP和TXA2会加强前激活过程。GPⅥ在胶原诱导下的血小板活化、粘附、聚集、颗粒物释放以及发挥促凝活性过程中起着核心作用。胶原与受体结合后会导致多个激酶的级联磷酸化并引起蛋白激活磷脂酶C(Phospholipase C,PLC)的聚集,使磷脂酰肌醇二磷酸(Phosphatidylinositol diphosphate,PIP2)水解产生三磷酸肌醇(Inositol triphosphate,IP3)和二酰基甘油(Diacylglycerol,DAG)。IP3可以促进胞内Ca2+流出,DAG可以激活PLC进而诱导致密颗粒的分泌和ADP的释放。激活的蛋白激酶C(Protein kinase C,PKC)和细胞内Ca2+水平的升高会刺激磷脂酶A2,释放膜磷脂中的花生四烯酸(Arachidonic acid,AA)[5]。AA在环氧合酶(Cyclooxygenase,COX-1)作用下生成前列腺素,进而转化为TXA2释放到胞浆外[6]。
1.2 ADP
ADP是血小板活化的重要放大剂,正常状态下,高浓度的ADP储存于血小板的致密颗粒内,当血小板激活后,ADP被迅速释放出来并激活其他血小板,进一步放大血小板反应。P2Y1和P2Y12是血小板表面的ADP受体。P2Y1受体激活后通过偶联的Gq蛋白使血小板内Ca2+水平升高。P2Y12受体激活后通过偶联的Gi蛋白抑制腺苷酸环化酶(Adenylate cyclase,AC)活性,同时激活磷脂酰肌醇3激酶(Phosphatidylinositol 3 kinase,PI3K)。AC活性下降可以降低环磷酸腺苷(Cyclic adenosine monophosphate,cAMP)水平,并使得磷酸化的血管舒张剂刺激磷蛋白(Phosphoprotein,VASP)去磷酸化,而活化的PI3K又可使Akt(也称为蛋白激酶B)发生磷酸化[7],最终激活GPⅡb-Ⅲa。此外,活化的P2Y12受体可放大和维持TXA2和凝血酶引起的血小板反应,并稳定形成血栓。
1.3 TXA2
TXA2是在血小板活化后合成和分泌的一种重要介质,多种激动剂诱导的血小板活化过程都伴随着TXA2的合成和其介导的信号级联放大作用。血小板被激活后,膜上的AA会与COX-1作用产生前列腺类产物,之后进一步生成TXA2,随后TXA2扩散到细胞外,激活其他血小板。TPα和TPβ是血小板表面的TXA2受体。当TXA2与血小板表面的受体结合后,会通过血小板内部偶联的Gq、G12、G13蛋白激活PLC,活化的PLC进而催化PIP2降解,释放出第二信使IP3和DAG。IP3可促进内质网Ca2+的释放,而DAG可激活血小板内的PKC,引起蛋白磷酸化,并进一步激活GPⅡb-Ⅲa[8]。
1.4 凝血酶
在血管损伤处,血液中的凝血酶原迅速产生凝血酶,凝血酶不但可以催化纤维蛋白原生产纤连蛋白,同时也是效应最强的血小板激动剂。凝血酶的激活作用主要是通过与G蛋白偶联的蛋白酶激活受体(protease activated receptors,PARs)介导的,PARs在凝血酶的作用下裂解掉氨基端外结构域后被激活,并通过偶联的G蛋白发挥作用[9]。人血小板膜上凝血酶的受体是PAR1和PAR4,其中PAR1与G12、G13、Gq、Gi蛋白偶联,G12和G13可与Rho鸟苷酸交换因子结合,诱发Rho因子介导的细胞骨架反应,导致血小板发生形状改变[10]。Gq和Gi蛋白活化后同样可引起上述改变。因此,凝血酶不仅可引起血小板的变形,还能促使血小板内Ca2+水平升高和cAMP水平下降,从而激活GPⅡb-Ⅲa,使血小板活化。
各激动剂激活血小板后,血小板变形、扩散,并引起膜表面受体GPⅡb-Ⅲa构象改变,变为高亲和力受体,进而与二价纤维蛋白原等蛋白配体连接,介导血小板的粘附和聚集,最终导致血栓产生[11]。
1.5 常见的血小板药物及其作用机制
目前临床使用的抗血小板药物主要分为:(1)阿司匹林(Aspirin),通过不可逆地阻断COX-1的合成,抑制TXA2的合成,从而抑制血小板的活化和聚集。(2)替格瑞洛(Ticagrelor),通过可逆地与P2Y12受体相互作用,从而选择性抑制ADP诱导的血小板聚集。(3)氯吡格雷(Clopidogrel),通过不可逆地抑制ADP与受体P2Y12结合,从而选择性抑制ADP诱导的血小板聚集。(4)Vorapaxar和Atopaxar是目前处于临床试验阶段的PAR1受体抑制剂[12]。(5)阿昔单抗(Abciximab)、依替巴肽(Integrilin)、替罗非班(Tirofiban)均属于GPⅡb-Ⅲa受体拮抗剂,三者虽作用于同一受体,但结构却有所不同:阿昔单抗为抗β3单克隆抗体;而依替巴肽和替罗非班是模拟受体与纤维蛋白原结合的序列,其中,依替巴肽是7个氨基酸组成的环肽[13],而替罗非班为左旋酪氨酸非肽类结构。
2 抗血小板肽
早在1984年就有研究证实RGDS序列是纤维蛋白原结合细胞的活性位点,能够抑制血小板凝集和纤连蛋白结合到活化的血小板上,从而抑制血栓形成[14]。此后,从各种天然产物中[15]分离的抗血小板肽相继出现。这些天然抗血小板肽的抗血小板聚集效果虽然没有临床药物好,但其副作用小,因而备受关注。还有少数研究在天然抗血小板肽基础上进行结构优化和人工合成,从而开发抗血小板肽潜在的生物学价值和医学价值。按来源可将抗血小板肽分为以下几类:
2.1 动物源抗血小板肽
乳与血液的凝固有许多的相似之处,除本身具有的抗凝因子外,经酶解后的肽段也具有抗血小板活性。Qian等[16]从绵羊乳铁蛋白的N端分离、提纯出三条抗凝血酶诱导的血小板聚集的肽段:TAQVTSTEV,QVTSTEV和KDQDK。实际上其N端序列残基37-33 RKLGRPL与人乳铁蛋白N端序列相同,具有相同抗血小板活性,其抑制凝血酶诱导的血小板聚集的IC50值为4 μM。酪蛋白作为乳的重要成分,不仅可以提供充足的氨基酸和氮源,还是生物活性肽的主要来源。Meddeb等[17]从牛乳κ-酪蛋白中提取出残基106-116 AIPPKKNQDK以剂量依赖性方式抑制ADP诱导的血小板聚集和纤维蛋白原结合。该十一肽比人纤维蛋白原β链的C端十二肽具有更强的抑制性。用胰蛋白酶酶解该十一肽得到两条短肽:残基106~112 MAIPPKK和残基113-116 NQDK。这两条短肽对血小板聚集的影响较小且不会抑制纤维蛋白原与血小板结合。Jolles等人[18]将从牛乳蛋白中分离出的四肽KRDS进行构象优化得到KREE,其抗血小板活性高于早前发现的四肽KRDS和RGDS。四肽RGDS可以抑制ADP和胶原诱导的血小板聚集,IC50值分别为32.3 μM和13.75 μM。
有部分研究关注了肉蛋白衍生肽的抗血小板活性,发现I型胶原含有氨基酸序列:DGEA[19]、FGN、GPR、RGD均具有抗血小板活性。Zied Khiari等[20]从鲭鱼皮明胶的酶解物中提取出抗血小板三肽FGN。Maruyama等[21]从猪皮胶原的酶解物中提取出的三肽GPR抑制胶原和凝血酶诱导的血小板聚集,其IC50值为250 μM。某些胶原肽也具有抑制纤维蛋白原-凝血酶诱导血小板聚集的作用,但是不能抑制凝血酶的活性。Nonaka等[22]研究发现,胶原肽GPR及其衍生物能够与纤维蛋白原结合并阻止纤连蛋白单体间发生聚合,从而选择性抑制ADP诱导的血小板聚集。同时动物实验证实,静脉注射或口服三肽GPR以及猪皮胶原的酶解物可以抑制内毒素诱导的患有弥散性血管内凝血大鼠体内的血小板数量减少,也就是说口服该三肽可以对血小板聚集起到抑制作用。
自然界中存在多种具有抗血小板活性的蛋白类物质,到目前为止已从蚊蝇、水蛭、蜈蚣、蛇等生物体内提取出具有良好活性的抗凝血和溶栓蛋白,通过酶解后分离纯化得到活性更强的短肽。Kong等[23]从少棘蜈蚣(Scolopendramutilans)中分离出三肽SQL。在0.2~1.0 mg/mL浓度范围内,SQL以剂量依赖性方式抑制ADP诱导的人血小板聚集。同时,SQL可有效延长活化部分凝血活酶时间(Activated partial thromboplastin time,APTT),而凝血酶原时间(Prothrombin time,PT)不受影响,这可能是由于其对内源性凝血途径中的凝血因子发挥抑制作用,而不影响外源性凝血途径。Hao等[19]从棕点湍蛙(Amolopsloloensis)皮肤分泌物中分离出多肽ZDPI(FRGCWLKNYSPRGCL-NH2),能够以剂量依赖性方式抑制ADP诱导的人血小板聚集,IC50值为12.27 μg/mL。Kato等[24]从白蛉沙蝇(Leishmaniaspp)的唾液中分离出的Ayadualin可通过影响纤维蛋白原与GPⅡb-Ⅲa的结合而显著抑制凝血酶、ADP和胶原诱导的血小板聚集。Chen等[25]从蕲蛇毒水解物中分离出多肽ACH-11(LTFPRIVFVLG)。在0.1~1.0 mg/mL浓度范围内,ACH-11以剂量依赖性方式抑制ADP诱导的兔血小板聚集;同时,研究发现ACH-11可直接抑制FXa或FXa-底物复合物(Ki值为9.02 μM),进而发挥抗凝血作用;此外,动物实验发现ACH-11可缓解ADP诱导的血栓形成,效果优于阿司匹林,并且显著延长PT及APTT,但不影响出血时间(Bleeding time,BT)。
大量研究涉及蛇毒对血小板聚集的抑制作用,活性位点均为RGD序列。除ACH-11之外,研究人员从多种蛇毒中提纯出了抗血小板肽,包括:Echistatin[26],Trigramin,Rhodostomin,Arietin[27],Halysin[28],Gabonin[29],NKV-66[30],Triflavin[31],Jerdonibitin[32],Accutin[33],pENW[34],AAP[35],LX0702[36]。
2.2 植物源抗血小板肽
植物源抗血小板作用主要来自于中草药中的多酚类物质,而抗血小板多肽的相关研究较少。目前,Hyun等[37]从药用蘑菇(桦褐孔菌Inonotusobliquus)中提取、纯化出三肽WGC,可以抑制胶原和ADP诱导的血小板聚集,其抑制率高达91.6%,IC50值为0.16 mM。相对于其他血小板聚集抑制剂(如Bassiatin,IC50值为0.19 mM),由于WGC具有较高的抑制血小板聚集活性且更安全,无副作用,因此被认为是医药或功能性食品的更优选择。
近几年科学家逐渐注意到种子贮藏蛋白的多肽链内部可能普遍存在着功能区,选择适当的蛋白酶水解这些多肽,有可能将其释放出来,从而制备生物活性肽。Lee和Kim[38,39]从大豆蛋白的水解产物中提纯并鉴定了两种活性最高的亲水性抗血小板肽:SSGE和DEE。SSGE和DEE的IC50值分别为480、460 μM。均可以抑制ADP诱导的大鼠血小板聚集。同时,大豆蛋白的水解物中多数组分具有抗血小板活性,表明水解物中的大多数肽具有抗血小板作用。于国泳等[40]从燕麦,青稞和荞麦的酶解并模拟消化产物中提取出38条抗血小板肽,并从中筛选出了活性最高的9条肽:ALPIDVLANAYR,EFLLAGNNKR,GEEFGAFTPK,QLAQIPR,LQAFEPLR,ALPVDVLAN AYR,GEEFDAFTPK,QKEFLLAGNNK和TNPNSMVS HIAGK。这些肽通过以低结合能结合COX-1活性中心的方式抑制血小板聚集。所有水解产物均显示出高抗血小板活性,并以剂量依赖性方式抑制血小板聚集,其中,燕麦球蛋白水解物的抗血小板活性最强,IC50值为0.282 mg/mL。通过蛋白酶水解这些种子贮藏蛋白所获得的生物活性肽具有很多优点:原料廉价、成本低、安全性好、不需要很严格的实验条件和很贵重的仪器设备、便于工业化生产。
2.3 微生物源抗血小板肽
大多数重组的抗血小板肽选择在酵母菌、枯草杆菌及大肠杆菌中表达,使工业化制备抗血小板肽成为可能,鲜有报道从微生物蛋白中分离抗血小板肽。Pytela等[41]从噬菌体文库中分离出的环状九肽ACRGDGWCG,通过抑制整合素αⅤβ1介导的受体与纤维蛋白原结合,从而抑制ADP和胶原诱导的大鼠血小板聚集,IC50值为6 μM。通过计算机模拟,环肽ACRGDGWCG的类似物ACDCRGDCFCG同样具有较高的抗血小板活性。
2.4 人工合成的抗血小板肽
近几十年来,随着基因工程和生物制药技术的发展,国内外科学家根据已知抗血小板肽序列和相关受体结构优化和开发了多种新型高效抗血小板肽。Revacept(二聚体糖蛋白VI-Fc)通过清除激活血小板受体的关键配体,阻断斑块中的胶原与GPVI结合从而降低血小板粘附。Revacept能够有效抑制胶原诱导的人血小板聚集,且呈剂量和时间依赖性,但不抑制ADP或凝血酶诱导的血小板聚集[42]。
N-{4-(4-Amidinophenoxy)butyryl}-a-L-aspartyl-L-valine(FK633)是一种人工合成的肽类似物,可以抑制凝血酶,ADP,胶原和血小板活化因子(Platelet-activating factor,PAF)诱导的人血小板聚集,IC50值分别为103、87、98、239 nM。FK633与四肽RGDS的抑制作用相似,但其效力比RGDS强约1 000倍。但与RGDS相比,FK633不会抑制浓度高达1.0 mM的整合素αⅤβ3和αⅤβ1介导的细胞粘附[43]。
SFLLRNPNDKYEPF是基于人凝血酶受体结构而设计合成的凝血酶受体拮抗剂。可以通过抑制凝血酶引发的一些细胞内信号传导系统,从而抑制血小板聚集。基于仓鼠凝血酶受体(SFFLRNP-NH2)推导出的衍生七肽也同样有效[44]。
(S,S)PSRCDCR-NH2衍生自整合素亚单位αⅡb。人血小板表面受体GPIIb-IIIa的亚单位αⅡb的313-332序列在与纤维蛋白原结合过程中起重要作用。体外实验表明,(S,S)PSRCDCR-NH2能显著抑制人血小板聚集。在电诱导兔动脉血栓模型中发现,经股静脉给予该肽后,与依替巴肽相比,能更显著地延长动脉血流时间,减轻血栓质量;且该肽还具有不影响凝血功能和BT的优点[45]。
大量研究还发现其他具有抗血小板激活、聚集活性的肽段,除部分人工合成的肽类物质会影响血小板功能外,多种食源性抗血小板肽也处于研发阶段。下表为已报道的抗血小板肽序列信息。

表1 已报道的抗血小板肽序列
续表1(Continued Tab.1)
注:“-”表示未报道。
Note:“-” means not reported.
3 抗血小板肽的作用机理
3.1 纤维蛋白原受体拮抗剂
血小板膜上存在多种纤维蛋白原的受体,如整合素αⅡβ1、GPⅡb-Ⅲa和GPⅥ。整合素家族种类较多,与血小板相关受体主要有三种,纤连蛋白,玻连蛋白和纤维蛋白原的细胞表面受体,分别为:αⅤβ1整联蛋白,αⅤβ3整联蛋白,IIb-IIIa整联蛋白。纤维蛋白原通过结合血小板表面上的特异性受体糖蛋白IIb-IIIa(GPIIb-IIIa),形成网状结构从而导致血小板的聚集。在纤维蛋白原序列上已确定了两个结合位点。首先,γ链的C端序列:HHLGGAKQAGV。第二,对应于α链的残基572-575或95-98的四肽序列:RGD(S或F),这两条肽都能抑制胶原与ADP诱导的血小板的聚集。
依替巴肽(Integrilin)[13]是美国食品药品管理局批准上市的第一种抗血小板多肽,是衍生自东南侏儒响尾蛇(Sistrurusmiliariusbarbouri)毒液中蛋白质的环状七肽Mpa-Har-GDWPC-NH2,属GPIIb-IIIa受体拮抗剂。它活性基团为Har-GD,该基团通过模拟与纤维蛋白原结合的氨基酸序列,选择性、竞争性、可逆性抑制GPⅡb-Ⅲa与纤维蛋白原结合,进而起到抗血小板聚集的作用。
RGD多肽及其衍生物和类似物:GPIIb-IIIa与配体的结合主要通过一个三肽序列,即RGD序列,RGD序列广泛存在于纤维蛋白原中,是黏附蛋白与血小板表面受体相互作用的识别位点,含RGD序列肽段可竞争性与GPIIb-IIIa识别位点结合,阻断纤维蛋白原与血小板结合,进而抑制血小板聚集[49]。其衍生物和类似物包括:人工合成的四肽RGDS[50];人工合成的含2个RGD序列的小分子线性肽Z4A5[51];从乳蛋白中分离出的KRDS[52];对RGD周边部分氨基酸进行突变得到的三肽RWR[53];以RGD为先导物而设计合成的AoGDW[54];用液相法合成的新型多肽类似物RGD-苯乙胺衍生肽Ⅰ[55];含RGD序列的线性模拟物Ac-RGD-pe[56];含RGD序列的环状模拟物cyclo-S-Ac-(AA1)-RGDC-OH[57];在N端氨基处掺入水杨酸衍生的新型RGD类似物[58];含有RGD序列的肽类似物W2002(Nα-acetyl-RGD-p-methoxyphenethylamine)[59];从白蛉沙蝇的唾液中分离出的Ayadualin[24];大部分蛇毒中的抗血小板多肽均含RGD结构:Accutin[33],Echistatin[26],Trigramin,Rhodostomin,Arietin[27],Halysin[28],Gabonin[29],NKV-66[30],Triflavin[31];从噬菌体文库中分离出的环状九肽ACRGDGWCG和增加二硫键合成的ACDCRGDCFCG;纤维蛋白原α链中的RGDF及其衍生肽GRGDSPK[41]、NIMEILRGDF,γ链中的LGGAKQAGDV[36]。
P1c是结缔组织生长因子中第4功能区的一个多肽序列,由17个氨基酸组成,能与人整合素αⅤβ3特异性结合,用其标记的纳米颗粒能与高度表达整合素αⅤβ3的肝癌细胞高度亲和,该纳米探针已成功用于肿瘤的体内定位。P1c可以有效抑制ADP诱导的血小板聚集,同时抑制细胞内ERK1-2信号通路的磷酸化,显示P1c可能是通过抑制ERK1-2的磷酸化而实现对血小板聚集的抑制作用[55]。研究还证实,作为GPIIb-IIIa的配体,P1c可与该受体发生特异性结合而产生抗血小板作用。
3.2 凝血酶受体拮抗剂或凝血酶抑制剂
凝血酶的活性中心处于一个极性较强的缝隙中,因为底物必须与缝隙中的活性位点相结合从而使肽键断裂,所以凝血酶具有较强的特异性。1990年,Rydel等[60]通过X射线晶体衍射阐明了水蛭素与凝血酶的结合方式,即水蛭素的N端在一定程度上阻塞了凝血酶的活性位点,而其较长的C端则与凝血酶的带正电荷的外结合位点结合。目前对水蛭素的结构和作用机制研究比较深入,还有部分科学家对水蛭素结构进行重组和优化。
天然水蛭素主要包括HV-l、HV-2和HV-3三种异构体,均为由65~66个氨基酸组成的无糖基化单链多肽,相对分子量约为7 000 Da。水蛭素是迄今为止发现的活性最强的天然凝血酶特异性抑制剂。水蛭素能与凝血酶以摩尔比为1∶1的方式结合形成复合物,使凝血酶失活,阻止了凝血酶裂解纤维蛋白原,进而抑制了纤连蛋白的形成。同时,水蛭素也能阻断凝血酶诱导旳血小板反应及凝血酶催化的止血反应[61]。
比伐卢定(Bivalirudin)于2 000年被批准在美国上市,是一种近年来用于临床的直接凝血酶抑制剂,其主要成分是水蛭素的二十肽类似物。通过可逆地与凝血酶催化位点特异性结合,直接抑制凝血酶的活性,从而抑制凝血酶所诱导和催化的反应[62]。
WP-30(VISRTQSNVQAAWGQVGGHAADYSAVAIER)是从干燥水蛭中分离纯化出一种多肽,属凝血酶受体拮抗剂。研究发现,WP-30可能通过干扰凝血酶与受体结合,从而以剂量依赖性方式抑制凝血酶诱导的血小板聚集,IC50值为445.1 μM。但对U46619及胶原诱导的血小板聚集抑制作用较弱。同时,动物实验发现,WP-30能缓解小鼠体内血栓的形成,且呈剂量依赖性[63]。
3.3 粘附受体GPIb拮抗剂
GPIb是血小板膜上的主要粘附受体,参与血小板相关疾病。然而,使用生理配体在体内研究GPIb特异性识别是十分困难的。GPIb结合蛇毒C型凝集素(Snaclecs)是体外探索GPIb的常用方法。蛇毒含有许多生物成分,其通过破坏内皮或影响凝血因子并最终影响血小板功能而发挥作用。具体来说,由α、β异二聚体组成的蛇毒C型凝集素低聚化后形成大分子与特异性血小板受体如GPⅠb、αⅡβ1或GPⅥ受体相互作用,从而抑制血小板功能。
Chen等[32]从竹叶青蛇(Trimeresurusjerdonii)蛇毒中提取出一种名为Jerdonibitin的新型蛇毒C型凝集素能够与GPIb特异性结合。氨基酸序列显示Jerdonibitin不仅是一种蛇毒C型凝集素,而且与一种GPIb受体抑制性蛇毒C型凝集素TSV-GPIb-BP具有序列相似性。Jerdonibitin剂量依赖性地抑制低剂量凝血酶或瑞斯托霉素诱导的血小板聚集,但不抑制高剂量凝血酶诱导的血小板聚集。许多研究表明GPIb是凝血酶受体,特别是在凝血酶剂量低时。在体内,Jerdonibitin也剂量依赖性地使小鼠的血小板数量降低,并且在静脉注射18小时后血小板计数仍保持在非常低的水平。
3.4 TXA2合成酶抑制肽
AA代谢在血小板聚集过程中起到了重要作用,COX-l是AA代谢产生TXA2过程中关键限速酶。于国泳[40]研究发现,燕麦抗血小板聚集肽能显著抑制AA代谢过程中COX-l的活性从而抑制TXA2的生成。计算机模拟结果表明,燕麦球蛋白族蛋白酶水解物可通过进入COX-1活性中心,与其中的氨基酸通过氢键、共价键和范德华力结合,产生空间位阻,引起COX-1活性中心构象改变,从而竞争性地抑制COX-1活性,从而介导AA代谢途径减少TXA2的生成,进而抑制血小板聚集。
3.5 其他
myr-RKEFAK是模拟GPⅡb-Ⅲa的β3亚单位C端α螺旋上6个氨基酸序列(RKEFAK)肽段,并通过十四烷酰化修饰而形成的肽模拟物。研究发现myr-RKEFAK的抗血小板作用可能与选择性调控血小板信号转导有关。myr-RKEFAK可以浓度依赖性地抑制血小板固相化纤维蛋白原上稳定黏附和伸展、二相聚集以及纤维蛋白块回缩等外向内信号转导功能,但不影响游离纤维蛋白原结合和一相聚集等内向外信号转导功能[64]。
CGHC是一种基于蛋白质二硫键异构酶(Protein disulfide isomerase,PDI)氧化还原序列设计合成的四肽。PDI在血小板聚集中起主要作用,其抑制剂已成为新型抗血栓药物。CGHC抑制PDI还原酶活性和由嗜中性粒细胞NOX-2产生的PDI调节的超氧化物。研究发现,CGHC的中间两个氨基酸并不影响该肽的抗血小板活性,在凝血酶活化的血小板中,CxxC以剂量依赖性方式抑制血小板聚集,在较低的激动剂浓度下更有效。CxxC肽通过与PDI中的Cys400结合(一种PDI促血栓形成活性的重要位点)显著抑制血小板聚集和活化,而不干扰颗粒分泌。揭示了其抗血小板活性的潜在机制,PDI的C端CGHC序列的反应性半胱氨酸对血栓形成具有重要意义[65]。
4 结语
抗血小板治疗在血栓性疾病的防治中具有关键作用。尽管目前临床上使用的抗血小板药物种类良多,但仍存在一定的局限性:出血风险高、副作用大、个体差异性大(如某些药物需肝细胞色素P450 酶代谢形成活性代谢物),半衰期短等。
自然界中存在大量具有抗血小板活性的蛋白类物质,到目前为止已经从沙蝇、水蛭、蛇、蛙等生物体内提取出具有良好活性的抗凝血和溶栓蛋白。但这些物质大都从吸血类动物的毒液中提取,安全性差且副作用没有得到改善。而从食源性蛋白质中发现的具有抗血小板活性的小分子肽类化合物具有安全、可食用、营养、来源广泛等特点,开发利用前景广泛。虽然大部分抗血小板肽的活性低于抗血小板药物,但通过结构优化和设计合成将会开发出多种新型高效的抗血小板肽类似物,具有一定的临床应用潜力。另一方面越来越多研究发现抗血小板药物的联合治疗获得的收益更大,而食源性蛋白水解物可抑制多种途径诱导的血小板激活和聚集,故抗血小板肽适合开发成具有预防或缓解血栓形成功能的多靶向的精准营养产品。因此,深入研究食源性抗血小板肽及其作用机理,将为今后抗血小板肽作为膳食补充剂用于功能食品,或用于血栓类疾病的防治提供新的策略和依据。
