我国不同地区熊蜂短膜虫的感染情况及亲缘关系
2019-04-03唐裕杰王刘豪李凯李继莲
唐裕杰,王刘豪,李凯,李继莲
(中国农业科学院蜜蜂研究所农业部授粉昆虫生物学重点实验室,北京100093)
0 引言
【研究意义】熊蜂(Bombusspp.)是自然生态系统中重要的授粉昆虫,在维持自然界和农业生态系统平衡方面发挥着至关重要的作用。我国是全世界熊蜂种类最丰富的国家之一[1-2]。目前全球已知的熊蜂种类约250种[3]。我国已知的熊蜂种类多达125种,约占全球熊蜂已知物种的 50%[4]。熊蜂具有个体大、寿命长、吻较长、全身密被绒毛等特点,采集能力强于蜜蜂,对弱光、低温等较恶劣的环境条件有良好的适应能力[5]。目前,我国饲养熊蜂的主要用途是为设施农业、大田作物、果蔬等授粉,同时也对外出口至其他国家[6]。商品化熊蜂群的应用规模越来越大,其在不同国家间的进出口不可避免会传播部分病原虫害,其中寄生虫是影响熊蜂生态分布和商业化发展的主要因素。熊蜂短膜虫(Crithidia bombi)是危害熊蜂健康的常见寄生虫之一,其主要寄生于熊蜂肠道内,且传播广泛、数量多,对熊蜂的繁育与产业化产生巨大的影响[7-8]。在野外环境中,熊蜂可能会从巢内的同伴或在被污染的花上觅食的同伴处感染这种寄生虫[9]。研究熊蜂短膜虫的感染情况,关注熊蜂健康,保护熊蜂的物种多样性,对更好地保护生态系统具有重要意义。【前人研究进展】熊蜂短膜虫属于动鞭毛虫纲、动质目、锥虫亚目、短膜虫属,其形态特点为只有锥虫亚目6个发育期中的无鞭毛期和前鞭毛期,无鞭毛期是随昆虫粪便排出的感染期,而前鞭毛期为肠道寄生期[10]。早期的研究报道证实,在熊蜂肠道中发现了短膜虫属的Crithidia bombi和细滴虫属的Leptomonassp.。武文杰认为自然界中的熊蜂短膜虫存在着多重感染的现象;熊蜂短膜虫对熊蜂的成活率有较为明显的影响,且不同株的短膜虫对熊蜂的影响不同[11-13]。在真核生物的核糖体中,内转录间隔区(internal transcribed space,ITS)位于18S和5.8S rDNA之间以及5.8S和28S rDNA之间,故ITS区包括ITS-1区和ITS-2区。因为ITS区域两端分别为大亚基和小亚基,所以不像rRNA基因一样受到功能上的限制,且 18S、5.8S和28S基因组序列在绝大多数的生物中趋于保守,在生物种间变化相对较小,稳定性强,而ITS区域进化速度较编码区快,在核苷酸序列和长度上也存在很强的变异性[14-16]。基于这些特点,ITS区域成为许多寄生虫分子分类学研究的有用标记。ZHU等[17]通过对 15种蛔虫rDNA的ITS-1区和ITS-2区进行测序,发现了不同种的ITS序列存在不同程度的差异,进而分析了15种蛔虫的系统进化;张立海等[18]利用2个引物扩增松材线虫(Bursaphelenchus xylophilus)和拟松材线虫(B. mucronatus)的ITS序列,得到ITS-1区的扩增产物大小约308 bp,该区可作为松材线虫PCR鉴定的靶向序列,并测出这两个种间的ITS序列差异为32—39 bp,而松材线虫种内差异不超过1 bp;周荣琼等[19]通过对国内 3株安氏隐孢子(Cryptosporidium andersoni)的ITS-1序列进行扩增并分析,发现3株安氏隐孢子的ITS-1序列基本一致,仅其中1株与其他2株有3个碱基的差异,与GenBank注册的C. muris和C. parvum存在种间差异,且差异显著,这充分说明了ITS-1序列可以作为C. andersoni种的遗传标记,从而为隐孢子虫属的种间鉴定打下了基础;邹志文等[20]研究发现,ITS序列片段分析结果支持尼氏真绥螨(Euseius nicholsi)和卵圆真绥螨(E. ovalis)现在的分类地位,而小新绥螨属与钝绥螨属似乎未达到属间差异,其分类地位有待进一步确定;艾琳等[21]扩增了黑龙江绒山羊和绵羊的东毕吸虫(Orientobilharziaspp.)的ITS序列,发现这两种东毕吸虫的ITS序列总长度均为875 bp,且序列相似性为99.9%,证实了黑龙江绒山羊和绵羊的东毕吸虫为同一个种;LIU等[22]通过测得不同牛梨形虫ITS序列来构建牛梨形虫的系统发育树,发现所有的牛巴贝斯虫和泰勒虫各独立占有一支,故通过ITS序列差异来反映这些种的亲缘关系更为理想。上述研究均证实了随着分子生物学技术的发展,rDNA-ITS序列分析已经广泛应用于原虫和蠕虫等寄生虫的分类、鉴定、诊断和系统发育的研究,且能够取得很好的效果。【本研究切入点】近年来我国关于熊蜂短膜虫的研究报道相对缺乏。本研究利用特异的ITS引物扩增待检测的熊蜂肠道总DNA,之后进行凝胶电泳,通过是否扩增出675 bp的熊蜂短膜虫ITS基因片段来判断待检测的蜂群是否感染了熊蜂短膜虫,通过进一步测序,分析不同蜂种、不同地区寄生的熊蜂短膜虫之间的亲缘关系。【拟解决的关键问题】调查研究我国内蒙古、甘肃、青海、四川4个省(自治区)熊蜂短膜虫的感染率,并由其序列同源性构建系统发育树,旨在进一步探究我国部分地区短膜虫的流行规律及不同地区、不同蜂种间寄生的短膜虫的亲缘关系,为商品化熊蜂的短膜虫病的进出口检疫以及熊蜂短膜虫的分类鉴定提供理论依据。
1 材料与方法
1.1 熊蜂样本采集
供试熊蜂样本均于2017年7—8月采自内蒙古、甘肃、青海、四川等地。在采集样本时,将捕虫网捕获得到的熊蜂置于无水乙醇中,妥善保存熊蜂样本,同时记录采集地区的海拔高度和经纬度(表 1)。之后对不同蜂种、不同地区熊蜂短膜虫的感染率进行卡方检验分析(SPSS 22.0)。
1.2 熊蜂肠道总DNA提取
将采样保存的熊蜂解剖,取其中肠后放入1.5 mL的离心管中,10 000×g离心2 min,收集离心管下方的沉淀物。向沉淀中依次加入500 mmol·L-1的NaCl 60 μL、100 mmol·L-1的 Tris-HCl(pH 8.0)30 μL、50 mmol·L-1的 EDTA(pH 8.0)150 μL、10%的 SDS 溶液 30 μL、50 μg·μL-1蛋白酶 K 溶液 30 μL,并混匀,然后在液氮中反复冻融3次,55℃水浴48 h。消化好的悬液按DNA提取试剂盒(Wizard ® SV 96 Genomic DNA Purification System,Promega)的操作步骤提取熊蜂肠道的基因组DNA,于-20℃冰箱保存备用。
1.3 引物设计和PCR扩增
利用ITS引物Cri-its-b12及Cri-its-f4扩增熊蜂短膜虫 ITS序列[23],上游引物 Cri-its-b12序列为5′-AGGAAGCCAAGTCATCCATCGC-3′,下游引物Cri-its-f4 序列为 5′-GGTCTATGTGATTCCGTGGTTT CC-3′,由华大基因公司合成。PCR反应体系为25 μL,包括 5 μL 的 5×GoTaq Buffer、1.5 μL 的 MgC12(25 mmol·L-1,Promega公司),2.0 μL的dNTPs(200 μmol·L-1,TaKaRa公司),引物 Cri-its-b12和引物 Cri-its-f4各 1 μL(10 μmol·L-1),0.625 U/管的 GoTaq DNA 聚合酶,5 μL 的模板 DNA(约 5 ng·μL-1),8.875 μL 的ddH2O。反应在Eppendorf Master cycler PCR仪上进行。反应参数:预变性95℃ 4 min,变性95℃ 1 min,退火64℃ 1 min,延伸72℃ 1 min,循环32次,最后延伸 72℃ 10 min。之后进行电泳检测条带有无,2%的琼脂糖凝胶,GlodView核酸染料染色,在10 g·L-1的TAE电泳液中电泳,全自动凝胶成像系统成像并拍照留存。
1.4 ITS基因片段克隆与测序
1.4.1 PCR产物与载体的连接 利用琼脂糖凝胶回收试剂盒(DP209,天根生化科技有限公司)切胶回收PCR扩增产物,然后再在PCR管中依次加入PCR纯化产物1—3 μL(根据产物浓度而定)和pMD19-T载体1 μL,然后加ddH2O至5 μL,即总量为5 μL,最后加入 Solution I溶液 5 μL,混匀,16℃反应 30 min。
1.4.2 连接产物的转化 从-80℃冰箱取出感受态细胞,轻轻放置在冰浴环境中使其融化;缓慢地加入目的DNA,轻轻上下颠倒混匀,冰浴30 min,42℃水浴热激30 s,然后快速转移,冰浴2—3 min,该过程避免离心管剧烈摇晃;然后向离心管中加入500 μL不含氨苄的LB液体培养基,混匀,置于37℃恒温培养箱中,200 r/min培养1 h,待细胞复苏;吸取已转化的感受态细胞加入到含氨苄的LB固体培养基上,涂板,使细胞均匀地分布于平板上,再将平板倒置于37℃培养箱中培养过夜。
1.4.3 菌液 PCR 取阳性重组菌落的菌液接种于含氨苄的LB液体培养基中,于恒温培养箱中培养过夜,然后取一定量的菌液进行PCR扩增。反应的总体系为25 μL,反应参数:预变性95℃ 4 min,变性95℃ 1 min,退火64℃ 1 min,延伸72℃ 1 min,循环32次,最后延伸72℃ 10 min。然后进行电泳检测条带有无,
2%的琼脂糖凝胶,GlodView染料染色,在10 g·L-1的TAE电泳液中电泳,全自动凝胶成像系统成像并摄像。

表1 各地区所调查的熊蜂的种类和数量Table 1 The species and number of bumblebees in different regions
1.4.4 重组质粒的抽提及酶切鉴定 经过菌液 PCR筛选出来阳性克隆菌株后,采用质粒小提试剂盒(DP103,天根生化科技有限公司)抽提重组质粒,用限制性内切酶HindⅢ和BamHⅠ进行双酶切鉴定。
1.4.5 熊蜂短膜虫 ITS序列的测序 将经过菌液PCR方法筛选,以及重组质粒酶切鉴定后的阳性菌落送至北京诺赛基因组研究中心有限公司测序。ITS基因片段的测序结果采用BioEdit编辑,并进行Blast比对分析,用DNAman 9.0对分离的rDNA-ITS序列进行分析比较,MEGA 6.0构建系统发育树以确定短膜虫的系统进化[24-26]。
2 结果
2.1 不同种熊蜂的短膜虫感染情况
检测了25种熊蜂的短膜虫感染情况,共计1 007只。检测到感染短膜虫的熊蜂有20种,共计262只,感染率为26.0%,样本量在30只以上的熊蜂有表2所示8种。其中白背熊蜂与火红熊蜂的短膜虫感染率极显著高于其他6种熊蜂(P<0.01),而西伯熊蜂的短膜虫感染率极显著低于其他7种熊蜂(P<0.01)。

表2 不同种熊蜂的短膜虫感染情况Table 2 Infection situations of C. bombi in different bumblebee species
2.2 同一地区不同种熊蜂的短膜虫感染情况
在调查的熊蜂中,对样品数≥30只的熊蜂短膜虫感染率进行分析比较(表3),四川的弗里熊蜂、疏熊蜂、兴熊蜂的短膜虫感染率依次为 27.1%、20.1%和15.0%,且这3种熊蜂感染率无显著性差异(P>0.05);而白背熊蜂的短膜虫感染率为70.0%,极显著高于前3种熊蜂(P<0.01)。甘肃的密林熊蜂和红束熊蜂的短膜虫感染率依次为 23.1%和14.6%,且这两种熊蜂感染率差异不显著(P>0.05)。内蒙古的密林熊蜂的短膜虫感染率为 12.2%,而西伯熊蜂未发现感染,故密林熊蜂的感染率极显著高于西伯熊蜂(P<0.01)。

表3 同一地区不同种熊蜂的短膜虫感染情况Table 3 Infection situations of C. bombi of different bumblebee species in the same region
2.3 同种熊蜂在不同地区的短膜虫感染情况
由表4可以看出,同种熊蜂在不同地区感染的短膜虫感染率之间差异均不显著。密林熊蜂在内蒙古的短膜虫感染率为 12.2%,在甘肃为 23.1%;火红熊蜂在甘肃的短膜虫感染率为 68.4%,在青海为 63.6%,两个省份的差异虽不显著,但火红熊蜂的短膜虫感染率在这两个省份均较高;稳纹熊蜂在甘肃和青海两个省份均未发现感染。另外从表1可以看出,跨3个地区分布的明亮熊蜂虽然总的样本量不多,但感染率均较高。
2.4 不同地区熊蜂的短膜虫感染情况
由表5可以看出,青海、四川、甘肃、内蒙古4个地区的熊蜂短膜虫感染率分别为 48.2%、28.0%、22.0%、10.2%。其中青海的短膜虫感染率最高,且极显著高于其他3个地区(P<0.01);内蒙古的短膜虫感染率最低,且极显著低于其他3个省份(P<0.01)。
2.5 不同级型熊蜂的短膜虫感染情况
由表6可以看出,雄蜂和工蜂的短膜虫感染率分别为44.7%、24.5%,蜂王未发现感染。其中,雄蜂的感染率极显著高于其他两种级型(P<0.01)。
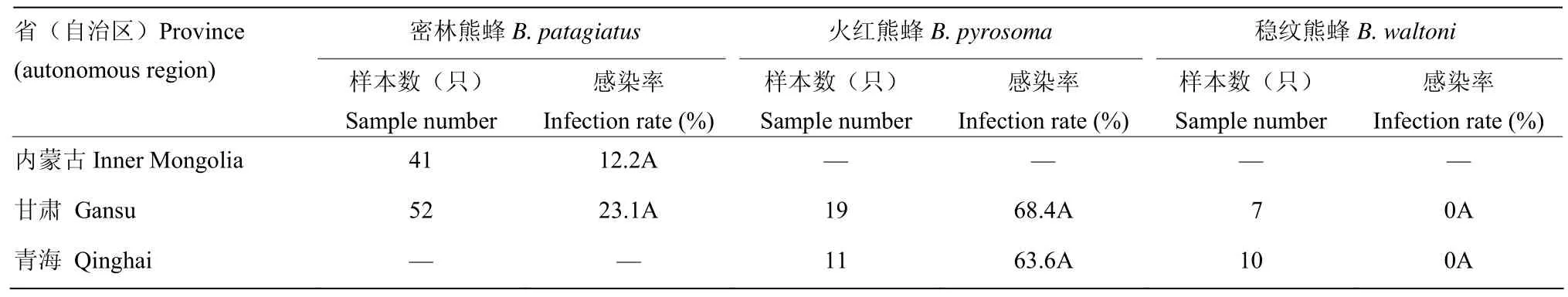
表4 同种熊蜂在不同地区的短膜虫感染情况Table 4 Infection situations of C. bombi of the same bumblebee species from different regions

表5 不同地区熊蜂的短膜虫感染情况Table 5 Infection situations of C. bombi from different regions

表6 不同级型熊蜂的短膜虫感染情况Table 6 Infection situations of C. bombi from different castes
2.6 感染熊蜂的短膜虫亲缘关系
基于 NJ算法构建不同地区熊蜂感染的短膜虫的亲缘关系(图1)。甘肃地区检测的9种熊蜂中,有7种熊蜂感染的短膜虫亲缘关系较近,而另外2种亲缘关系较远,分别为黑尾熊蜂和猛熊蜂。内蒙古地区检测的3种熊蜂感染的短膜虫亲缘关系均较近。青海地区检测的4种熊蜂短膜虫亲缘关系均较近。四川地区较为复杂,疏熊蜂、兴熊蜂和弗里熊蜂感染的短膜虫种类不一,感染的短膜虫亲缘关系既与整体保持一致性,又有各自特殊的进化分支。总体而言,大部分熊蜂感染的短膜虫亲缘关系均较近,除了甘肃的黑尾熊蜂和猛熊蜂,四川的疏熊蜂、兴熊蜂和弗里熊蜂感染的短膜虫与其他短膜虫亲缘关系较远。此外,还发现甘肃的黑尾熊蜂和四川的弗里熊蜂感染的短膜虫亲缘关系很近,部分采自四川的疏熊蜂感染的短膜虫接近于Crithidia expoeki。

图1 基于NJ算法构建的不同地区感染熊蜂的短膜虫近缘种间的系统进化树Fig. 1 Phylogenetic tree of C. bombi of closely related species from different regions based on NJ algorithm
3 讨论
本研究发现,熊蜂短膜虫对我国熊蜂的感染广泛,在检测的内蒙古、甘肃、青海、四川4个省(自治区)的25种1 007只熊蜂中,有20种262只被短膜虫感染,其感染率为26.0%。样本量在30只以上的8种熊蜂分别为白背熊蜂、火红熊蜂、弗里熊蜂、疏熊蜂、密林熊蜂、红束熊蜂、兴熊蜂和西伯熊蜂,其中白背熊蜂和火红熊蜂的短膜虫感染率极显著高于其他6种熊蜂,而西伯熊蜂的短膜虫感染率极显著低于其他 7种熊蜂,说明短膜虫存在寄主专一性,这是由于不同种类寄主的生理生化特性和免疫特征不同[27],以及不同基因型的短膜虫与不同基因型的熊蜂种群间相互作用的结果。四川地区的白背熊蜂的雄蜂感染率极高,这导致雄蜂整体发病水平偏高,同时,四川地区的白背熊蜂成为最容易感染短膜虫的蜂种,推测该地区的白背熊蜂为较易感特定种属的短膜虫。另外,青海地区的短膜虫感染率最高,内蒙古地区的短膜虫感染率最低,这可能与不同地区熊蜂的种类有关,例如,青海地区的火红熊蜂、明亮熊蜂、西氏熊蜂的感染率都较高,均为易感染短膜虫的蜂种;而内蒙古地区的西伯熊蜂的短膜虫感染率是样本量在 30只以上的所有蜂种中相对最低的,推测正是由于西伯熊蜂占比较大而使得内蒙古地区的整体感染率水平相对其他省份较低。
对我国不同地区熊蜂短膜虫感染情况的统计分析侧重于样本量≥30的种类,这些种类是各个地区的优势种。但数量少于30只的样本也可观察到差异,从表1可以看出,跨3个地区分布的明亮熊蜂虽然总的样本量不多,但感染率均很高,推测明亮熊蜂亦为易感病的蜂种,因样本量不足,有待进一步采样检测和验证。根据统计结果也可以看出,同种熊蜂在不同地区的短膜虫感染率差异均不显著,但火红熊蜂在甘肃和青海地区的感染率均远高于其他种熊蜂水平,推测火红熊蜂较易感染短膜虫,这与前述结果一致;而在甘肃和青海两个省份采集的稳纹熊蜂样品中均未发现感染短膜虫,推测稳纹熊蜂为较抗短膜虫的蜂种。
YOURTH等研究发现,在继代移殖短膜虫的蜂群中,短膜虫对熊蜂宿主的感染能力在同一蜂群内没有增加;在未处理的蜂群中,感染短膜虫的工蜂数量下降,推测这种感染情况的减少很可能是由于在同一蜂群中继代移殖短膜虫,会逐渐丧失短膜虫的某些株型,混合型在特定株型的连续传代过程中被“过滤”,而没有相应增加存活株型的整体强度[9]。在意大利和瑞士,短膜虫感染率水平与宿主级型相关,蜂王的感染率为54%—81%,工蜂为75%—80%,雄蜂为47%—71%[28]。我国熊蜂的雄蜂和工蜂的感染率分别为44.7%和24.5%,雄蜂感染率略低于国外水平,而工蜂的感染率远低于国外水平,说明我国熊蜂更抗短膜虫;另外,相比于工蜂,雄蜂的短膜虫感染率更高,说明我国短膜虫更倾向于寄生雄蜂,这为今后防治熊蜂短膜虫提供了理论依据。
通过对四省/区熊蜂所感染的短膜虫的ITS序列进行测序分析发现,内蒙古、甘肃、青海地区熊蜂感染的短膜虫总体进化关系较为一致,同种短膜虫在这几个地区的感染率也相对一致,而四川与其他3个地区虽然有重叠的进化关系,但分化相对较远。熊蜂所感染的短膜虫间的亲缘关系总体来说较强,但也受到地理位置以及其寄主熊蜂蜂种的影响。本研究取样范围仍不够宽泛,我国其他省/区的短膜虫感染情况仍不明确,故有待于进一步扩大调查研究范围。同时,采集样本时,对蜂王的采集较为缺乏,不具充分理由说明蜂王是否抗熊蜂短膜虫。
4 结论
我国熊蜂广泛感染熊蜂短膜虫,不同蜂种、不同地理环境和不同级型间熊蜂短膜虫的感染率均有差异,熊蜂群体经过长期进化演变,不同地区形成优势种类,故不同地区所捕捉到的熊蜂种类不同。熊蜂短膜虫存在寄主专一性,且短膜虫对熊蜂宿主的感染具有适应性,这与不同基因型的短膜虫种群和熊蜂种群间相互作用有关。此外,我国部分地区熊蜂感染的短膜虫的亲缘关系总体来说较强,但也受地理位置及其寄主的影响。
[1] WILLIAMS P H. An annotated checklist of bumble bees with an analysis of patterns of description (Hymenoptera: Apidae, Bombini).Bulletin of the Natural History Museum Entomology, 1998, 67(1):79-152.
[2] WILLIAMS P, TANG Y, YAO J, CAMERON S. The bumblebees of Sichuan (Hymenoptera: Apidae, Bombini).Systematics and Biodiversity,2009, 7(2): 101-189.
[3] CAMERON S A, HINES H M, WILLIAMS P H. A comprehensive phylogeny of the bumble bees (Bombus).Biological Journal of the Linnean Society, 2007, 91(1): 161-188.
[4] 黄家兴, 安建东. 中国熊蜂多样性、人工利用与保护策略. 生物多样性, 2018, 26(5): 486-497.HUANG J X, AN J D. Species diversity, pollination application and strategy for conservation of the bumblebees of China.Biodiversity Science, 2018, 26(5): 486-497. (in Chinese)
[5] 方文富. 熊蜂的生物学. 养蜂科技, 2003(1): 5-9.FANG W F.The biology of bumblebees. Apicultural Science and Technology, 2003(1): 5-9. (in Chinese)
[6] 彭文君, 安建东, 梁诗魁. 蜜蜂科中几个具有重要经济价值的昆虫及其利用概况. 蜜蜂杂志, 1999(12): 7-8.PENG W J, AN J D, LIANG S K. Several economically valuable insects in Apidae and their utilization.Journal of Bee, 1999(12): 7-8.(in Chinese)
[7] LI J L, WU J, PENG W J, AN J D, GUO Z B, TONG Y M.Nosema bombi, a microsporidian pathogen of the bumble beeBombus lucorum.Journal of Apicultural Science, 2005, 49(1): 53-57.
[8] 李继莲, 吴杰, 彭文君, 安建东, 国占宝, 童越敏. 熊蜂的病虫害.蜜蜂杂志, 2004(12): 12-13.LI J L, WU J, PENG W J, AN J D, GUO Z B, TONG Y M.Bumblebee pathogens and internal enemies.Journal of Bee, 2004(12):12-13. (in Chinese)
[9] YOURTH C P, SCHMID-HEMPEL P. Serial passage of the parasiteCrithidia bombiwithin a colony of its host,Bombus terrestris, reduces success in unrelated hosts.Proceedings of the Royal Society B:Biological Sciences, 2006, 273(1587): 655-659.
[10] HOARE C A, WALLACE F G. Developmental stages of trypanosomatid flagellates: a new terminology.Nature, 1966, 212(5068): 1385-1386.
[11] 武文杰. 熊蜂短膜虫(Crithidia bombi)微观进化的研究. 寄生虫与医学昆虫学报, 1997, 4(1): 27-32.WU W J. Microevolutionary studies onCrithidia bombi. Acta Parasitologica et Medica Entomologica Sinica,1997, 4(1): 27-32. (in Chinese)
[12] 武文杰. 自然界熊蜂短膜虫的多克隆感染. 中国人兽共患病学报,1997, 13(2): 3-6.WU W J. Muticle clones infection ofCrithidia bombiin the nature.Chinese Journal of Zoonoses, 1997, 13(2): 3-6. (in Chinese)
[13] 武文杰. 不同株的熊蜂短膜虫与宿主生存的关系. 动物学报, 1998,44(2): 235-236.WU W J. The relationship between different strains ofCrithidia bombiand the survival of their host bumble bees.Acta Zoologica Sinica, 1998, 44(2): 235-236. (in Chinese)
[14] HILLIS D M, DIXON M T. Ribosomal DNA: molecular evolution and phylogenetic inference.The Quarterly Review of Biology, 1991,66(4): 411-453.
[15] 林睿. 吸虫种株基因差异的研究进展. 应用预防医学, 2002, 8(5):310-313.LIN R. Advances in genetic differences of trematode strains.Journal of Applied Preventive Medicine, 2002, 8(5): 310-313. (in Chinese)
[16] 翁亚彪, 谢德华, 林瑞庆, 李华文, 张德林, 吴绍强, 朱兴全. 弓形虫ITS及5.8S序列的PCR扩增、克隆及分析. 畜牧兽医学报, 2005,36(1): 70-73.WENG Y B, XIE D H, LIN R Q, LI H W, ZHANG D L, WU S Q,ZHU X Q. PCR amplification, cloning and sequencing analysis of ITS and 5.8S of rDNA fromToxoplasma gondii.Acta Veterinaria et Zootechnica Sinica, 2005, 36(1): 70-73. (in Chinese)
[17] ZHU X Q, GASSER R B, JACOBS D E, HUNG G C, CHILTON N B.Relationships among some ascaridoid nematodes based on ribosomal DNA sequence data.Parasitology Research, 2000, 86(9): 738-744.
[18] 张立海, 廖金铃, 冯志新. 松材线虫rDNA的测序和PCR-SSCP分析. 植物病理学报, 2001, 31(1): 84-89.ZHANG L H, LIAO J L, FENG Z X. Sequencing and PCR-SSCP analysis of ribosomal DNA ofBursaphelenchusnematodes.Acta Phytopathologica Sinica, 2001, 31(1): 84-89. (in Chinese)
[19] 周荣琼, 李国清, 肖淑敏, 郭远忠, 夏艳勋, 林瑞庆, 朱兴全. 安氏隐孢子虫ITS-1序列的PCR扩增、克隆及分析. 中国预防兽医学报, 2005, 27(5): 369-372.ZHOU R Q, LI G Q, XIAO S M, GUO Y Z, XIA Y X, LIN R Q, ZHU X Q. PCR amplification, cloning and sequencing of ITS-1 rDNA fromCryptosporidium andersoni.Chinese Journal of Preventive Veterinary Medicine, 2005, 27(5): 369-372. (in Chinese)
[20] 邹志文, 陈芬, 夏斌, 吴瑜, 张宇. 几种钝绥螨 ITS基因片段的序列分析. 中国农业科学, 2011, 44(23): 4945-4951.ZOU Z W, CHEN F, XIA B, WU Y, ZHANG Y. Sequence analysis of ITS gene in several Amblyseiinae (Acari: Phytoseiidae).ScientiaAgricultura Sinica, 2011, 44(23): 4945-4951. (in Chinese)
[21] 艾琳, 王春仁, 唐剑栋, 林瑞庆, 朱兴全. 绒山羊和绵羊源东毕吸虫ITS rDNA的PCR扩增及序列分析. 热带医学杂志, 2007, 7(3):209-211.AI L, WANG C R, TANG J D, LIN R Q, ZHU X Q. PCR amplification and sequence analysis of the ITS rDNA ofOrientobilharziaspp. from goat and sheep in Heilongjiang Province.Journal of Tropical Medicine, 2007, 7(3): 209-211. (in Chinese)
[22] LIU J L, YIN H, LIU G Y, GUAN G Q, MA M L, LIU A H, LIU Z J,LI Y Q, REN Q Y, DANG Z S, GAO J L, BAI Q, ZHAO H P, LUO J X. Discrimination ofBabesia majorandBabesia ovatabased on ITS1-5.8S-ITS2 region sequences of rRNA gene.Parasitology Research, 2008, 102(4): 709-713.
[23] 李继莲, 吴杰, 彭文君, 安建东, 罗术东, 黄家兴. 熊蜂短膜虫的分子检测方法: CN 103820540 A[P]. (2014-05-28)[2018-10-12].LI J L, WU J, PENG W J, AN J D, LUO S D, HUANG J X. Molecular detection method forCrithidia bombi: CN 103820540 A[P].(2014-05-28)[2018-10-12]. (in Chinese)
[24] SOUFFREAU C, VERBRUGGEN H, WOLFE A P, VANORMELINGEN P, SIVER P A, COX E J, MANN D G, VAN DE VIJVER B, SABBE K, VYVERMAN W. A time-calibrated multi-gene phylogeny of the diatom genusPinnularia.Molecular Phylogenetics and Evolution,2011, 61(3): 866-879.
[25] ALTSCHUP S F, GISH W, MILLER W, MYERS E W, LIPMAN D J.Basic local alignment search tool.Journal of Molecular Biology, 1990,215(3): 403-410.
[26] KLEE J, BESANA A M, GENERSCH E, GISDER S, NANETTI A,TAM D Q, CHINH T X, PUERT F A, RUZ J M, KRYGER P,MESSAGE D, HATJINA F, KORPELA S, FRIES I, PAXTON R J.Widespread dispersal of the microsporidianNosema ceranae, an emergent pathogen of the western honey bee,Apis mellifera.Journal of Invertebrate Pathology, 2007, 96(1): 1-10.
[27] 李继莲. 熊蜂微孢子虫形态学及有关生物学的研究[D]. 北京: 中国农业科学院, 2004.LI J L. Studies on the morphology and biology ofNosema bombi[D].Beijing: Chinese Academy of Agricultural Sciences, 2004. (in Chinese)
[28] LIPA J J, TRIGGIANI O.Crithidia bombisp. n. a flagellated parasites of a bumble-beeBombus terrestrisL. (Hymenoptera, Apidae).Acta Protozoologica, 1988, 27(3/4): 287-290.
