基于CalliSpheres载药微球的肝动脉栓塞化疗治疗不可切除的原发性肝癌
2019-04-03侯勤明王国伟任鲜华冯锐吴宝亮李运江尹春煜黄谦
侯勤明,王国伟,任鲜华,冯锐,吴宝亮,李运江,尹春煜,黄谦
(杭州市西溪医院,浙江 杭州310023)
不可切除的中晚期肝癌占肝癌患者70%以上,经肝动脉化疗栓塞术(TACE)已经成为不可手术切除肝癌的一种成熟的治疗方法[1-2],传统TACE治疗(cTACE)一般用碘化油加化疗药混合后进行治疗。基于载药微球(drug-eluting bead,DEB)的 TACE 称之为“DEB-TACE”,CalliSpheres载药栓塞微球是我国自主研发的新型载药微球,其内可以加载高剂量的化疗药物,并在瘤体内缓慢释放,减少化疗药进入全身血液循环而导致不良反应。国内文献报道不多,研究结果存在差异。本文应用CalliSpheres载药微球经动脉栓塞化疗治疗与传统的cTACE治疗不可切除肝癌,并进行对比,评价临床疗效及安全性。
1 资料与方法
1.1 一般资料 选择本院2016年12月-2017年6月收治的经病理组织学或临床诊断为肝细胞肝癌[3]患者75例,符合以下条件:(1)年龄18-75岁;(2)均为不可切除的中晚期原发性肝细胞癌,每例患者肿瘤结节数量≤3个,且单个结节长径≤7cm;(3)原发肿瘤未经治疗或1年内未经介入治疗(TACE、碘粒子治疗)或手术/消融后复发;(4)预计生存期>3 个月;(5)肝功能良好(Child-Pugh A 级或B级7分)、肾功能正常;(6)体能ECOG≤1分;排除标准:(1)出现肿瘤远处转移者;(2)有明显动/静脉瘘或动/门脉瘘者;(3)有其他脏器或系统受累的重大疾病史;(4)近期感染需抗生素治疗者;(5)4周内有参加其他试验药物或器械的临床试验者 (如乙肝抗病毒药物试验或新型TIPS支架临床试验者)。将患者随机分为两组,其中cTACE组38例,DEB-TACE组37例。两组一般资料比较差异无统计学意义(P>0.05),详见表1。本研究获本院伦理委员会批准,且患者知情同意。
1.2 方法
1.2.1 DEB-TACE治疗 注射用水4mL溶解表阿霉素50~80mg后用CalliSpheres载药微球 (规格100~300μm)1瓶进行加载吸附30分钟。加入1:1碘比醇注射液静置5分钟备用。通过DSA造影明确肿瘤供血动脉,运用微导管将CalliSpheres载药微球以1mL/min的速度超选栓塞到肿瘤供血动脉中,若肿瘤血管出现血流停滞,则结束栓塞,如1瓶载药微球不足以到达栓塞终点则可根据患者实际情况加用300~500μm普通微球,直至到达栓塞终点。

表1 两组一般资料比较(n)
1.2.2 cTACE治疗 用注射用水4mL溶解表阿霉素50~80mg,用法国GUERBET超液态碘化油充分混合乳化。通过DSA造影明确肿瘤供血动脉,运用微导管将混合乳剂以1mL/min的速度超选栓塞到肿瘤供血动脉中。如肿瘤血管血流停滞,再用350~560μm的PVA颗粒栓塞到肿瘤供血动脉中直至到达栓塞终点。
1.3 观察指标 (1)记录两组治疗前及治疗后3、6、12个月的MR检查结果,根据改良实体瘤疗效评价标准(mRECIST)进行评价,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD),疾病有效率(RR)为 CR+PR,疾病控制率(DCR)为CR+PR+SD,评价两组RR及DCR以及两组3、6、12、24 个月生存率(OS)。(2)比较首次治疗前与治疗后7天、1个月的肝功能变化。(3)根据NCI制定的CTCAE 4.0标准[4]评价术后不良反应及并发症。
1.4 统计学处理 采用SPSS22.0软件进行统计分析,计量资料用(±s)表示,采用 t检验;计数资料用百分率表示,采用χ2检验;生存率的比较采用Log-rank检验。
2 结果
2.1 疗效 两组术后3、6及12个月的RR及DCR差异无统计学意义(P>0.05)。详见表2。

表2 术后疗效评价[n(%)]
2.2 肝功能 介入治疗后7天,cTACE组ALT、AST及总胆红素(TBIL)较DEB-TACE组高,差异有统计学意义(P<0.05),两组 ALB术后 7天、1个月比较差异均无统计学意义(P>0.05);介入治疗后1个月,两组肝功能比较差异无统计学意义(P>0.05)。详见表3。
2.3 并发症 介入治疗术后,两组在发热及腹痛腹胀方面比较差异无统计学意义(P>0.05);cTACE组恶心呕吐的发生率较DEB-TACE组高,差异有统计学意义(P<0.05)。详见表 4。
2.4 生存率 两组随访终点截止初次治疗后的24个月或患者死亡。截至随访终点,cTACE组中位随访时间为17.0个月,其6、12、24个月的累积生存率分别为89%、74%和41%;DEB-TACE组中位随访时间为17.5个月,其6、12、24个月的累积生存率分别为95%、78%和48%。对两组的生存率差异经Log-Rank检验无统计学意义(P>0.05)。
表3 两组手术后肝功能变化比较(±s)
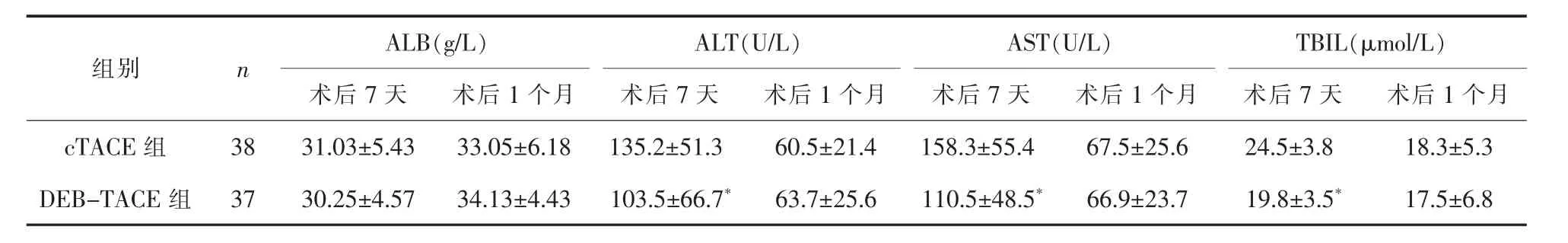
表3 两组手术后肝功能变化比较(±s)
与cTACE组比较*P<0.05
ALB(g/L) ALT(U/L) AST(U/L) TBIL(μmol/L)术后7天 术后1个月 术后7天 术后1个月 术后7天 术后1个月 术后7天 术后1个月cTACE 组 38 31.03±5.43 33.05±6.18 135.2±51.3 60.5±21.4 158.3±55.4 67.5±25.6 24.5±3.8 18.3±5.3 DEB-TACE 组 37 30.25±4.57 34.13±4.43 103.5±66.7* 63.7±25.6 110.5±48.5* 66.9±23.7 19.8±3.5* 17.5±6.8组别 n

表4 两组术后并发症比较(n)
3 讨论
原发性肝癌的治疗目前仍以手术治疗为主。对于无法进行手术切除的中期肝癌患者的治疗临床推荐cTACE法。cTACE法常用碘油与化疗药混合成乳剂治疗,使化疗药物进入全身循环系统,降低了局部疗效、增加了全身不良反应。在肝癌治疗中,药物的持续释放以及肿瘤内部维持一定的药物浓度有着重要的治疗作用,而药物缓释微球(drug eluting beads,DEB)恰好解决了此问题。DEB-TACE在国外已有较成熟的经验,国内也有少量文献报道[5-6]。这种新型的栓塞剂可以和碘油化疗药物混悬剂一样,在TACE的治疗过程中实现动脉内注射,不仅可以实现精准、可控的栓塞平面,还能使承载药物的微球与血管壁密切贴合,并局限在肿瘤内部持续释放,其携载表阿霉素的剂量远大于cTACE法。
CalliSpheres载药栓塞微球经动脉栓塞化疗治疗不可切除原发性肝癌,目前国内已有相关报道[7],根据RECIST标准,疾病缓解率和疾病控制率治疗后1个月分别为70.6%和94.1%,治疗后3个月分别为58.8%和76.5%;治疗后6个月分别为23.5%和58.8%。本研究结果显示,DEB-TACE组疾病缓解率和疾病控制率治疗后6个月分别为35.1%和67.6%,和 cTACE组比较差异无统计学意义(P>0.05)。在生存率方面,24个月生存率DEB-TACE组高于cTACE组,但两组差异无统计学意义(P>0.05)。在肝功能方面,TACE术后肝功能变化主要表现在术后7天,本文术后7天DEB-TACE组肝功能损害较轻,主要因为载药微球基本在病灶内释放化疗药物,使全身毒性及肝脏毒性反应较轻;另外,由于载药微球粒径较碘油大,不容易漏入正常肝组织及门脉小分支,对正常肝组织影响较小。本组栓塞后7天均出现ALT、TBIL的轻度升高,但术后1个月肝功能均已恢复,未出现肝功能衰竭、胆汁瘤、肝脓肿、肿瘤破裂出血等并发症。术后并发症方面,90%以上患者在cTACE治疗后都会出现栓塞术后综合征,但不良反应均轻微,患者耐受性好[8]。本组DEB-TACE栓塞术后大部分出现发热、腹痛腹胀及恶心呕吐等并发症,cTACE组在消化道症状方面的并发症发生率较DEB-TACE 组高(P<0.05),说明与 cTACE 治疗相比,DEB-TACE治疗并未加重患者阿霉素的相关不良反应发生率。
综上所述,DEB-TACE治疗不可切除的原发性肝癌安全有效,患者耐受性较好,且术后消化道并发症相对较少。
