3种林下灌木竹种地上竞争的可塑性响应
2019-04-02潘雁红田新立李伟成
潘雁红, 田新立, 李伟成,2*
3种林下灌木竹种地上竞争的可塑性响应
潘雁红1, 田新立1, 李伟成1,2*
1. 国家林业和草原局竹子研究开发中心/浙江省竹子高效加工重点实验室, 杭州 310012 2. 西南林业大学生命科学学院, 昆明 650224
林下灌草层物种种群内竞争是森林生态系统发育和演替研究的重要组成部分。通过模拟去除边缘效应, 对3种赤竹属灌木竹种——铺地竹()、菲黄竹()、菲白竹()3种植物对地上竞争的可塑性响应研究。研究发现: (1)3种赤竹属竹种的垂直结构和器官(根、茎和叶)表征了在进化尺度上3种植物内源的相似性和表型可塑性差异; (2)根冠比表明在高密度条件下菲黄竹投入到地上部生物量大于低密度条件, 菲白竹类似, 铺地竹则相反, 3物种在向最大生长速率进化的过程中, 遇到生理(光合)和分配之间的交换关系而产生的矛盾选择; (3)菲黄竹与菲白竹较慢的光合速率, 表明在生理上已经对高密度处理产生可塑性变化, 并且这种可塑性是以缩短叶寿命为代价的。
赤竹属; 表型可塑性; 地上竞争; 生长分析
0 前言
表型可塑性是具有相同基因型的物种在变化的环境条件下产生多个表现型的特性。表型可塑性行为是物种适应环境变化的有效方法, 由竞争导致的表型可塑性变化, 因提升、削弱或不影响植物的竞争能力, 而对最终种内和种间竞争结果(共存或排斥)起到决定性作用。
竞争是生态学研究的重要领域[1], 物种的生长状况主要受竞争、压力和干扰(自然和人类活动形成的限制因子)的综合影响[2-3]。研究植物种内竞争及其对竞争产生的可塑性响应和种间差异性在进化生物学上具有重要意义, 对系统分析森林植物群落、生态系统发育和演替规律过程机制十分关键[4]。在大多数情况下, 植物都会发生地上部和地下部竞争[5], 有关在有限资源环境中植物生长发育的研究对生物量分配倍感关注[6-7]。植物地上部竞争发生时, 由于植物是通过邻域植株冠幅改变红/红外波长比例来感知竞争的存在, 而地上生长的响应可以在邻域遮荫形成前发生[8], 故对于光竞争而言其营养器官和繁殖器官的数量特征变化并不同步, 而地下部的竞争在尺度上是同步的, 因此使用地上部器官的生长分析参数就显得较为直接和简捷[9]。
铺地竹(E.G.Camus)、菲黄竹(E. G. Camus)、菲白竹((Van Houtte) Fiori)均为竹亚科赤竹属多年生灌木。3种林下灌木竹种的地上部器官和结构的差异性为研究物种内和物种间竞争的异质性提供了材料。本实验的目的是模拟3种植物在种内植株竞争资源时, 研究植物在胁迫情况下的生物量分配, 比较3种植物异速生长对竞争的响应, 探讨生物量的最佳分配情况及其微进化意义, 为竹类资源的保护及可持续利用提供理论依据。
1 材料与方法
1.1 实验设计
2015年8—9月采用3种植物的带根鞭单株植株种植在直径为6.7 cm、高15 cm的塑料花盆中进行培苗, 栽种所用土壤为黄泥土, 有机质含量为28.2—37.34 g·kg-1, 全氮含量1.35—2.47 g·kg-1, 速效磷含量8.87—21.33 mg·kg-1, 速效钾含量60.69—108.71 mg·kg-1; 设置2个地上竞争梯度, 即通过改变花盆之间的距离得到低密度和高密度2个竞争梯度, 每个梯度3个重复。低密度种群为100株·m-2, 实验设10行10列共100盆植株, 每盆中心点之间间隔10 cm, 为了避免边缘效应, 周边植株不统计在内; 高密度种群为225株·m-2, 实验设15行15列共225盆植株, 每盆之间紧密相邻, 周边植株不统计。塑料盆被埋在土壤中, 盆沿与土壤面相平, 减小盆内的温度差异。每隔1—3 d补给1次水分, 通过塑料盆底部2个1 cm左右的圆孔进行排水。
1.2 数据处理
2016年10月中旬结束整个生长期后, 将植株在土壤表面截断, 地上部分被分为叶和茎两部分。总叶面积通过扫描仪对所有叶面进行扫描累加得到, 叶面积用来计算SLA, 然后地上部在80℃烘箱内烘至恒重, 称重。根从土壤中分离出用水洗净, 置于烘箱内烘至恒重, 称重。总地上生物量由茎和叶两部分相加得到。
可塑性研究包括与资源获取直接相关的地上和地下特征的详细描述。故计算以下生长分析参数: 根冠比(root/shoot)=根生物量/地上生物量; 比叶面积=叶面积/叶生物量(SLA, specific leaf area ); 叶面积比=总叶面积/总生物量(LAR, leaf area ratio), 直接影响光合作用中的光获取; 叶生物量比=叶生物量/总生物量(LMR, leaf mass ratio); 相对生长速率(RGR)=(LnW2-LnW1)/(T2-T1), 其中W1为刚种植时植株的生物量, W2为收割时的植物生物量, T1为刚种植时间, T2为收割时间[10]。
种内及处理间的差异显著性用SAS进行ANOVA和ANCOVA分析, 为了说明种群随机选择个体在实验中的影响, 种群作为一个随机变量(由于随机取样造成)并隐含在密度参数中(表1)进行计算; 同时, 由于SLA 的变化具有种的特异性, 故选择其作为其中一个自变量[11]。
采用最小显著差异法(LSD)比较不同处理间的差异显著性。
2 结果与分析
2.1 密度和随机样本对生物量分配的影响
从表1可以看到两种密度和种群的随机样本个体的差异对物种生物量分配的影响, 实验中总生物量分割为根(RMs)、茎(BMs)和叶生物量(LMs), BMs+LMs=SMs(地上部生物量)。ANCOVA表明: 菲黄竹的LMs和RMs分别以BMs和LMs作为协变量(p<0.001)时, LMs和RMs对密度的差异性达到极显著(p<0.001), 而种群的差异性仅为0.434和0.807; 菲白竹的LMs和RMs分别以BMs和SMs作为协变量(p<0.001)时, 情况与铺地竹类似, LMs和RMs对密度的差异性达到极显著(p<0.001), 而种群没有差异; SLA在没有协变量的情况下, 表现类似, 说明种群个体的随机取样对实验没有干扰。
2.2 物种可塑性响应
地上竞争显著影响了植物的生物量分配行为, 地上和地下部都有体现。菲黄竹平均生物量在高密度时比低密度大, 与地上生物量表现一致, 而地下生物量则相反; 虽然实验是在避免地下资源竞争的前提下进行的, 但地上竞争引起的生物量分配差异引起地下部分变化, 根生物量比表明两种梯度的平均生物量差异主要是地上生物量的贡献造成的(表2), 并且梯度之间差异显著(p<0.001)。根冠比体现了地上和地下生物量分配的差异: 由于地上、地下的分配在两种梯度下向两个方向发展, 高密度种群根冠比小于低密度, 表明菲黄竹在存在地上竞争时,其分配更多生物量到地上部, 以获得更多的光资源, ANOVA检验表明两种梯度下根冠比差异显著(p<0.001), 生物量频率范围较窄(图1), 没有差异变化(表1), 但两密度梯度的RGR表明相对生长速率在统计上没有差异(p=0.864)。LMR和LAR的方差分析也呈现极显著(p<0.001), 响应了根冠比的情况, 更体现了高密度下菲黄竹倾向于叶生物量的分配, 扩展了叶面积, 并且与SLA的分析是对应的, SLA差异极显著(p<0.001), 高密度明显大于低密度, 表明单位叶面积上生物量分配的可塑性响应, 菲黄竹在固定光源下的最大净光合速率低密度大于高密度且差异显著(p=0.003), 蒸腾速率则相反且差异显著(p=0.001)。
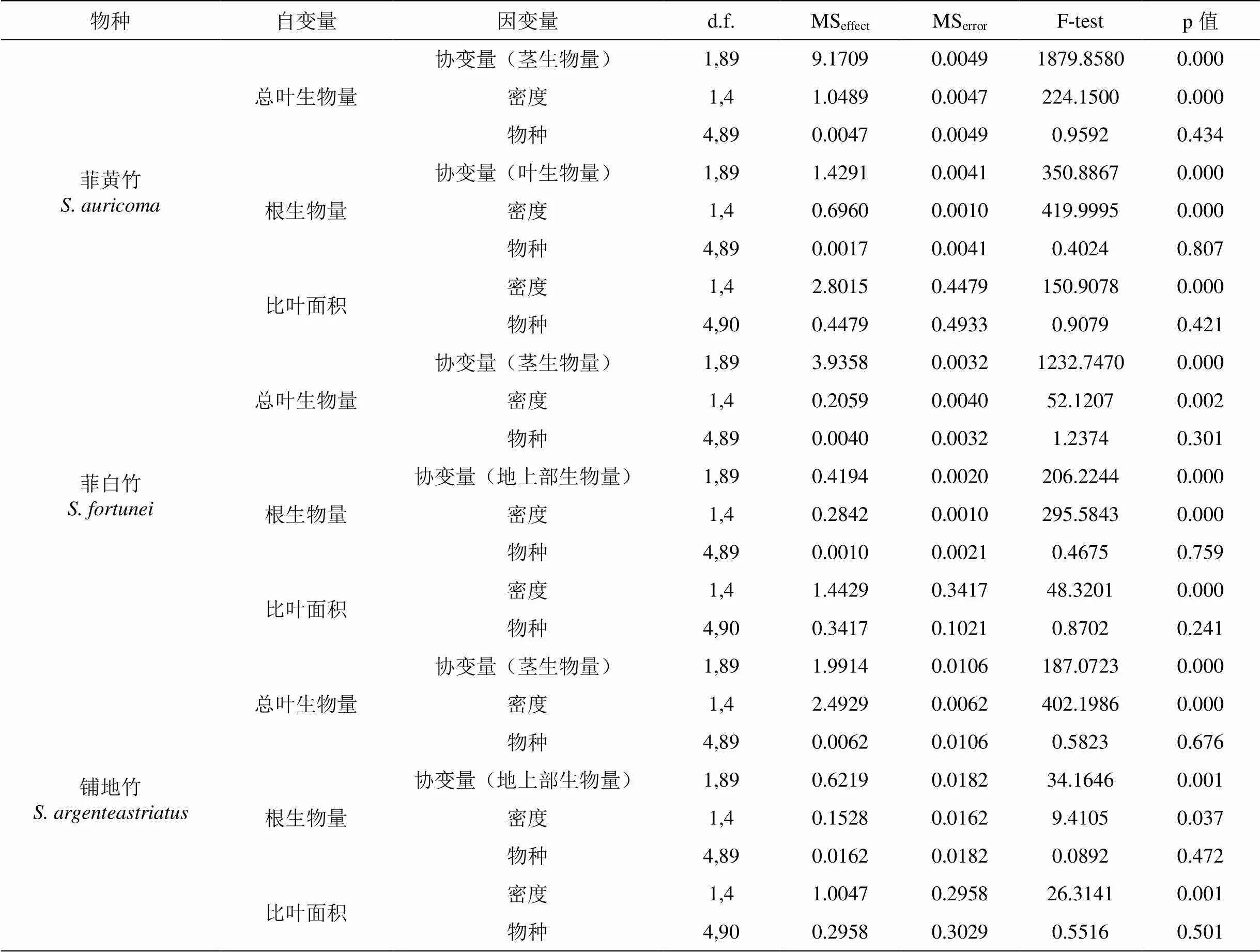
表 1 密度和种群对生物量分配的ANOVA和ANCOVA检验
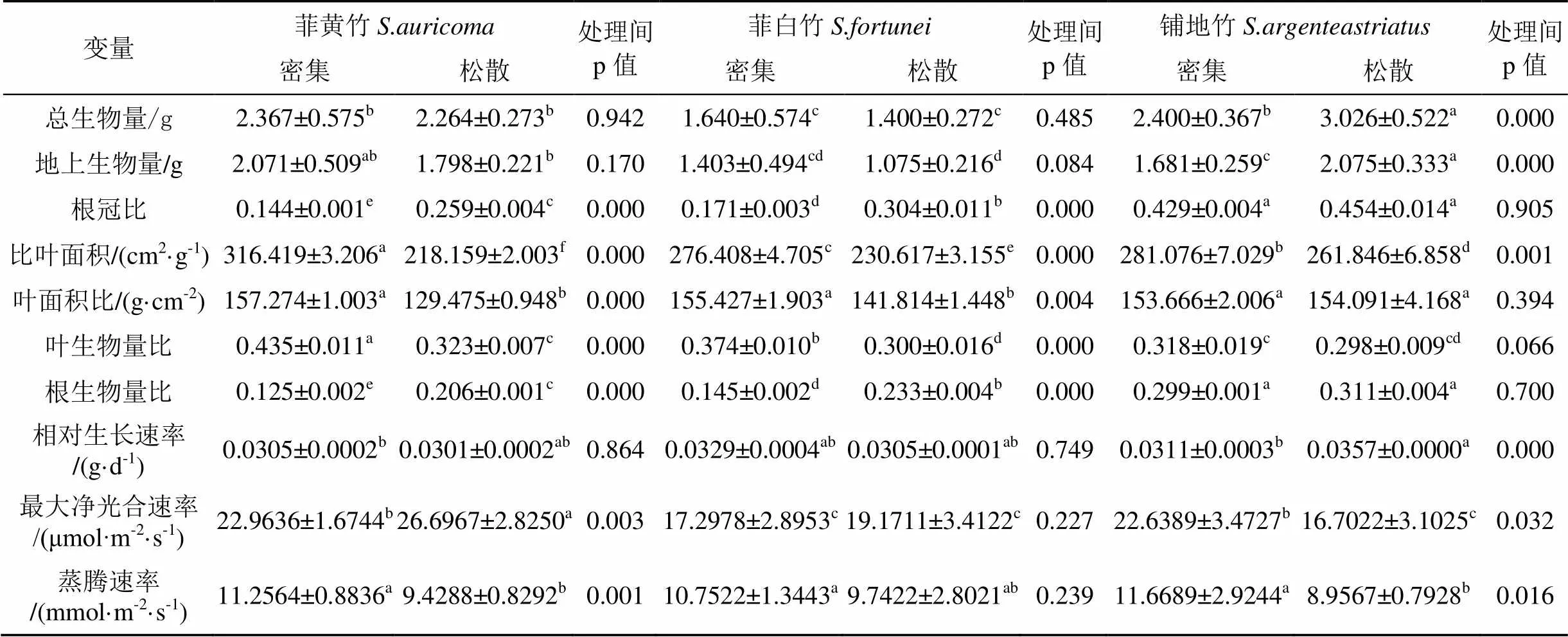
表 2 3种地被竹的生长分析和光合蒸腾速率
同行数据后的不同小写字母表示在<0.05水平差异有统计学意义。
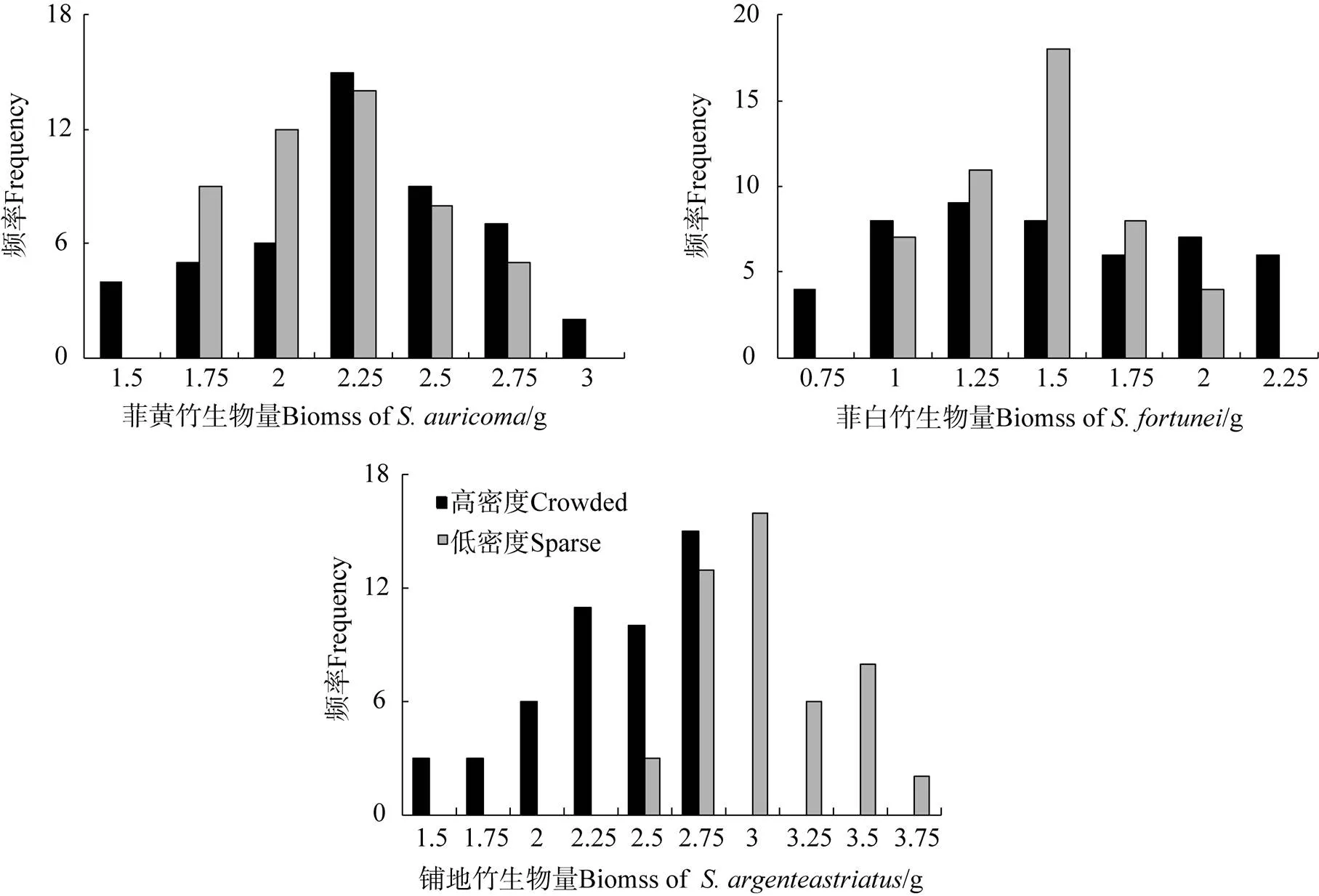
图1 3物种不同密度处理的生物量频率比较
Figure 1 Comparison of plant-size distribution for the crowed and sparse densities
菲白竹的可塑性表现与菲黄竹类似。菲白竹的平均生物量在高密度时比低密度大, 地上生物量也表现出同样情况, 而地下生物量则相反, 梯度之间根生物量比差异显著(p<0.001), 表明两种梯度的平均生物量差异主要是地上生物量的贡献造成(表1)。根冠比差异显著(p<0.001), 生物量频率与菲黄竹相仿, 但RGR表明相对生长速率在统计上没有差异(p=0.749), 但p的数值都略小于菲黄竹, 表现出物种自身在可塑性上的差异; 同时, LMR和LAR的方差分析分别达到极显著(p<0.001和p=0.004), 说明在高密度下菲白竹倾向于叶生物量的分配, 扩展了叶面积, SLA的差异(p<0.001)表明菲白竹在单位叶面积上生物量分配在高密度时明显大于低密度, 这与菲黄竹类似但又有自身的差异: 在竞争的情况下, 菲白竹地上部枝条互相遮掩, 其遮掩的密度和强度明显不及菲黄竹, 但这种小范围的遮掩还是导致了低的光子流密度, 促使了菲白竹具备了较高的叶生物量, 在一定程度上, 光合速率在低密度下上升但与高密度植株的表现并没有差异也可得到一定解释。
铺地竹的表现则与前两种物种有较大的差别, 甚至有些指标表现出相反的情况。两种梯度下的平均生物量差异极显著(p<0.001), 在高密度种群时比低密度种群小, 与地上生物量表现一致(p<0.001); 根生物量比(表2)表明地下生物量在高密度种群时比低密度种群小, 趋势与前两种物种类似, 但两种梯度下差异不显著(p=0.700); 根冠比差异亦不显著(p=0.905), 说明两种密度梯度下铺地竹在平衡地上和地下生物量分配时比前两种物种稳定, 生物量频率弹性范围大, RGR表明相对生长速率在统计上差异极显著(p<0.001), 说明了铺地竹在生长速率上于平衡根冠分配比例上起到了关键作用: 保持根系生物量的投入在没有统计学差异的同时, 加大了低密度植株的地上生物量投入, 从另一个方面体现了铺地竹对地下根系的依赖程度较高, LMR存在的差异(p=0.066)也说明这个问题, 但LAR差异不显著(p=0.394), 且高密度小于低密度, 表明低密度下的较弱竞争有利于整体生长, 不利于铺地竹叶生物量的分配, 但叶面积得到一定的扩展; SLA差异极显著(p<0.001)表明高密度单位叶面积上生物量分配大于低密度, 铺地竹在高密度下地上部冠型、枝条互相遮掩较少或几乎没有遮掩, 降低了光子流密度的影响, 所以在SLA平均值得到了体现, 同时在光合速率上可以清晰地看到高密度明显大于低密度(p=0.032), 与前两者截然相反。
3 讨论
3.1 植株株型结构
表形可塑性差异是由基因型和环境因素共同造成, 遗传物质的存在为其形态构建、生理代谢和遗传变异的正常进行提供了潜在的可能性, 物种株型对地上、地下和器官生物量分配起到了关键作用[7], 本实验发现菲黄竹和菲白竹的地上部和地下部整体结构与铺地竹之间存在着一定差异, 菲黄竹和菲白竹同属一个类型, 因此, 根、茎、叶等宏观器官都表征了菲黄竹和菲白竹内源和表型可塑性的相似性, 而铺地竹在生物量、根冠比、叶面积比、叶生物量比、根生物量比、相对生长速率和光合速率上都表现出了相反的趋势。3种植物的叶生物量比、比叶面积随可获得光的增加而降低说明了不同冠层和垂直结构对密度的响应。同时, 在本实验中, 内源性的稳定性对外界环境变化和压力的响应得到了体现。菲黄竹在低密度下的高光合速率得益于其较强大近乎伞状的叶冠, 其在竞争的情况下, 由于地上部枝条形状而互相遮掩, 适应了低的光流密度而具备了较高的叶生物量和较大的叶面积, 这与Sultan[12]和Sloan[13]的结果类似, 高密度条件下光合速率显著小于低密度条件下; 铺地竹的株型造成了高密度下其表现出相反的情况, 而菲白竹在两种密度梯度下光合速率没有差异。
3.2 生物量分配
植物的生长发育过程, 是一个不断调整其生长和营养物质分配策略的过程[2], 并且遵循生长与物质分配相协调原则。从根冠比可以看到菲黄竹在高密度下投入到地上部的生物量大于低密度下, 菲白竹类似, 铺地竹则相反, 铺地竹这种表现与Casper等[6]研究地下根茎类的植物行为类似。从生物量频率看铺地竹生物量范围明显大于其他两物种, 说明在生长发育过程中其生物量分配的弹性范围更大, 菲黄竹分配到叶的生物量的减少, 表明为了保持其植株的机械稳定性, 当存在地上部竞争时, 其分配更多生物量到地上支撑系统(木质化茎), 冠幅越大的植物越不得不分配过量的生物量到支持组织(茎和枝)中去, 以获得更多的光资源[14]; 尽管地上竞争对植物行为有很大影响, 而铺地竹在两种密度梯度下根冠比并没有发生显著变化, 对密度的响应比菲黄竹和菲白竹迟钝, 但铺地竹在比叶面积上还是体现了一定的可塑性, 同时表现出明显的异速生长。Anten等[9]在研究高原草原的物种中认为相对生长速率依赖叶面积比的程度, 从草本向木本会增强, 但本实验从铺地竹的木质化茎、枝到菲白竹、菲黄竹(草本结构)来看并没有这种趋势。这3种林下竹种的生长能力, 从其光合速率、比叶面积和相对生长速率比较可以看到: 在非光合成分(即结构物质)分配量提高的同时, 任何以叶为基础的参数都在下降, 其在向最大生长速率进化的斗争中, 遇到了生理(光合)和分配之间面临的矛盾选择[15-16]。
3.2 表型可塑性与生态位
叶通常作为植物碳收获策略的关键性状之一[17], 具有较高比叶面积的植物种类, 叶平均寿命较低, 但叶的光捕获面积、单位重量的叶氮含量较高, 并导致较高的净光合速率[16,18], 这可以解释菲黄竹与菲白竹较慢的光合速率, 表明在生理上已经对高密度处理产生可塑性变化, 并且这种可塑性是以缩短叶寿命为代价。同时, 总生物量是宏观判断生长优劣的参数, 因为铺地竹的生物量频率变化明显, 差异显著, 所以菲黄竹、菲白竹比铺地竹更能适应密度变化, 可能是资源分配并未达到限制生理和生长发育的一定阀值[19], 所以在适应高密度生境时菲黄竹采用的可能是耐受性策略, 但这对种群的扩大并不有利, 而铺地竹的情况却相反: 在观察到的逸生于林下和林缘群落中的菲白竹和菲黄竹两物种并不占优势, 在群落中处于伴生或退出群落的状态, 需要开阔地带或林窗, 铺地竹则可低密度逸生出现在群落中, 可渐渐扩大种群数量并依赖集体优势在群落中成为优势物种。目前, 表型可塑性是否推动物种进化的速度还在讨论中[17], 本研究发现菲黄竹理论和实际生态位存在着差异, 可塑性虽然增加了生存弹性范围, 但降低了其种间竞争的能力; 而就本实验的两种密度而言, 铺地竹适应于低密度环境, 具有较大的种间竞争能力。
物种性状与其种内和种间的适合度相关, 种群和群落物种的密度决定了其存活、繁殖和扩散能力。本实验的密度梯度设计尚存缺憾, 由于物种自身的生物学特性和排除竞争环境干扰因素的需要, 未能完整体现3种林下灌木竹种在多个密度梯度下的功能性状, 未来研究的重点将侧重于铸模立体定点栽植分配空间和缩短实验时间来控制竹种的生物学特性, 以保障多密度梯度的体现。
4 结论
菲黄竹、菲白竹的地上部和地下部整体结构、生物量分配与生态位同属一个类型, 两者的宏观器官具有内源性, 其生物量分配策略和表型可塑性的有相似性, 而铺地竹则表现出了相反的趋势。同时, 菲黄竹理论和实际的光生态位存在着差异, 铺地竹适合低密度环境, 具有较大的种间竞争能力。
[1] 莫昌健, 韩晓卓. 生态位构建作用对捕食-竞争系统的影响[J]. 生态科学, 2016, 35(5): 73–81.
[2] GRIME J P. Vegetation classification by reference to strategies[J]. Nature, 1974, 250: 26–31.
[3] 陈洁, 周年兴, 李灿, 等. 集合种群竞争机制在庐山森林演替模拟中的应用[J]. 生态学杂志, 2017, 36(3): 862– 868.
[4] NICOLAS M M, COLLARD A, BUSSET H, et al. Investigating and modelling the morphological plasticity of weeds[J]. Field Crops Research, 2014, 155: 90–98.
[5] RYSER P, EEK L. Consequences of phenotypic plasticity vs. interspecific differences in leaf and root traits for acquisition of aboveground and belowground resources[J]. American Journal of Botany, 2000, 87(3): 402–411.
[6] CASPER B B, CAHILL J F, HYATT L. Above-ground competition does not alter biomass allocated to roots in[J]. New Phytologists, 1998, 140(2): 231–238.
[7] HO M D, MCCANNON B C, LYNCHA J P. Optimization modeling of plant root architecture for water and phosphorus acquisition[J]. Journal of Theoretical Biology, 2004, 226: 331–340.
[8] APHALO P J, BALLARE C L. On the importance of information acquiring systems in plant-plant interactions[J]. Functional Ecology, 1995, 9(1): 5–14.
[9] ANTEN N P R, HIROSE T, Intraspecific differences in above-ground growth patterns result in spatial and temporal partitioning of light among species in a tall-grass meadow[J]. Journal of Ecology, 2008, 87(4): 583–597.
[10] 盛海燕, 李伟成, 葛滢. 明党参幼苗存活与生长对光照强度的响应[J]. 应用生态学报, 2006, 17(5): 1423–1428.
[11] Diemer M. Life span and dynamics of leaves of herbaceous perennials in high‐elevation environments: ‘news from the elephant’s leg’[J]. Functional Ecology, 1998, 12(3): 413–425.
[12] SULTAN E S. Phenotypic plasticity for plant development, function and life history[J]. Trends in plant Science, 2001, 5(12): 537–542.
[13] SLOAN J L, USCOLA MERCEDES, JACOBS D F. Nitrogen recovery in planted seedlings, competing vegetation, and soil in response to fertilization on a boreal mine reclamation site[J]. Forest Ecology and Management, 2016, 360: 60–68.
[14] CAHILL J F. Interactions between root and shoot competition vary among species[J]. Oikos, 2002, 99(1): 101–102.
[15] HUNT R, CORNELISSEN J H C. Physiology, allocation and growth rate: a reexamination of the Tilman model[J]. American Naturalist, 1997, 150(1): 122–130.
[16] SEGHIERI J, LALOË F. Characterization of the variability of the daily course of leaf water potential in the dominant shrub species within Sahelian fallows in south-west Niger[J]. Ecological Modelling, 2004, 173: 271–281.
[17] WRIGHT I J, WESTOBY M, REICH P B. Convergence towards higher leaf mass per area in dry and nutrient-poor habitats has different consequences for leaf life span[J]. Journal of Ecology, 2002, 90(3): 534–543.
[18] TOKUOKA Y, OHIGASHI K, WATANABE K, et al. Removal of competitive native species combined with tree planting can accelerate the initial afforestation process: an experiment in an old field in Japan invaded by dwarf bamboo and kudzu[J]. Journal of Forest Research, 2015, 26(3): 581–588.
[19] NOVOPLANSKY A. Developmental plasticity in plants: implications of non-cognitive behavior[J]. Evolutionary Ecology, 2002, 16(3): 177–188.
The plasticity response to above-ground competition of three understory dwarf bamboo species
PAN Yanhong1, TIAN Xinli1, LI Weicheng1,2*
1. China National Bamboo Research Center/Key Laboratory of High Efficient Processing of Bamboo of Zhejiang Province, Hanzghou 310012, China 2. College of Life Sciences, Southwest Forestry University, Kunming 650224, China
Phenotypic plasticity is often described as the responses of organisms to environmental conditions or stimuli. The study of the interspecific and intraspecific competitive relationship is important to understand the analysis of community and the developmental ecological system. Therefore, the main aim of this paper is to study the plasticity response to above-ground competition of three dwarf bamboo species (,and), and discuss the optimal biomass allocation according to their micro-evolution significance. Plasticity differences among species have important implications in terms of ecological and evolutional consequence. ANCOVA shows there are no differences when the effects of population and density treatments added to the experiment. Through all of the data we concluded that: 1. The crown, vertical structure and macro-organic (e.g. root, branch and leaf) difference among those three species exhibit the inner similarity and the response behavior of phenotypic plasticity drawing from the data of SLA and LMR. 2. According to the data of root/shoot, the above-ground biomass ofunder crowded treatment is higher similar withbut contrary to. Meanwhile, the total biomassshowsandare more adaptive in the density treatment thanbecause they are inclined to spend more trade-off on the behavior of optimal allocation. In the process of pursuing the maximal growth rate, however, they must face the contradiction selection when they are in the exchange relationship between physiology and allocation. 3.andrespond the crowded treatment with the slow photosynthesis rate, and moreover, represent the trade-off behavior with shorting the longevity of leaf.
; Phenotypic plasticity; Above-ground competition; Growth analysis
10.14108/j.cnki.1008-8873.2019.01.020
Q948.1
A
1008-8873(2019)01-152-07
2018-01-11;
2018-03-05
中央级公益性科研院所基本科研业务费专项(CAFYBB2017MB031); 浙江省省院合作林业科技项目(2015SY06); 浙江省科技计划项目 (2016F50008); 浙江省自然科学基金(LY14C030008)
潘雁红(1978—), 女, 硕士, 工程师, 主要从事竹林生态学研究
李伟成(1978—), 男, 博士, 副研究员, 主要从事生态学研究, E-mail: lee_caf@163.com
潘雁红, 田新立, 李伟成, 等. 3种林下灌木竹种地上竞争的可塑性响应[J]. 生态科学, 2019, 38(1): 152-158.
PAN Yanhong, TIAN Xinli, LI Weicheng, et al. The plasticity response to above-ground competition of three understory dwarf bamboo species[J]. Ecological Science, 2019, 38(1): 152-158.
