甘草查尔酮A调控人结肠癌细胞增殖与凋亡的分子机制研究①
2019-04-02张九成陈卫东
张九成 陈卫东 邹 宁
(湖北省肿瘤医院腹部放疗二病区,湖北省结直肠癌临床医学研究中心,武汉 430079)
结肠癌是最常见的胃肠道癌症之一[1]。近些年,随着经济的快速增长及人们生活方式的改变,尤其是饮食结构的变化,结肠癌已成为发病率上升最快的恶性肿瘤之一,严重威胁着人们的生命与健康。已有研究显示,结肠癌的死亡率已跃居全世界癌症死亡率的第二位,在我国也已达到第四位[2]。目前,结直肠癌治疗的主要手段有手术切除、放疗、化疗,但由于其高发生率,低治愈率以及较差的预后,这些治疗手段并不是十分理想,所以迫切需要寻找新的治疗策略来提高结肠癌患者的生存率[3]。天然产物作为抗肿瘤药物的重要来源,具有效果显著、机制独特、毒副作用小等优势[4]。因此,寻找作用效果好且毒副作用低的抗结肠癌天然产物具有很好的科学意义和临床价值。
甘草在我国药用历史悠久,在传统医学中被广泛应用。甘草查尔酮A(Licochalcone A,LCA)是从甘草植物中提取的一种黄酮类化合物,主要分布在甘草的根和茎中,具有多种药理活性,如抗癌、抗炎、抗氧化和调节免疫等[5]。近年来研究表明LCA具有良好的抗肿瘤活性,对肺癌、胃癌、宫颈癌等均显示出较好的抑制作用[6]。LCA主要通过诱导肿瘤细胞周期阻滞和凋亡等途径来选择性地抑制多种肿瘤细胞生长[7]。此外,也有研究表明氧化应激在LCA的抗肿瘤活性中发挥着重要作用[8]。因此,本研究将进一步验证LCA良好的抗肿瘤活性,并阐明其具体的分子作用机制,旨在为结直肠癌的治疗提供新药物及靶标。
1 材料与方法
1.1材料
1.1.1实验材料 细胞株:人结肠癌HCT116细胞株(货号:ATCCCCL-247)购自美国菌种保藏中心;SW480(货号:TCHu172)细胞株购自中科院细胞库。
实验试剂:RPMI1640培养基(货号:11875101)、胎牛血清(货号:26140079)、青霉素-链霉素(货号:15140148)购自美国Gibco公司;LCA购自成都瑞芬思生物科技有限公司(纯度≥98%,货号:58749-22-7);MTT细胞增殖及细胞毒性检测试剂盒(货号:M1020-500)购自北京索莱宝科技有限公司;Annexin V-FITC/PI双染细胞凋亡检测试剂盒(货号:KGA106)购自江苏凯基生物技术股份有限公司;ROS抑制剂NAC(纯度>99%,货号:S0077)、活性氧ROS检测(DCFH-DA探针法)试剂盒(货号:S0033)购自上海碧云天生物技术有限公司;BCA法蛋白定量测定试剂盒(货号:A045-3)及全蛋白提取试剂盒(货号:W034)购自南京建成生物技术有限公司;抗ATF6抗体(货号:24169-1-AP)、抗XBP-1抗体(货号:25997-1-AP)、抗ATF4抗体(货号:10835-1-AP)、抗CHOP抗体(货号:15204-1-AP)、抗Bcl2抗体(货号:26593-1-AP)、抗Bax抗体(货号:50599-2-Ig)、抗GAPDH抗体(货号:10494-1-AP)的兔多克隆一抗以及山羊抗兔IgG二抗(货号:10285-1-AP)购自武汉三鹰生物技术有限公司;Anti-active Caspase3抗体(货号:ab2302)购自Abcam公司。
1.1.2主要仪器 3111型CO2培养箱(Thermo,美国)、倒置显微镜(尼康,日本)、凝胶处理分析系统(ABI,美国)、低温冷冻离心机(Eppendorf,德国)、酶标仪(Bio-Tek,美国)、FC500型流式细胞仪(Beckman,美国)等。
1.2方法
1.2.1细胞培养 人结肠癌细胞HCT116和SW480均培养在含有10%胎牛血清、青霉素100 U/ml、链霉素100 μg/ml的RPMI1640完全培养基中;培养条件:37℃,CO2体积分数为5%饱和湿度的培养箱中培养。根据细胞生长状态定期换液,待细胞接近长满培养瓶底部时,用0.25%的胰酶消化传代。在正式实验开始之前,需对细胞进行同步化培养处理后再进行分组及药物处理。
1.2.2MTT法检测LCA对HCT116和SW480的增殖抑制作用 取生长处于对数期的HCT116或SW480细胞,按照1.0×105ml-1浓度接种于96孔培养板中。将细胞分为7组,分别为空白对照组、1.0 μmol/L 的LCA药物组、2.5 μmol/L的LCA药物组、5 μmol/L的LCA药物组、10 μmol/L的LCA药物组、25 μmol/L的LCA药物组以及50 μmol/L的LCA药物组,每组设置3平行复孔。37℃,CO2体积分数为5%饱和湿度的培养箱中培养48 h,分别在12 h、24 h和48 h测量各孔细胞的吸光度(OD)并记录,计算各组细胞在不同生长时间点的生长抑制率,抑制率(%)=(1-药物组平均OD值/对照组平均OD值)×100%。以时间点为横坐标,以抑制率为纵坐标,绘制各组细胞的生长抑制率变化统计图,并采用Bliss法计算LCA在48 h对HCT116和SW480细胞的半抑制浓度(IC50)值。
1.2.3Annexin V-FITC/PI双染检测各组HCT116细胞凋亡水平 取生长处于对数期的HCT116细胞,按照1.0×105ml-1浓度接种于96孔培养板中。将细胞分为4组,分别为对照组(含10%FBS的完全培养基),LCA组(含50 μmol/L的LCA),N-乙酰半胱氨酸(N-Acetyl-L-cysteine,NAC)组(含5 mmol/L的NAC)以及LCA+NAC组(5 mmol/L的NAC预先孵育1 h,再加50 μmol/L的LCA),每组设置3平行复孔,用药后常规培养24 h。后根据下列操作检测各组细胞凋亡率:①1 000 r/min离心5 min,弃上清,收集细胞;②加入1 ml预冷的PBS,轻轻振荡使细胞悬浮,1 000 r/min,4°C离心5 min,弃上清;③重复步骤②两次;④将细胞重悬于200 μl的Binding Buffer;加入10 μl Annexin V-FITC和10 μl PI,轻轻混匀,4°C避光孵育30 min;⑤加入300 μl Binding Buffer,随即进行流式细胞仪检测;⑥使用CXP分析软件进行分析并记录结果。总凋亡率=第二象限B2细胞占比+第四象限B4细胞占比。
1.2.4各组HCT116细胞活性氧(ROS)水平检测 取对数生长期的HCT116细胞,按照1.0×105ml-1浓度接种于96孔培养板中。将细胞分为4组,分别为对照组(含10%FBS的完全培养基),LCA组(含50 μmol/L 的LCA),NAC组(含5 mmol/L的NAC)以及LCA+NAC组(5 mmol/L的NAC预先孵育1 h,再加50 μmol/L的LCA),每组设置3平行复孔,用药后常规培养24 h。后根据下列操作检测各组细胞ROS水平:①1 000 r/min离心5 min,弃上清,收集细胞;②更换终浓度为10 μmol/L的ROS探针工作液(DCFH-DA)的无血清培养基;③37℃细胞培养箱中避光继续培养20 min,每隔3~5 min依次轻振荡混匀;④收集细胞,PBS洗涤、离心3次;⑤适量PBS重悬细胞,采用流式细胞仪检测细胞内荧光强度。
1.2.5Western blot检测各组HCT116细胞中内质网应激(Endoplasmic reticulum stress,ERS)及凋亡相关蛋白表达量 取对数生长期的HCT116细胞,按照1.0×105ml-1浓度接种于96孔培养板中。将细胞分为4组,分别为对照组(含10%FBS的完全培养基),LCA组(含50 μmol/L的LCA),NAC组(含5 mmol/L的NAC)以及LCA+NAC组(5 mmol/L的NAC预先孵育1 h,再加 50 μmol/L 的LCA),每组设置3个平行复孔,用药后常规培养24 h。后采用全蛋白提取试剂盒对各组HCT116细胞分别进行蛋白提取;用BCA蛋白浓度检测试剂盒对所提蛋白进行浓度检测;取20 μg蛋白和4 μl 2×SDS上样缓冲液混合均匀,100℃变性10 min;上样,SDS-PAGE凝胶电泳分离后转至PVDF膜上;用5%脱脂牛奶封闭1 h;PBS洗膜;PBS洗膜后分别加入一抗(ATF6、XBP-1、ATF4、CHOP、Bcl2、Bax、Cleaved-caspase3和GAPDH),在4℃下孵育过夜;PBS洗膜;加入HRP标记的羊抗兔IgG二抗(1∶5 000)室温孵育0.5 h;PBS洗膜;用ECL化学发光试剂盒进行显色。以GAPDH为内参蛋白,后采用Quantity One图像分析软件进行灰度比分析。

2 结果
2.1LCA抑制人直肠癌HCT116和SW480细胞的增殖 MTT检测结果显示(图1),LCA呈明显的时间和浓度依赖性抑制HCT116和SW480细胞的增殖。与同一时间点1 μmol/L的LCA作用效果比较,细胞增殖抑制率随LCA浓度的增加而显著增高(P<0.05,P<0.01);其中50 μmol/L的LCA作用细胞48 h后,HCT116和SW480细胞的增殖抑制率均高于80%,对细胞活力抑制效果显著。根据Bliss法计算得出LCA在48 h对HCT116和SW480细胞抑制浓度的IC50值分别为21.94 μmol/L和29.38 μmol/L,故后续实验我们选择抑制效果较好的HCT116细胞为研究对象。
2.2LCA促进人直肠癌HCT116细胞的ROS水平 流式检测结果显示(图2),与对照组比较,50 μmol/L 的LCA能显著增加HCT116细胞的ROS水平(P<0.01),而5 mmol/L的NAC处理HCT116细胞能显著降低ROS水平(P<0.01);与5 mmol/L的NAC处理组比较,加入50 μmol/L的LCA共孵育24 h能有效逆转NAC的抑制作用,显著增加细胞的ROS水平(P<0.01)。
2.3LCA促进人直肠癌HCT116细胞凋亡 流式细胞术检测细胞凋亡结果显示(图3),与对照组比较,50 μmol/L的LCA能显著促进HCT116细胞的凋亡(P<0.01),而采用5 mmol/L的ROS抑制剂NAC处理HCT116细胞,细胞的凋亡率显著下降(P<0.05);与5 mmol/L的NAC处理组比较,加入50 μmol/L的LCA共孵育24 h能有效逆转NAC对HCT116细胞凋亡的抑制作用,显著增加细胞的凋亡率(P<0.01)。

图1 MTT法检测不同浓度LCA对HCT116和SW480细胞活性的影响Fig.1 Determining effect of different concentrations of LCA on viability of HCT116 and SW480 cells by MTT assay

图2 流式细胞术检测各组细胞ROS水平Fig.2 ROS levels in each group of cells were detected by flow cytometry

图3 流式细胞术检测各组细胞凋亡率Fig.3 Apoptosis rates in each group of cells were detected by flow cytometry
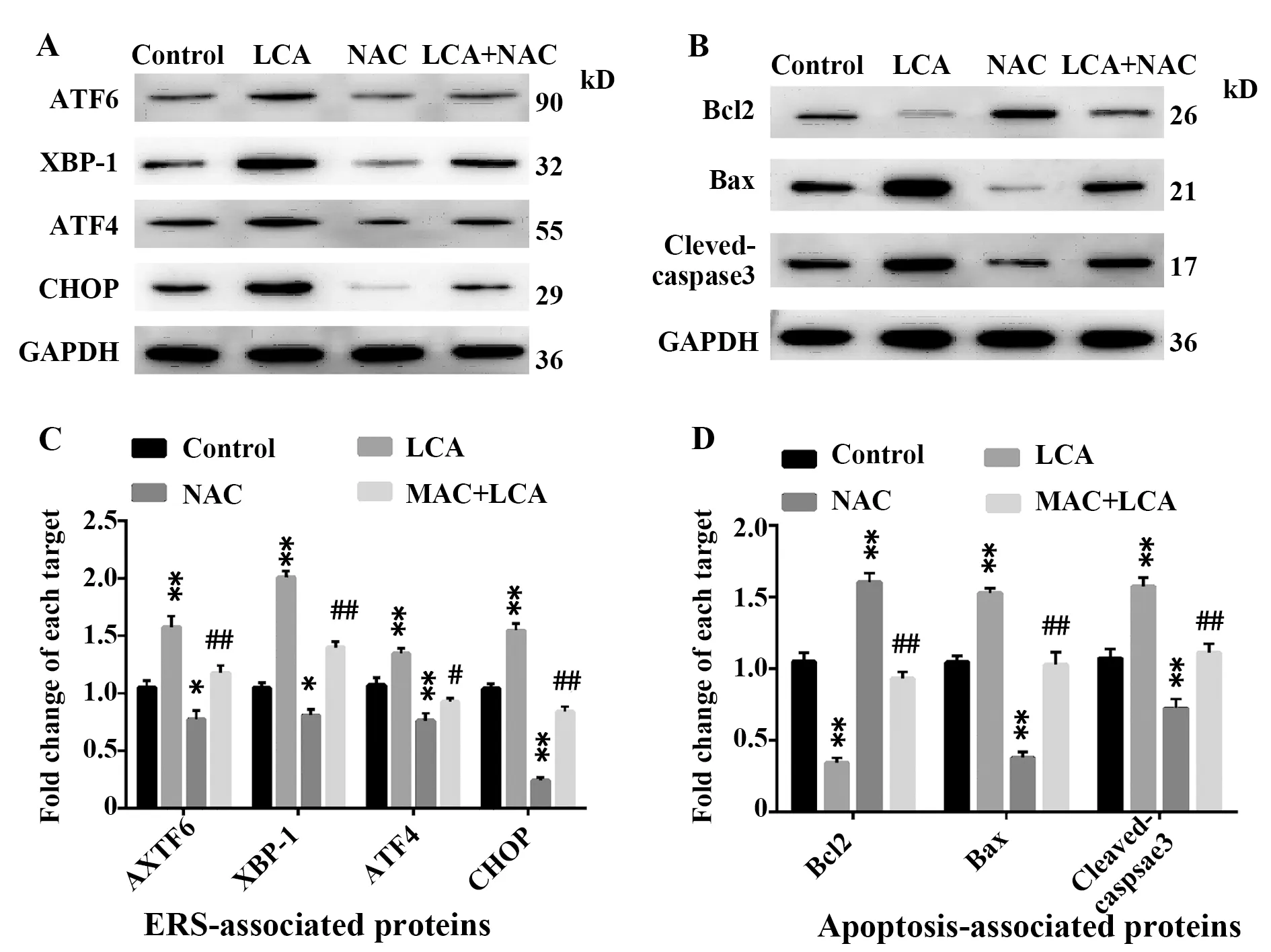
图4 Western blot检测各组细胞ERS及凋亡相关蛋白的表达水平Fig.4 Determining levels of ERS and apoptosis-related proteins in each group of cells by Western blot
2.4LCA上调人直肠癌HCT116细胞内质网应激及凋亡相关蛋白的表达水平 Western blot检测结果显示(图4),与对照组比较,50 μmol/L的LCA处理组细胞中ERS相关蛋白ATF6、XBP-1、ATF4和CHOP以及凋亡相关蛋白中Bax和Cleaved-caspase3的表达水平均显著升高(P<0.01),而采用5 mmol/L的ROS抑制剂NAC处理HCT116细胞后,上述指标表达水平显著降低(P<0.05,P<0.01);相反地,与对照组比较,50 μmol/L的LCA处理组细胞中抗凋亡蛋白Bcl2表达水平显著降低(P<0.01),而 5 mmol/L 的NAC处理组Bcl2表达水平显著升高(P<0.01)。与5 mmol/L的NAC处理组比较,5 mmol/L NAC+50 μmol/L LCA组细胞中ATF6、XBP-1、ATF4、CHOP、Bax和Cleaved-caspase3表达水平显著升高(P<0.05,P<0.01),而Bcl2表达水平显著降低(P<0.01)。
3 讨论
结肠癌作为全球发病率逐年攀升的恶性肿瘤之一,目前的主要治疗方法仍然是手术切除、放化疗等,但预后不良及发病率高等特点仍使得结肠癌的治疗具有相当大的局限性,严重威胁着患者的生命及健康。更彻底地了解结肠癌的分子病理机制对于建立新的治疗及诊断策略至关重要。随着越来越多的中草药植物的发现及其天然提取物药理作用的研究,中草药植物在抗肿瘤方面的作用逐渐被发现。黄酮类化合物是一类天然产物,在自然界中普遍存在,具有生理活性广泛、毒副作用小的特点[9]。近年来,其抗肿瘤作用得到了广泛的关注和研究。研究显示,黄酮类化合物对多种常见癌症如肺癌、乳腺癌、结肠癌、前列腺癌、肝癌、白血病、卵巢癌、胃癌等皆有显著的防治效果。而其抗肿瘤的机制主要涉及抗氧化清除氧自由基、促凋亡、阻滞细胞周期、调节免疫、抑制肿瘤新生血管形成、抑制环氧合酶2、抑制端粒酶活性等[10]。LCA是一种在甘草中提取的黄酮类有效物质,在胃癌的研究中,Xiao等[11]已经证明来源于甘草的7种有效成分(甘草酸、甘草次酸、铵盐、LCA、甘草素、异甘草素以及甘草黄酮),其中LCA对5种胃癌细胞株(CES-1、MKN-28、SGC7901、AGS以及MKN-45)抑制作用浓度的IC50值均最小,表明LCA对胃癌细胞的毒性作用最强,且其主要作用机制为阻滞G2/M期细胞和诱导凋亡。而本研究结果表明,LCA对结肠癌细胞株HCT116和SW480的毒性作用在一定程度上呈明显的时间与浓度依赖性,且对HCT116的毒性作用强于SW480(48 h的IC50值分别为21.94 μmol/L和29.38 μmol/L)。
越来越多的证据表明,ROS通过诱导细胞凋亡和分化,在抑制癌细胞增殖方面起着重要作用[12]。低水平的ROS通常能支持细胞增殖和生存途径,而一旦ROS水平过高,就会导致有害的氧化应激,从而导致细胞死亡;且在癌细胞中,癌细胞会对自身ROS水平进行严格的调控,以适应自身增殖,而通过自身突变或外界调控破坏了ROS的平衡,即癌细胞的氧化应激被调节,其增殖能力进而会被抑制[13]。因此如何有效抑制癌细胞ROS水平已成为抗癌的研究重点。研究显示,ROS途径是天然黄酮类化合物发挥抗肿瘤功能的主要途径之一。例如,黄酮类化合物淫羊藿甙处理的甲状腺癌B-CPAP细胞的ROS水平显著高于未处理的对照组,且导致细胞的不可逆损伤,进而诱导细胞凋亡发生[14]。在膀胱癌的研究中,Jiang等[15]发现LCA主要通过增加T24癌细胞株的ROS水平来抑制其增殖,且经LCA处理的细胞氧化还原状态被破坏,细胞GSH/GSSG水平呈明显的浓度依赖性显著降低。在胃癌的研究中,Hao等[16]同样发现LCA能通过增加BGC-823癌细胞的ROS水平,进而激活MAPKs途径,抑制PI3K/AKT途径,最终诱导细胞的凋亡。而本研究显示,LCA同样能提升HCT116细胞的ROS水平,促进细胞凋亡;而采用ROS抑制剂NAC处理后,细胞的ROS水平及凋亡率显著下降,证明LCA可通过ROS途径介导癌细胞的凋亡。
ERS是细胞启动的一种自我保护反应机制,有利于细胞内环境稳态的维持,但长期持续的ERS则可以损伤内质网的功能,ERS无法恢复平衡时,细胞将启动内质网相关的凋亡程序[17,18]。目前ERS诱导凋亡的途径主要有CHOP通路、ASK1-JNK通路及Caspase-12通路,其中CHOP是一种凋亡促进因子,被认为是ERS发生的标志物[19]。而CHOP基因的启动子中含有ATF6、XBP-1以及ATF4等蛋白的结合位点,本研究检测结果显示,LCA能显著提升CHOP、ATF6、XBP-1以及ATF4的蛋白表达水平;而ROS抑制剂NAC处理下能显著逆转这一变化,说明LCA介导的ROS水平变化参与了ERS过程。进一步对线粒体凋亡途径中凋亡相关蛋白检测结果显示,LCA能显著上调促凋亡蛋白Bax和Caspase-3蛋白活化片段Cleaved-caspase3的表达,下调抗凋亡蛋白Bcl2的表达,而ROS抑制剂NAC处理下能显著逆转这一变化,说明LCA介导的ROS水平变化还参与了线粒体凋亡途径。Kang等[20]在乳腺癌相关研究中发现,LCA能显著提升癌细胞MCF-7和MDA-MB-231的ROS及线粒体膜电位水平,同时通过线粒体凋亡途径诱导细胞的凋亡,且通过siRNA技术证明了Sp1蛋白为其靶向作用位点。Tang等[21]在非小细胞肺癌的研究中发现,LCA不仅能增加内质网应激蛋白CHOP的表达,还能诱导癌细胞的自噬效应,且对CHOP进行敲降后发现LCA诱导的癌细胞活性有所增加,凋亡率和自噬能力均有所下降,提示CHOP蛋白与LCA诱导的细胞活力下降、凋亡和自噬至关重要。此外,在膀胱癌中,Yang等[22]的研究表明LCA不仅能增加细胞内Ca2+水平,进而诱导线粒体功能障碍,且ERS通路同样被证明是LCA诱导T24膀胱癌细胞凋亡的重要机制。
综上所述,LCA以剂量依赖的方式抑制人结肠癌细胞的活性;其可能的机制是通过上调细胞ROS水平,进而从Bcl2/Bax/Cleaved-caspase3线粒体凋亡和CHOP内质网应激两条途径共同诱导癌细胞的凋亡。因此,LCA有望成为抗结肠癌的新型治疗药物,但其更全面、深入的抗癌机制还有待进一步研究。