新型Th9细胞分化及功能调控的研究进展①
2019-04-02刘芮辰刘光伟
刘芮辰 董 琳 刘光伟
(北京师范大学生命科学学院教育部细胞增殖与调控生物学重点实验室,北京 100875)
CD4+辅助性T细胞在不同的微环境下分化为不同的效应细胞亚群,在调控适应性免疫应答和维持机体免疫稳态中发挥重要作用。Th9细胞是新近被报道的效应T细胞亚群之一。Schmitt等[1]首先描述了被活化的小鼠T细胞可以产生白细胞介素9(Interleukin 9,IL-9),随后定义了在培养过程中可以促进产生IL-9细胞分化的细胞因子。在2008年,Dardalhon[2]与Veldhoen等[3]在小鼠模型中,使用聚合酶链式反应和细胞内染色的方法,发现在TGF-β和IL-4存在的情况下,初始CD4+T细胞可以分化为IL-9+IL-10+Foxp3-效应性T细胞,主要分泌IL-9和IL-10,而不表达Th1、Th17 及调节性T细胞(regulatory T cells,Treg)分化所必需的转录因子,即产生的效应细胞不同于Th1(T helper 1)、Th17和Treg亚群,故将其命名为“Th9细胞”。进一步发现,Th9细胞分化的重要转录调控因子是PU.1和干扰素调节因子4(Interferon response factor 4,IRF4)[2,3]。本文对Th9细胞的分化调控、免疫功能及在疾病中的作用进行了较详尽的综述(图1)。
1 Th9细胞的分化调控
1.1Il9基因的转录调控 IL-9 是Th9细胞分泌的标志性细胞因子,具有刺激细胞增殖、防止细胞凋亡和参与造血等功能。IL-9通过与细胞表面受体(IL-9R)结合,从而活化信号传导及转录激活子1(Signal transducers and activators of transcription 1,STAT1)、STAT3、STAT5等因子,启动下游信号通路,促进细胞发挥功能。编码细胞因子IL-9的基因是Il9。Il9基因位于小鼠5号染色体上,大小约为11 kb,其编码区域由5个外显子组成,外加3个保守的非编码序列(CNS0-2)。CNS0位于Il9转录起始位点(TSS)上游6 kb处,而CNS2位于TSS位点下游约5.4 kb处。CNS1为启动子区域,包含多个转录因子的结合位点[4-7]。例如,能够调控Il9基因转录的调节因子包括PU.1、IRF1、IRF4、STAT5、STAT6、活化T细胞核因子(Activated T cell nuclear factor,NFAT)、GATA结合因子1(GATA-1,也称为红细胞转录因子)、GATA3、Smads、Etv5、Notch以及核因子κB(Nuclear factor κB,NF-κB)、碱性亮氨酸拉链转录因子ATF样蛋白(Basic leucine zipper transcription factor ATF-like protein,BATF)、活化蛋白1(Activator protein 1,AP-1)等[8]。Etv5还可以结合CNS0和CNS2区域,通过招募组蛋白乙酰转移酶p300介导染色质重塑[9]。有研究表明,Il9基因上游的增强子(CNS25),可以结合促进Il9基因表达的大多数转录因子。小鼠种系中增强子CNS25的缺失改变转录因子与剩余的Il9调节元件的结合,并导致包括Th9细胞在内的多种细胞产生IL-9降低,并减弱IL-9依赖性的免疫应答。此外,在人原代Th9培养物中缺失同源增强子(CNS18)导致IL-9产生显著降低。因此,IL-9 CNS25/IL-9 CNS18是IL-9产生的关键和保守的调节元件[10]。也有研究发现,叉头转录因子(Forkhead-box protein O1,FOXO1)能够与IL-9和IRF4的启动子结合,促进IL-9的产生。抑制蛋白激酶B(又称AKT)能够诱导细胞因子IL-9的产生,从机制上讲,FOXO1结合于Th9、Th17和iTreg细胞中Il9和Irf4的启动子。另外,FOXO1的缺失还能降低小鼠和人Th9、Th17细胞中IL-9的分泌,改善哮喘等过敏性疾病[11]。近年来发现,Foxp3被认为是Il9基因表达的重要抑制因子[12]。
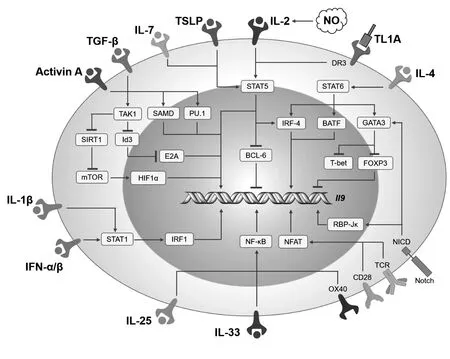
图1 Th9细胞分化的信号调控途径Fig.1 Signal regulatory pathway of Th9 differentiation
1.2Th9细胞分化的调控机制
1.2.1T细胞受体活化作用 辅助性Th细胞的抗原特异性活化是诱导初始CD4+T细胞分化成Th9细胞,分泌IL-9等细胞因子必不可少的前提。T细胞受体(T cell receptor ,TCR)活化可以激活T细胞的核因子NFAT和NF-κB,促进其核定位和Il9基因的表达,协同促进Th9细胞分化[7]。NFAT1能够通过主动重塑染色质,促进NF-κB p65与Il9基因启动子结合,然而当T细胞缺失NFATc1/NFATc2时,会使过敏性疾病小鼠T细胞分泌IL-9减少[7]。
另外,TCR激活也可诱导IRF4的表达,而IRF4是Th9细胞发育以及Th2和Th17细胞分化所必需的。Staudt等[5]研究表明,Irf4基因缺失的小鼠初始CD4+Th细胞不能分化成Th9细胞,采用siRNA技术下调IRF4的表达会显著抑制Th9细胞分泌IL-9;利用染色质免疫共沉淀技术,发现IRF4能够直接与Th9细胞的Il9基因的启动子相结合,调节Th9细胞的分化并促进Il9基因的转录。事实上,BATF和IRF4在Th9细胞的发育过程中都表现出协同作用,因为缺失BATF可以减少Irf4与Il9启动子的结合,反之亦然[13]。近期有研究表明,IRF4的同源物IRF8是Th9在体内和体外分化过程中所必需的,IRF8通过由IRF8、IRF4、PU.1和BATF组成的转录因子复合物发挥作用,与DNA结合,促进Il9的转录,提出IRF8是影响Th9在癌症治疗中的重要调控分子[14]。除IRF4和IRF8外,IRF1在Th9分化中的功能尚不完全清楚,已有研究显示IRF1和IRF4对Th9的分化表现出相反的作用。IRF1可以抑制人Th9细胞产生IL-9。IRF1抑制IRF4激活的Il9启动子活性,IRF1和IRF4对激活组蛋白修饰具有相反的作用,从而影响RNA聚合酶Ⅱ的招募,IRF1-IRF4在Il9启动子位点具有竞争性结合作用[15]。
1.2.2共刺激分子活化的作用 T细胞共刺激信号不仅对T细胞活化很重要,而且对T细胞各亚型的分化也至关重要。在Th9细胞中,NF-κB途径的两个主要的组分RelB-p52和p50分别在OX-40和糖皮质激素诱导的肿瘤坏死因子受体(Glucocorticoid-induced tumor necrosis factor rece-ptor,GITR)作用时诱导产生[4,12,16]。OX-40作为TNFR受体超家族的一员,它诱导IL-9的过程依赖于STAT6、OX40 可以活化肿瘤坏死因子受体相关因子6(TNF receptor associated factor 6,TRAF6),进而激活非经典NF-κB信号[4]。而GITR能够诱导Th9细胞中的STAT6,BATF、PU.1和IRF4的激活[16]。CD28信号可以增强IL-9的诱导,而IL-9诱导与FOXO3a的表达和磷酸化也有关[17]。
肿瘤坏死因子样配体1A(Tumor necrosis factor-like ligand 1A,TL1A)是死亡受体(Death receptor,DR)3的配体。研究发现,TL1A与DR3结合后,通过激活IL-2和STAT5信号途径,来促进Th9细胞的分化[18]。重组信号结合蛋白免疫球蛋白J区(Recombinant signal binding protein immunoglobulin J region,RBPJ)与T盒蛋白21(T-box protein 21,TBX21)启动子结合后,参与Notch 信号通路的调控,Notch配体可以促进IL-9的产生,Notch胞内结构域(Notch intracellular domain,NICD)可以招募Smad3蛋白,并与RBP-Jκ作用,结合到Il9启动子上,启动Il9转录,诱导Th9细胞分化[6]。Notch信号与TGF-β信号共同作用促进IL-9表达[7]。
1.2.3细胞因子的作用 在激活初始CD4+T细胞的局部环境中,细胞因子在诱导T辅助亚群中发挥关键作用。IL-4 是诱导Th9细胞最重要的一种细胞因子。IL-4通过下游转录因子如STAT6、PU.1和IRF4促进Th9细胞分化[19]。在仅有IL-4存在的条件下,会诱导初始CD4+T细胞向Th2细胞分化,而IL-4联合TGF-β能够刺激初始CD4+T细胞向Th9细胞分化[2]。而在IL-4缺失的情况下,TGF-β能够诱导其向Treg分化[20]。当IL-4与其受体结合,进而磷酸化STAT6,促进BATF和IRF4的表达[12,19]。磷酸化的STAT6还能够促进GATA3的表达。研究表明,GATA3并不直接参与Il9基因的转录调控,而是通过下调Foxp3,间接影响Th9的分化[19]。在没有STAT6的情况下,可以通过Notch信号介导GATA3的转录[21]。
TGF-β信号通路在Th9细胞中可诱导Smad活化和PU.1的表达[6,19,22]。然而Jones等[23]证明激活素A可以替代TGF-β作为Th9的诱导因子,在体内过敏性疾病中,TGF-β和激活素A被中和才能导致IL-9分泌下调。Smad蛋白,例如Smad2、3和4是TGF-β受体的下游信号,在Th9细胞的分化过程中起重要作用。TGF-β可以通过依赖和非依赖Smad信号途径激活IL-9的表达。有研究表明,Smad2、3和4缺失时,明显抑制Th9细胞分化[24]。Smad2、3和4可以分别与Il9基因启动子和非编码保守序列CNS区域结合[22,25]。Smad3也被观察到其结合于Il9转录起始位点上游区域。在Notch配体刺激IL-9产生的过程中,Smad3结合于Il9转录起始位点,依赖于重组信号结合蛋白与免疫球蛋白-κJ区域(RBP-Jκ)和Notch细胞内结构域的协同结合(NICD)[6]。而PU.1缺失,可以抑制T细胞IL-9表达[22]。机制上主要是通过PU.1转录因子与Il9启动子结合,以及PU.1招募组蛋白乙酰转移酶调控Il9位点的染色质重构发挥调控作用[22,26]。另外,PU.1也可以通过调节GATA3和IRF4与DNA的结合来抑制Th2细胞因子的表达,从而促进Th9分化[27-29]。TGF-β激酶TAK1可通过Smad非依赖信号通路调节IL-9的分泌。E-box是一种转录因子结合位点,Id3为E-box的抑制剂,Id3缺失或Id3小干扰RNA (siRNA)处理,均可以抑制Th9细胞分化。TAK1缺失,TAK1的抑制剂或siRNA处理均可以明显抑制Th9细胞分化,其机制与抑制转录过程E-box的Id3表达增加有关[30]。
IL-2也对Th9细胞的分化以及IL-9的产生有重要作用。IL-2与受体结合后,诱导STAT5的活化,从而促进Th9细胞的分化[31,32]。阻断IL-2或抑制STAT5可导致IRF4和PU.1的表达下降,抑制Th9细胞的分化[5,12,22]。
胸腺基质淋巴细胞生成素(Thymic stromal lymphopoietin,TSLP)是一种IL-7样细胞因子,对树突状细胞活化和诱导T细胞分化、成熟等有重要作用。在人和鼠初始CD4+T细胞中加入TSLP提高了培养物中IL-9的分泌水平,增加了Th9细胞数量。TSLP 转基因小鼠Th9细胞分化也增加。这些研究结果提示,TSLP可以促进Th9细胞的分化和IL-9的分泌[33]。在整个Th9细胞分化过程中,TSLP还增加了STAT5的磷酸化水平,并促进STAT5与Il9启动子位点结合。IL-2和TSLP可以共同促进T细胞IL-9的产生,在一定条件下,TSLP可能替代IL-2。研究发现,阻断IL-2或抑制STAT5可导致转录抑制因子B细胞淋巴瘤6 (BCL-6)的mRNA和蛋白表达水平增加[34]。虽然活化的STAT5能够直接与Il9启动子结合,但Th9细胞中STAT5的功能可以被BCL-6抑制[35]。在机制上,BCL-6与STAT5竞争结合在Th9细胞的Il9启动子上,从而抑制了Th9细胞的分化[34]。另外,也有其他成员通过增加IL-2浓度来促进Th9细胞的分化。研究发现,TL1A与DR3结合后,可通过激活IL-2和STAT5信号途径,来促进Th9细胞的分化[18]。IL-7可以通过激活STAT5和PI3K-AKT-mTOR信号通路,显著增加组蛋白乙酰转移酶p300的表达,促进Il9启动子的组蛋白乙酰化。转录调节因子FOXO1发生去磷酸化并转移到细胞核内与Il9基因启动子结合。此外,在CD4+T细胞中,FOXO1的缺失则抑制了IL-7的表达,IL-7通过磷酸化STAT5促进Th9细胞分化[36]。
一氧化氮(Nitric oxide,NO)可以刺激IL-2产生、STAT5磷酸化及IRF4的表达。敲除诱导型一氧化氮合酶(Nitric oxide synthase,Nos)2的小鼠Th9细胞数明显减少[37]。ITK是T细胞受体信号传导的调节分子,在体外培养中,Itk-/-CD4+T细胞中IRF4的表达降低,不能产生IL-9。这提示,ITK是Th9细胞分化的促进性调节因子,在TCR介导的IL-2-IRF4信号通路中起重要作用[38]。
IL-1β通过Myd88和Fyn来激活STAT1,IRF1直接结合在Il9基因的启动子上。最近有研究证实,STAT1-IRF1对于Th9细胞响应IL-1β以及增强IL-9、IL-21的产生有重要作用[39]。另外,IL-1家族成员IL-36γ/IL-36R通过调节Myd88和CD4+T细胞中的NF-κBp50有效抑制Treg的分化,同时通过IL-2-STAT5和IL-4-STAT6依赖性途径促进Th9细胞分化。这提示,IL-36/IL-36R在调节Treg和Th9细胞稳态中具有重要作用[40]。Ⅰ型干扰素IFN-α和IFN-β对Th9细胞的分化有促进作用。实验证明,在Th9培养条件下,抑制IL-21或IFN-α、IFN-β都对Th9的分化发挥抑制作用,IFN-α和IFN-β通过上调人T细胞IL-21的转录水平,促进Th9细胞分化[41-43]。
IL-25也是一个新发现的能促进Th9分化的细胞因子。Angkasekwinai等[44]发现阻断IL-25受体,小鼠Th9细胞分泌的IL-9 减少,该过程不依赖IL-4。IL-33协同IL-3可以刺激IL-9分泌,而IL-33与TGF-β协同作用可更有效地增强Th9细胞分泌IL-9的能力[45]。IL-25和IL-33都被认为通过激活NF-κB信号使其协同NFAT1诱导IL-9产生[7]。
IFN-γ无论在体内还是在体外都可以抑制Th9细胞的分化。IFN-γ不但可通过STAT1直接抑制Th9细胞分化,还可通过诱导IL-27表达来间接抑制Th9细胞分化[32,46]。实验发现,IL-27可促进STAT1、STAT3以及转录因子T-bet的磷酸化,其中STAT3对于IL-9表达的抑制作用不明显。IL-27 抑制Th9细胞的分化作用主要通过调节下游转录因子STAT1和T-bet发挥效应。
1.2.4Th9细胞分化的代谢调控 细胞代谢对T细胞亚群的分化也具有重要作用,并成为近几年免疫学和细胞生物学的研究热点。雷帕霉素靶蛋白(mechanistic target of rapamycin,mTOR)是一种丝氨酸/苏氨酸激酶,在细胞代谢过程中具有重要作用。mTOR含有两种复合体,分别为mTORC1和mTORC2。研究表明,敲除mTORC2能够下调Akt或STAT6的活性,降低IRF4表达从而抑制Th9分化,该过程不依赖FOXO1/FOXO3a[47]。
我们近期工作显示,组蛋白去乙酰化酶SIRT1在Th9细胞中特异性表达下调,而且在体外Th9细胞诱导条件下(IL-4+TGF-β)可以剂量依赖性下调SIRT1表达水平。这提示,SIRT1可能在Th9细胞功能调控中发挥重要作用。SIRT1过表达,特异性抑制Th9细胞的分化,而对其他亚群(Th1、Th2、Th17和Treg)分化影响不明显,同时明显下调糖酵解相关代谢调控分子表达。SIRT1缺失明显促进Th9细胞的分化,同时上调糖酵解相关代谢调控分子表达。这些研究结果提示,SIRT1对Th9细胞分化显示出了明显的负性调控效应。为进一步明确其调控机制,基因芯片分析SIRT1缺失Th9细胞表达谱的变化,发现SIRT1缺失Th9细胞明显上调糖代谢相关信号分子、mTOR-HIF等转录因子及细胞分泌因子等表达水平。这说明,SIRT1可能通过靶向多种细胞信号发挥调控Th9细胞分化的效应。最终,通过多基因缺失小鼠综合分析,研究证实SIRT1主要通过mTOR-HIF1α-糖酵解代谢信号途径调控了Th9细胞的分化。而且,更重要的是HIF1α可以直接与Il9启动子区结合并调控Il9启动子活性,发挥Th9细胞功能分化调控的效应[48]。
综上所述,Th9细胞分化过程中受多种细胞因子的调控,相关受体与其结合后激活下游信号网络,促进PU.1、SMAD、IRF4、NFAT等Th9分化相关转录因子发挥功能,促进Il9基因的转录,从而增加了Th9特征性细胞因子IL-9的分泌。
2 Th9细胞在疾病中的作用
IL-9是一种多功能细胞因子,参与体内免疫调节,在许多疾病中都发挥着重要的免疫调控作用。
2.1Th9在肿瘤免疫中的作用 Th9细胞的抗肿瘤活性成为近几年来肿瘤免疫研究的热点,其抗肿瘤效应主要通过影响天然免疫细胞或者适应性免疫细胞来发挥调控作用[49]。
Th9的抗肿瘤活性可以通过影响天然免疫细胞的功能产生抗肿瘤效应。Purwar等[50]研究表明,Th9细胞可明显抑制皮下黑色素瘤的生长,而中和体内IL-9则可明显促进了肿瘤的生长。这提示,Th9及IL-9在黑素瘤小鼠中具有重要的抗肿瘤作用。进一步研究证实,Th9及IL-9主要是以肥大细胞依赖性的方式抑制肿瘤生长。在抗PD-1疗法的背景下研究黑色素瘤转移,用PD-1抑制剂Nivolumab治疗的黑素瘤患者中,Th9细胞产生的IL-9发挥着重要作用,Th9细胞被作为有效的生物标志物进行检测[51]。有趣的是,IL-9的抗癌作用并不局限于黑色素瘤,在Lewis肺癌实体肿瘤中注入IL-9蛋白分子,也抑制了肿瘤生长[50]。关于肥大细胞在调节Th9细胞依赖的抗肿瘤活性中的作用在后续的研究中将被进一步证明。Abdul-Wahid等[52]利用抗肿瘤疫苗研究Th9细胞的抗肿瘤作用,当中和IL-9时则抑制了抗肿瘤疫苗的作用,同时抑制或者敲除肥大细胞都可以降低疫苗的抗肿瘤效果。这些研究结果提示,Th9细胞可以通过分泌IL-9来增强肥大细胞的活性从而提高抗肿瘤效果。
Th9细胞也可以通过适应性免疫细胞发挥抗肿瘤免疫活性。体内Th9细胞可以集聚到肺癌发生的部位,促进CD4+T、CD8+T和DC细胞的招募等,增强适应性免疫的作用,抑制肿瘤恶化。在小鼠注射Th9细胞后,T细胞的CD44表达量上调,Th9细胞通过驱使Ccl20/Ccrb招募DC细胞到肿瘤,活化CD8+T细胞[53]。Zhao等[54]进一步研究表明在荷瘤小鼠中,dectin-1可以通过激活脾酪氨酸激酶(Spleen tyrosine kinase,Syk)、丝氨酸/苏氨酸特异性蛋白激酶家族RAF激酶(RAF kinases,Raf1)和NF-κB信号通路,上调TNFSF15和OX40L的表达,从而激活DC细胞,促进初始CD4+T细胞分化成Th9细胞。另外,Th9细胞也可以提高肿瘤特异性CD8+T细胞活性,产生强大的抗肿瘤反应。IL-1β能够促进Th9细胞分泌细胞因子IL-21,从而促进NK细胞和CD8+T细胞的IFN-γ的分泌,这两种细胞因子都有抗肿瘤活性[39]。Th9细胞也可以分泌IL-3作用于DC细胞,IL-3能够通过不同的信号通路上调DC细胞的抗凋亡蛋白表达,促进DC细胞的存活,从而持续激活适应性抗肿瘤免疫应答[55]。激动性抗GITR抗体(DTA-1)处理的CT26结肠腺癌荷瘤小鼠中检测IL-9的表达,发现DTA-1可以促进IL-9和IL-21分泌,从而增强CD8+T 细胞抗肿瘤效应。在体外,IL-9却不直接作用于CD8+T细胞,而是通过增强DC的抗原提呈能力发挥抗肿瘤效应[15]。这些结果表明,Th9细胞可以通过分泌IL-9和IL-21增强适应性免疫应答的抗肿瘤效应。在鳞状细胞癌中,葡萄球菌肠毒素B(SEB)显著提高了CD4+T细胞中STAT5的磷酸化以及组蛋白去乙酰化酶-1(HDAC1)和PU.1的表达水平,促进了Th9细胞的分化,抑制了肿瘤的发展[56]。在小鼠胶质瘤中,用SEB处理CD4+CD25-T细胞,能够促进p300的磷酸化,促进Il9启动子组蛋白H3K4乙酰化,促进Il9的转录,具有促进胶质瘤细胞凋亡的作用[57]。
目前对Th9细胞抗肿瘤研究仍较局限,有待深入。Th9细胞对某些肿瘤(主要是黑色素瘤和肺腺癌等)的抑制作用表现明显。同时,研究也发现,IL-9可以促进某些癌症的发展,比如淋巴瘤。体外研究显示,IL-9是通过促进肿瘤细胞的增殖和抑制细胞凋亡来促进肿瘤生长[58],但淋巴瘤发展过程中的细胞因子IL-9是否来源于Th9细胞目前还不清楚。
2.2Th9在炎症性肠病中的作用 最近的研究表明Th9细胞及其分泌的细胞因子IL-9也可以加重炎症性肠病(Inflammatory bowel diseases)[59]。IBD是由肠道炎症引起的胃肠道疾病,主要包括两种主要疾病:克罗恩病(Crohn′s disease,CD)和溃疡性结肠炎(Ulcerative colitis,UC)。研究结果显示,Th9细胞的过继免疫可以导致豚鼠肠黏膜的UC加重,在肠道炎症期间也观察到IL-9和IL-9R的表达升高,提示Th9细胞在IBD进展中可能发挥重要作用[60]。最近临床研究也证实,UC患者的疾病进展与Th9细胞分泌的IL-9有关[60,61]。
研究表明,在维持肠道屏障完整性中起重要作用的紧密连接蛋白,其表达与Th9和IL-9相关。这提示,IL-9在结肠炎中存在潜在的调节机制。紧密连接蛋白,包括封闭蛋白(Claudins)和闭合蛋白(Occludin),对维持肠道屏障功能至关重要,其表达的改变被认为是许多炎症性疾病的原因。用结肠炎诱导剂2,4,6-三硝基苯磺酸(TNBS)处理Il9基因敲除小鼠,发现封闭蛋白1表达下调,但是封闭蛋白2的表达没有改变[62]。在恶唑酮结肠炎模型中,IL-9缺陷小鼠的封闭蛋白2表达降低。这些研究结果提示,IL-9可能通过增加恶唑酮诱导的结肠炎中封闭蛋白2的表达而破坏肠道通透性。综上,推测IL-9可能通过调节不同紧密连接分子在不同炎症条件下的表达调控结肠炎[62]。另外,黏附分子αEβ7与体内CD8+T细胞和Th9细胞在肠道集聚密切相关。研究显示,阻断αEβ7有效抑制了CD8+T细胞和Th9细胞在肠疾病病变局部的浸润和集聚[63]。
近来研究表明,在恶唑酮诱导的结肠炎中,IL-36γ可以激活pSTAT5和pSTAT6,促进初始CD4+T细胞分化成Th9细胞,抑制Treg分化,加重肠道炎症。因此靶向IL-36与其肠黏膜细胞受体的结合可能是治疗Th9细胞介导的结肠炎的新思路[40]。
2.3Th9细胞在过敏性炎症中的作用 Th9细胞在过敏性炎症中起关键作用,可能与Th2型细胞因子反应和IgE介导的即时超敏反应相关。在过敏性炎症患者中Th9细胞的数量和IL-9的血清水平与过敏原特异性IgE滴度直接相关[33]。在OVA诱导的过敏性哮喘的小鼠中,检测到Th9细胞增多。Th9细胞数目增多和IL-9的表达升高引起哮喘加重[5]。在过敏性哮喘中,用抗IL-9的抗体治疗患病小鼠能够阻断疾病的许多症状,比如抑制嗜酸性粒细胞的募集和杯状细胞的分化等[5,12]。另外,通过中和TGF-β或激活素A也可以抑制体内Th9细胞分化,同时抑制过敏性疾病的发展[64]。此外,在条件性敲除PU.1和IRF4或BATF的小鼠中,通过抑制IL-9表达,可以明显缓解疾病的症状[5,12,22,65]。IL-9还可刺激体内肥大细胞增殖和活性,并可通过2型先天淋巴细胞(ILC2s)促进其细胞因子的产生,在过敏性疾病中发挥调控效应[66]。
3 总结与展望
Th9细胞是新型CD4+辅助性T细胞亚群,其分化过程受多种细胞因子和转录因子调控,其相关信号通路和代谢调控机制备受关注,成为近几年免疫学研究的热点。Th9细胞在多种疾病中发挥功能,其在疾病中发挥的作用和调控机制也非常复杂,还需进一步深入研究。目前发现在大多数研究中Th9细胞发挥抗肿瘤效应,依据不同的肿瘤类型,Th9发挥的效应也不同。因此,深入探究Th9的分化机制和功能,探讨微环境对Th9的影响及细胞间的相互作用对于多种疾病的治疗具有非常重要的意义。