机器人辅助微创食管切除术的技术要点分析
2019-04-02李斌郭旭峰张晓彬杨洋茅腾孙益峰李志刚
李斌 郭旭峰 张晓彬 杨洋 茅腾 孙益峰 李志刚
微创食管切除术(minimally invasive esophagectomy,MIE)由于可以降低手术创伤,在过去二十多年中迅速发展并被广泛接受。相比于开放食管切除术,MIE具有减少出血、降低术后并发症、缩短住院时间的优点,同时在短期手术结果及长期肿瘤生存方面也与开放手术相当甚至更优[1-5]。但传统胸腹腔镜受制于二维(2D)的视野,较长的刚性操作器械以及狭小空间灵活度有限等不足,推广应用受到限制。机器人手术系统的出现弥补了传统腔镜的不足,它具备三维(3D)成像、10倍放大视野、7个自由度灵活旋转机械臂和震颤过滤等优势,提供了超越人手极限的外科操作灵活性和精准性,可以快速、准确地解剖和缝合组织。
机器人辅助微创食管切除术(robot-assisted minimally invasive esophagectomy, RAMIE)被Horgan等[6]在2003年首先报道,他们完成了首例机器人辅助经食管裂孔途径食管切除术(robot-assisted transhiatal esophagectomy, RATHE)。随后,Kernstine等[7]在2004年报道了机器人辅助经胸三切口食管切除术(Mckeown术)的应用。之后,机器人辅助技术在食管癌外科治疗中逐渐被接受和推广应用。多项研究表明,RAMIE除了具备术后并发症发生率低及康复时间短等优势外,在淋巴结清扫,特别是上纵隔淋巴结清扫方面也有一定的优势,但这项优势能否转化为远期生存获益,目前尚没有大宗的研究报道。
本文对RAMIE的手术路径和手术关键技术进行文献回顾,为广大已经开展或准备开展此项技术的食管外科医师提供参考。
一、 手术路径
RAMIE的手术路径选择与传统食管切除术的路径相同,主要分为经食管裂孔路径和经胸路径,后者主要包括右胸-上腹入路(Ivor-Lewis术)和左颈-右胸-上腹入路(Mckeown术)。不同的手术路径在手术适应证、手术操作、术中术后并发症发生、术后康复以及肿瘤学效果等方面各有优劣势,不同中心会根据患者病情以及既往开展传统食管切除术的经验采取相应的RAMIE手术路径。我们对目前文献报道手术例数超过10例的中心做了统计,共有27个中心报道了RAMIE的经验,其中有4家(14.8%)中心采用了经食管裂孔途径,有5家(18.5%)和13家(48.1%)中心分别采用了机器人辅助下Ivor-Lewis术和Mckeown术,此外,另有5家(18.5%)中心同时采用两种路径(表1)。
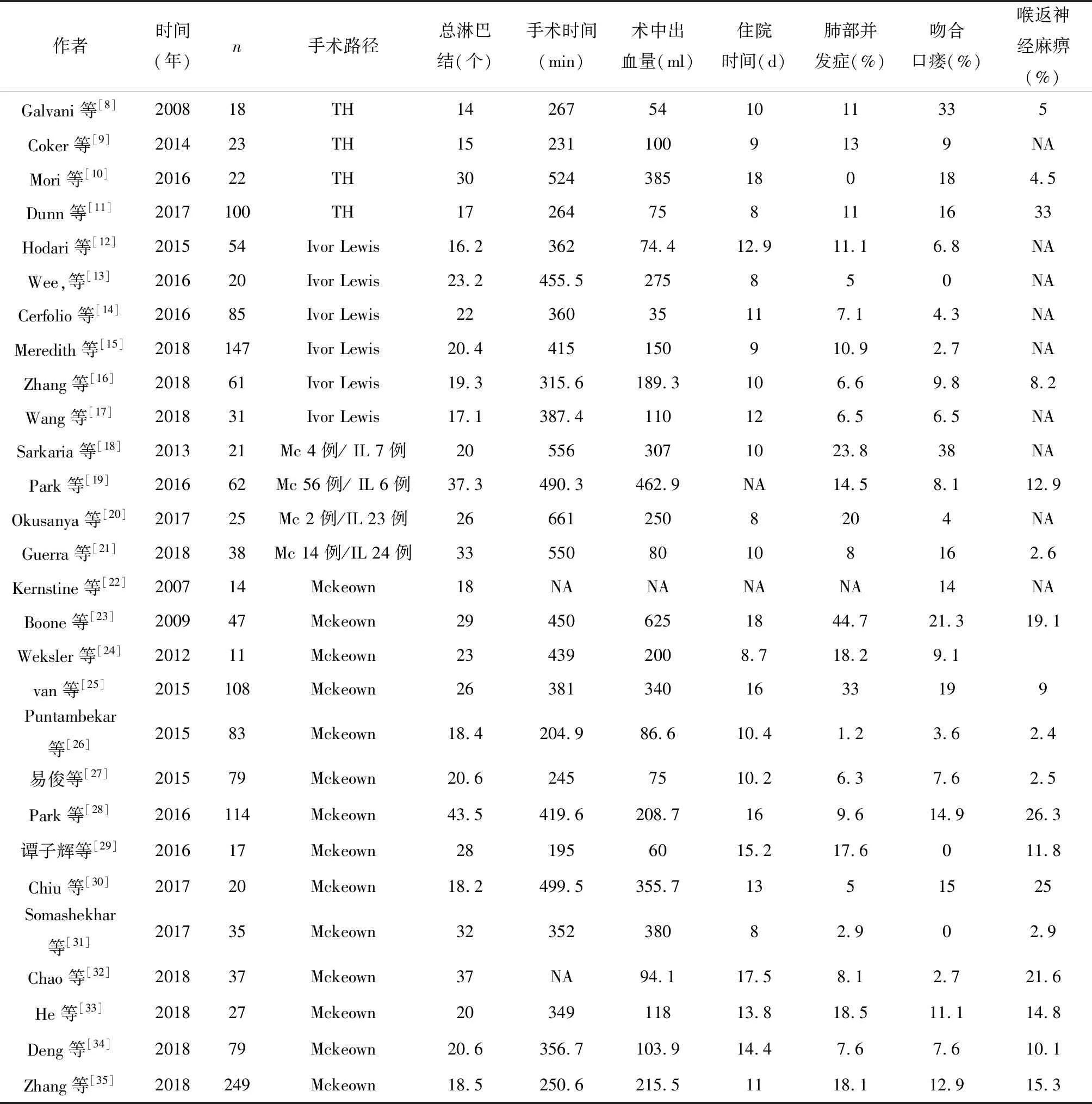
表1 机器人辅助微创食管切除术(RAMIE)手术路径及围术期短期结果
注:TH(transhiatal术);Mc(Mckeown术);IL(Ivor-Lewis术);NA(不明确)
1. 经食管裂孔途径:经裂孔食管切除术(transhiatal esophagectomy, THE)因为避免了胸部操作,可以减少因此带来的胸部并发症,如肺部并发症、术后胸部疼痛等,术中出血也更少,从而缩短术后住院时间,术后恢复更快[36-37]。但由于THE能否完成彻底地纵隔淋巴结清扫一直是食管外科医师的顾虑,另外术中出现严重事件时处理起来也更为棘手。虽然THE在清扫淋巴结时可能存在劣势,但多项回顾性研究在对比经食管裂孔路径和经胸路径食管癌根治术时,并没有发现在远期总生存期(overall survival,OS)和无病生存期(disease-free survival,DFS)间存在统计学差异[38-39]。因此,THE一直被一些中心所应用,特别是在欧美国家食管下段及胃交界部腺癌占主要比例。
机器人微创技术应用于食管切除术首先采用的就是经食管裂孔路径[6]。2013年,Dunn等[40]报道了3年连续40例RATHE的经验,平均手术时间和术中出血量分别为311 min和97.2 ml,术中有5例(12.5%)患者中转开放,术后重症监护室(intensive care unit,ICU)中位住院时间为1 d(0~16 d),术后中位住院时间为9 d(6~36 d)。术后主要并发症发生率分别为喉返神经麻痹(35%)、吻合口瘘(25%)和肺炎(20%)。术后在院病死率为0,30 d病死率为2.5%(1/40)。中位淋巴结清扫总数为20个,R0切除率94.7%。因此,他们认为RATHE是一种安全可行的术式,可以在较短时间以及较少术中出血状态下有效完成手术,虽然术后喉返神经麻痹以及吻合口瘘的发生率高于其他文献报道,但均为暂时性损伤,经治疗后可恢复,并不影响术后康复,术后病死率亦可接受。在后续研究中,Dunn等[11]于2017年又报道了100例RATHE的经验,经过学习曲线的培养,他们平均手术时间缩短为264 min,术中平均出血量减少为75 ml。术后吻合口瘘的发生率为16%,较前期有明显下降,但喉返神经麻痹发生率为33%,接近于前期结果。术中中转开放率为17%,这可能缘于后期手术适应证的扩展以及手术难度的增加。30 d病死率为2%,R0切除率为97.8%,中位淋巴结清扫总数为17个,超过美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)建议的食管癌根治术淋巴清扫总数≥15个的要求[41]。在完成27.7个月的中位随访期后,该组患者的中位无进展生存期(progression-free survival, PFS)为41个月,中位OS为54个月。 1年和3年PFS患者分别占82%(95%CI:75%~89%)和53%(95%CI:42%~62%),1年和3年OS患者分别占95%(95%CI:91%~99%)和57%(95%CI:46%~67%)。因此,作者认为RATHE可以花费合适的手术时间、较少的术中出血以及可控的术后并发症获得满意的肿瘤学控制效果。然而我们也发现,该组研究中病理分期在Ⅰ~Ⅱ期的患者占71.9%,早期病变患者占绝大多数。
为了进一步改善THE的淋巴结清扫效率,Mori等[10]发展了机器人辅助经食管裂孔结合颈部切口纵隔镜辅助的非经胸食管切除术(nontransthoracic esophagectomy,NTTE)。对比22例采取该项术式与139例传统腔镜辅助的经胸食管切除术患者的短期结果,研究者发现,相比于传统经胸手术组,NTTE组平均手术时间较长(524 minvs428 min),术中出血量无统计学差异(385 mlvs490 ml),术后住院时间较短(18 dvs24 d,P=0.0013)。两组间其他主要术后并发症无统计学差异,纵隔淋巴结清扫总数也无统计学差异(30个vs29个)。研究者认为,该项术式可以在明显降低术后肺部并发症的同时获得与经胸途径相同的淋巴结清扫效果。日本的另一组研究者Nakauchi等[42]首次尝试全机器人辅助下充气纵隔镜食管切除术(robotic assisted mediastinoscopic esophagectomy,RAME)。他们顺利完成了6例患者的操作,中位总手术操作时间为805 min(593~1 145 min),术中出血量为179 ml(118~409 ml);获得中位总淋巴结清扫数为46个(22~55个),其中胸部淋巴结数量为20.5个(10~36个),有2例(33.3%)患者出现轻度暂时性的声音嘶哑,有1例(16.7%)患者合并有吻合口瘘。这些技术为机器人辅助经食管裂孔路径提供了新的发展方向,但仍需更大样本量的积累来验证他的安全性和可行性。
2. 经胸路径:相比于经食管裂孔途径,经胸途径是食管外科经常采用的另外一类手术入路。在微创食管切除中主要包括右胸-上腹入路(Ivor-Lewis术)和左颈-右胸-上腹入路(Mckeown术)。两种手术入路各有优缺点,通常认为Ivor-Lewis术式能降低术后吻合口瘘和喉返神经损伤的发生率,一旦术后出现吻合口瘘,处置相对困难,病死率也会增加;同时,由于需要将吻合口在胸部完成,这会增加肿瘤R1切除的可能。另一方面,规范顺利地在微创胸腔镜辅助下完成胸部吻合口操作也是目前该项术式的难点。相对而言,Mckeown术可以保证肿瘤R0切除并且规范地在颈部完成吻合操作,即使发生吻合口瘘也易于处置,极少发生严重并发症,但同时部分文献也报道了该项术式有更高的吻合口瘘和喉返神经损伤的发生率[43-46]。
Luketich等[46]在2012年较早报道了微创Ivor-Lewis术和Mckeown术的回顾性研究结果。两组最终入组的患者分别为530例和481例,两组在术后ICU时间、住院时间以及30 d病死率方面无统计学差异;两组发生吻合口瘘的比率分别为4%和5%,也无统计学差异。Ivor-Lewis组喉返神经损伤的发生率为1%,显著低于Mckeown组的8%。van Workum等[45]采用荟萃分析的方法比较两种术式的短期临床结果,发现微创Ivor Lewis术后喉返神经损伤的发生率更低(1.2%vs8.8%,P<0.001),术中出血和术后住院时间也更短,但两组间吻合口瘘发生率比较差异无统计学意义(4.7%vs52%,P=0.14)。随后,他们联合荷兰四家中心进行了一项回顾性倾向性评分配对研究[43],结果提示微创Ivor-Lewis组术后吻合口瘘发生率更低(12.4%vs23.3%,P=0.003)。以上研究都是回顾性,并没有前瞻性随机对照研究的证据,所以van Workum等[47]在2016年注册开始了一项对比微创经胸术后胸内吻合和颈部吻合间的多中心随机对照研究,期待这项研究将来能给我们带来食管癌微创手术方式选择的建议。
随着机器人技术应用于MIE,微创Ivor-Lewis和Mckeown术也得到了发展。传统腔镜辅助下Ivor-Lewis术时,由于器械角度限制,手工缝合费时费力,多采用器械吻合的方式完成;在吻合效果不满意时,追加缝合也难以达到确切满意的效果。机器人技术借助3D高清视野,“内手腕”器械的使用以及震颤过滤使胸内食管胃手工吻合成为可能,并且更容易完成。机器人辅助胸内吻合方式主要有吻合器吻合、吻合器结合手工吻合及手工吻合三种方式。如采用吻合器吻合时,取出标本后,置入吻合器钉,上提管状胃,从前壁打开管状胃,置入吻合器主体,用管状胃后壁与上段食管做吻合,直线切割器关闭管状胃残端[17,48-49]。Hodari等[12]采用吻合器加手工吻合方式,后壁用45 mm的直线吻合器吻合之后,前壁采用3-0 Vicryl及3-0 V Loc缝线间断缝合,最后用2-0的丝线加固吻合口,平均手术时间362 min,吻合口瘘发生率为5.5%。手工缝合时,有单层缝合及双层缝合的区别。单层缝合时,可采用3.0的PDS缝线连续或间断缝合前壁及后壁全层。Cerfolio等[50]则报道了采用双层缝合的方式完成吻合,先采用3-0的丝线将吻合口后壁的食管和胃黏膜层间断缝合,再用2根3-0的PDS 缝线连续缝合吻合口内层,最后用3-0 丝线间断缝合吻合口前壁外层。早期16例采用这种方式吻合的手术中位时间为6.1 h,术后总并发症发生率仅6.3%,无吻合口瘘发生。上海瑞金医院Zhang等[16]也报道了部分采用双层手工缝合方法完成机器人辅助下Ivor-Lewis术的经验,26例患者平均手术操作时间302 min,术后吻合口瘘发生率为7.7%,术后30 d无患者死亡。
机器人技术对于提高淋巴结清扫效率也有一定优势,特别是在Mckeown术式时,传统腔镜在完成上纵隔淋巴结清扫时受限于器械及操作空间,难以完整地清晰暴露局部区域,机器人技术的进步正弥补了这些不足。在完成上纵隔淋巴结清扫时,术者可以清晰暴露胸顶部局部解剖,操作过程也在机器人技术的帮助下更加精细安全。多项针对机器人辅助与传统腔镜辅助下完成的Mckeown术对比研究均发现机器人辅助下可获得更多的淋巴结清扫数量,特别是上纵隔淋巴结的数量[19,32,34,51]。Park等[19]于2016年首先报道了他们研究结果。他们对比了62例RAMIE和43例传统腔镜辅助下食管切除术的患者,机器人辅助组的清扫淋巴结总数明显多于传统腔镜组(37.3个vs28.7个,P=0.003),并且上纵隔清扫的淋巴结数量也存在明显差异(10.7个vs6.3个,P=0.032)。Deng等[34]采取倾向性评分配对的方法对RAMIE与传统腔镜辅助MIE做对比研究。在完成52对患者的匹配后,发现RAMIE可以获得更多的总淋巴结数(21.5个vs17.3个,P=0.006)和腹部淋巴结数量(9.7个vs7.3个,P=0.042)。此外,RAMIE还获得了更多的左侧喉返神经旁淋巴结[(1.0±1.8)个vs(0.4±0.8)个,P=0.033]而不增加喉返神经麻痹的风险。
在面对机器人辅助下微创Ivor-Lewis术和Mckeown术的选择时,术者首先更多地是参考既往开放和传统腔镜辅助下微创手术的经验。完成Ivor-Lewis术的患者病变多位于食管下段及胃食管交界区,Cerfolio等[14]报道中,食管下段及胃食管交界区病变的比例占到94%;Luketich等[46]报道,在传统腔镜辅助下行Ivor-Lewis术的患者中,食管下段及胃食管交界区病变的比例占到93%,因此,van Workum等[47]在开展随机对照研究时也把患者的入选标准限定在隆突下食管中下段及胃食管交界区病变,这与欧美国家食管下段胃交界区腺癌高发的流行病学特点有关。经我们统计发现,采用经胸路径的23个单位中,有10个(43.5%)单位应用Ivor-Lewis术,其中亚洲国家占3个(30%);有18个(78.3%)单位应用Mckeown术,其中亚洲国家占11个(61.1%)(表1)。因此,在食管鳞癌高发的亚洲国家中,更多的单位采用了左颈—右胸—上腹入路的Mckeown术。
二、 麻醉及体位
RAMIE选择的麻醉方式和手术体位与传统腔镜辅助下MIE相似。在全身麻醉下气管插管时,Mckeown术更多地选择单腔气管插管+人工气胸的方式,必要时附加阻塞导管进行单肺通气,有利于气管食管沟区域的暴露以及术中肺功能的保护[52-53]。而Ivor-Lewis术在胸部操作时需要置入吻合器和有效地单肺通气,所以更多地选择双腔气管插管。
胸部手术体位主要包括左侧卧位和俯卧位,左侧卧位由于更接近既往手术解剖,故很多中心在完成Ivor-Lewis术时采用这种体位[12,48,54-57]。但Trugeda等[58]则采用了俯卧位方式进行Ivor-Lewis术,主要是考虑重力作用下可以更好地暴露食管,更少地触碰到肺部及获得更清晰的无血视野。Mckeown术时多采用的是俯卧位或侧俯卧位,利于暴露后纵隔区域解剖结构和纵隔淋巴结清扫;同时相对于侧卧位,有利于降低术后肺部并发症的发生,减少术中出血量[53]。腹部操作体位多采用仰卧位、头高脚低、左侧抬高的体位,这样利于胃网膜血管的游离,处理胃短血管及脾门区结构时也更为方便。
三、 Trocar位置设置及胸腹全机器人操作建议
Trocar的位置设置主要依据术者的经验以及个人偏好。根据各中心机器人配置以及术者经验,一般会选择3~4个机械臂操作(表2)。根据文献报道,所有机器人辅助下Ivor-Lewis术均选择了四臂操作模式,其中一个机械臂控制观察镜,其余三个臂作为手术操作臂。腹部操作时机器人观察孔一般设置在脐下,左腹部设置一个操作臂,右腹部分布两个操作臂,各操作臂间为防止互相干扰应间隔12 cm以上。有些单位会在右腹部设置一个助手腔镜器械辅助孔,协助组织暴露及术中操作。胸部操作时Ivor-Lewis术常设置四个机械臂,三个机器人操作臂的模式更有利于食管游离以及胸部吻合的完成[14,16,18]。Mckeown术胸部操作时大部分中心采用三臂操作模式,借助1~2个助手辅助孔亦能安全有效地完成胸部食管游离及纵隔淋巴结清扫。Chao等[32]在胸部操作时采用四臂模式,他们认为,借助术者控制的第四个机械臂,能完成良好的稳定暴露,最终完成安全容易的淋巴结清扫,特别是在清扫左喉返神经旁淋巴结时更具优势。胸部操作时观察孔一般设置在肩胛下角附近,二或三个操作机械臂分布在下胸部及腋下区域。我们中心沿用传统腔镜胸部操作习惯,在肩胛间区设置食管悬吊穿刺线,在清扫左喉返神经旁淋巴结时协助牵拉食管[35]。
胸腹全机器人辅助食管切除术(total robot-assisted esophagectomy,TRAE)操作是否存在优势目前尚无定论。Ivor-Lewis术式报道的6家中心只有2家选择TRAE,其他4家选择传统腹腔镜+机器人辅助胸腔镜(hybrid robot-assisted esophagectomy,HRAE)的杂交模式,可能缘于传统腹腔镜下完成胃游离及管状胃成形已被广大食管外科医师熟练掌握和应用。Mckeown术式14家中心有5家选择HRAE模式,认为机器辅助技术在清扫纵隔淋巴结更具优势,故在腹部操作时还是选择传统腔镜辅助模式;有3家中心在初期采用HRAE模式,经过一定病例积累后转为TRAE;另有6家中心从一开始就选择TRAE模式,说明HRAE模式可能是最终采取TRAE模式的学习曲线阶段(表2)。一些研究发现,机器人辅助技术除了在清扫纵隔淋巴结时具有优势,在获得腹部淋巴结数量上也多于传统腔镜[19,34,51]。另一方面,TRAE操作对于术者来说更具有舒适性,这对食管外科医师来说尤为重要。
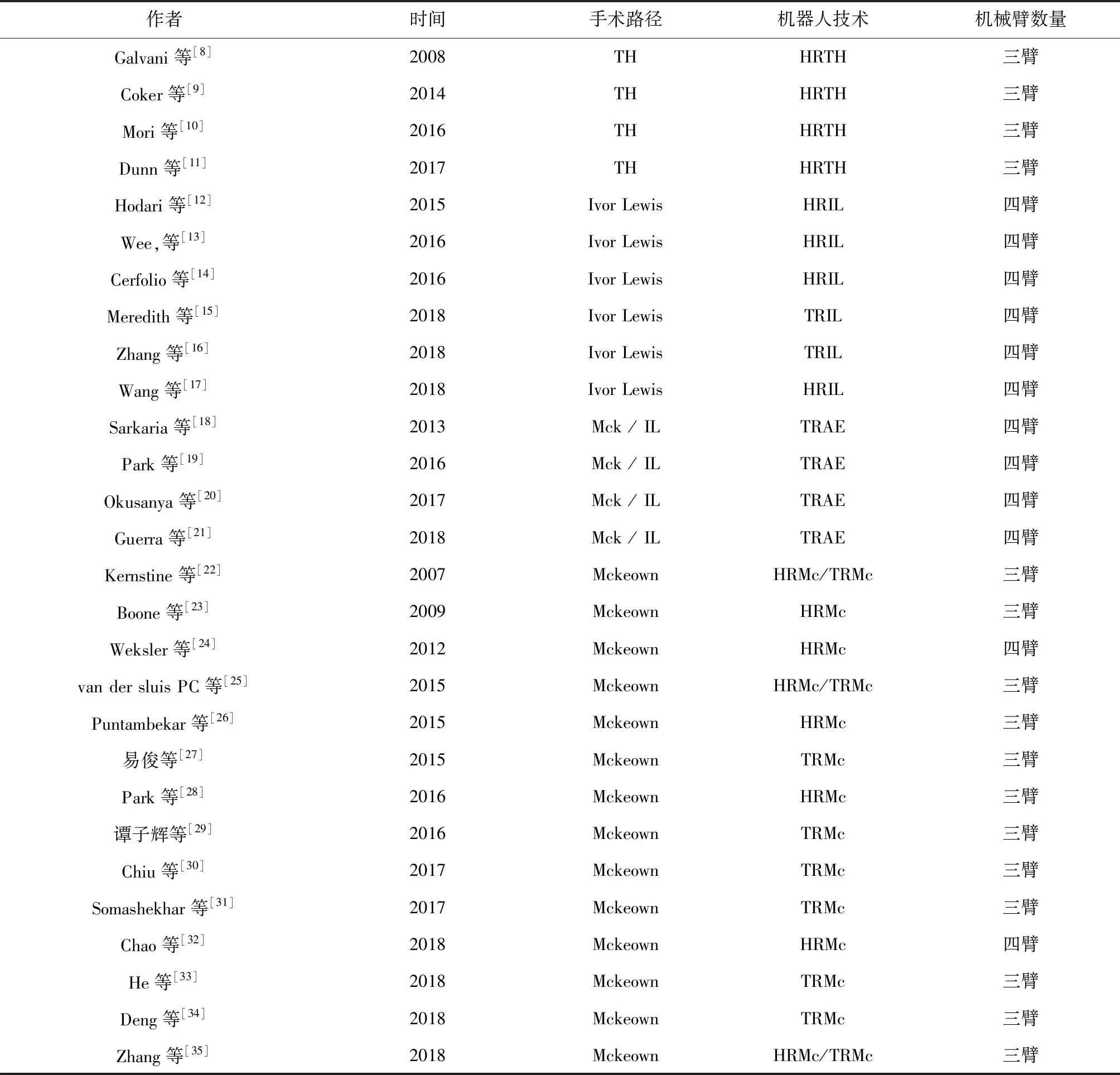
表2 机器人辅助食管切除术辅助技术
注:(TH经裂孔);Mck(Mckeown术);IL(Ivor-Lewis术);HRTH(杂交机器人经裂孔);HRIL(杂交机器人辅助经右胸-腹正中二切口);TRIL(完全机器人辅助经右胸-腹正中二切口);HRMc: (杂交机器人辅助经右胸-腹正中-颈部三切口);TRMc(完全交机器人辅助经右胸-腹正中-颈部三切口);TRAE(完全交机器人辅助食管切除术)
四、 喉返神经裸化
上纵隔淋巴结特别是双侧喉返神经旁淋巴结是中上段食管鳞癌早期转移扩散的常见部位[59-60]。虽然彻底淋巴结清扫可以为肿瘤进行准确分期,但是否常规进行喉返神经旁淋巴结彻底清扫还存有疑问。这一方面是由于彻底清扫能否带来治疗获益尚不明确;另一方面,伴随而来的喉返神经损伤等术后并发症也使得术者存有疑虑[61]。近二十年来,传统腔镜辅助下MIE因其能够提供改进的放大倍数和精确的组织解剖而越来越受欢迎。有经验的食管外科医师借助腔镜辅助的微创技术,可显著降低术后并发症的发生率和病死率[1,46]。然而,在腔镜辅助下安全有效地完成喉返神经旁淋巴结清扫仍然具有挑战性,主要原因在于2D视野、器械刚性限制以及有限的操作空间。机器人腔镜辅助技术的发展恰好弥补了传统腔镜的不足,为有效完成喉返神经旁淋巴结清扫、降低术后神经损伤提供了帮助。
Kim等[62]对比了RAMIE常规淋巴结清扫和全纵隔淋巴结清扫患者的术后病理资料,发现包含喉返神经裸化的全纵隔淋巴结清扫胸部操作平均手术时间要长于常规淋巴结清扫组(211.4 minvs156.6 min,P<0.001),清扫纵隔淋巴结和双侧喉返神经链淋巴结的时间也更长(30.3 minvs19.6 min,P<0.001;13.5 minvs4.8 min,P<0.001)。然而,喉返神经完全裸化后术后喉返神经麻痹的发生率也有所增高,未达到统计学差异(31.8%vs5.6%,P=0.054),但所有喉返神经麻痹症状均在1年内消退。Chao等[32]采用倾向性评分的方法对比了传统腔镜和机器人辅助完成包括喉返神经裸化的食管癌根治术患者的结果。两组间获得的总淋巴结清扫数量无统计学差异,胸部及腹部淋巴结清扫数量也无统计学差异,仅在左喉返神经旁淋巴结存在有显著差异,机器人辅助组平均获得的淋巴结数是5.32个,在传统腔镜辅助组中为3.38个(P=0.007);术后喉返神经麻痹(20.6%vs29.4%,P=0.401)和肺部并发症(5.9%vs17.6%,P=0.259)方面无统计学意义。因此,机器人辅助下完成喉返神经裸化是安全可行的,可以获得更多的淋巴结清扫数量,并且不增加术后并发喉返神经麻痹的比例。
五、 食管全系膜切除及胸导管切除
肿瘤全系膜切除的概念来源于直肠癌的根治性手术,1982年Heald等首先提出和应用全系膜外切除的方式治疗直肠癌,显著提高了直肠癌的手术切除率和5年生存率[63]。将此概念应用于同属消化道器官的食管中,对于食管癌切除手术中,把食管及其周围的系膜组织当作一个解剖单位予以完整切除。食管癌全食管系膜切除(total meso-esophageal excision,TME)的实质是利用食管与邻近结构之间的解剖间隙,最大限度地切除食管及食管周围神经、血管、淋巴脂肪组织,强调将食管系膜作为一个单位完整切除,在切除肿瘤病灶的同时能够彻底清除食管引流区域内的受累淋巴组织,则患者获得治愈的机会将大大增加。
国内多个中心学者已将TME理念用于胸腹腔镜辅助下食管癌根治术。傅俊惠等[64]对比腔镜辅助下45例TME和61例非TME患者的手术结果,虽然TME组花费了更多的手术时间(251 minvs235 min,P=0.011),但术中出血更少(136.4 minvs197.1 min,P<0.001)。TME组清扫颈部、胸部、腹部淋巴结数明显高于非TME组(P<0.001),术后常见并发症两组间并没有统计学差异。马昌云等[65]应用该项技术也得出了相似的结论。国外学者也已将TME技术应用于胸腹腔镜辅助下食管癌根治术[66-69]。Akiyama等[66]回顾行分析140例胸腔镜辅助下食管切除术患者资料,发现TME组与非TME组在清扫淋巴结数量及术后并发症发生率方面无统计学差异。远期随访发现,两组间OS和无复发生存(relapse free survive,RFS)方面无显著差异。但TME组的总复发率显著低于非ME组(23%vs43.4%,P=0.011),特别是TME组纵隔淋巴结复发率更低(2.3%vs11.3%,P=0.026),这显示出TME在肿瘤局部控制方面的优势。
在完成食管全系膜切除时,通常建议一并完成胸导管及其周围脂肪组织切除[66,68]。胸导管是全身最长的淋巴导管,起源于乳糜池并沿胸主降主动脉上升,最后注入左静脉角。 Schurink等[70]在解剖分析7个冰冻尸体标本胸导管及其周围组织后发现,胸导管淋巴结存在于6个尸体标本中(86%),平均淋巴结数量为1个(0~6个),主要位于奇静脉旁区域。Udagawa等[71]也在胸导管周围组织手术标本中发现有淋巴结,并且在中晚期食管癌患者中有发现转移,他们建议行食管癌根治术时应常规进行胸导管及周围淋巴结切除。Matsuda等[72]就对食管癌根治时行胸导管切除(n=167)和胸导管保留(n=89)的两组患者进行了对比分析。两组间术后主要并发症包括肺炎、吻合口瘘和乳糜胸的发生率无统计学差异。胸导管切除组纵隔淋巴结的清扫数量明显多于胸导管保留组(27.9个vs20.0个,P<0.001)。在胸导管旁淋巴结单独分析的72例患者中,67%的患者发现平均有2个胸导管淋巴结存在。其中8例(11%)患者出现淋巴结转移,位置多在肿瘤水平或近端。Anand等[73]研究发现,在行新辅助治疗后的食管癌患者中,胸导管切除并不增加淋巴结清扫的数量,但术后早期有轻微的血流动力学影响。
基于传统腔镜辅助下食管全系膜及胸导管切除的经验可借鉴给RAMIE。机器人技术较传统腔镜的更优视野、更精细的操作以及更灵活的器械,都为良好的完成食管全系膜切除以及胸导管切除提供保障[23,30]。未来需要聚焦于机器人技术在食管全系膜和胸导管切除的研究来进一步提供指南意见。
