硼促进缺铁条件下拟南芥根系细胞壁铁的再利用
2019-04-01朱晓芳沈仁芳
吴 启,朱晓芳,沈仁芳*
(1 土壤与农业可持续发展国家重点实验室/中国科学院南京土壤研究所,南京 210008;2 中国科学院大学,北京 100049)
铁在地壳中含量十分丰富,约占地壳总重量的5%左右。同时铁也是动植物生长发育所必需的微量元素,作为许多功能蛋白的重要组成部分,铁能参与高等植物的光合作用和氮同化等生理生化过程[1-2]。虽然在土壤中铁的含量很高,但其主要是以Fe3+复合物的形式存在,而植物可以直接吸收利用的Fe2+含量却是很低的。尤其是在碱性和石灰性土壤中,由于高pH和强氧化作用使得土壤中的Fe3+溶解度极低,从而抑制了土壤中游离铁的有效性,最终限制植物的生长发育[3-4]。据统计,全世界约有30%的土壤处于铁饥饿状态[5],地中海地区、北美大陆、南美的部分地区都严重缺铁。而我国西南地区、淮北平原以及西北等地均有缺铁现象的发生[6]。缺铁导致的症状首先是新叶出现黄化现象,铁元素由地下部向上运输的过程受阻,从而造成营养元素的分配不均匀,最终导致作物营养不良,品质和产量严重受限,进而影响人类的饮食健康[7]。
高等植物在漫长的进化过程中逐渐形成了一整套完善而复杂的应答缺铁的策略。根据植物对缺铁表现的形态学差异和生理变化的不同,人为地将这些植物划分为非禾本科植物和双子叶植物所共有的机理Ⅰ和禾本科所特有的机理Ⅱ。在受到缺铁胁迫时,机理Ⅰ植物主要有以下三个步骤响应缺铁信号:首先,植物根系表面的ATP酶 (H+-ATPase) 会首先活化,向根系外分泌H+来酸化土壤,增加Fe3+的溶解度来促进植物对铁的吸收[8]。如拟南芥中的AHA(Arabidopsis H+-ATPase isoform) 家族基因就是在该过程起着重要的作用[9]。其次,根系表面溶解的Fe3+需要转化成Fe2+形式才能被植物所吸收,位于根系细胞膜表面的铁离子螯合还原酶 (ferric-chelate reductase oxidase, FRO) 可以将根表面的三价铁还原成二价铁以供植物吸收利用[10]。最后,还原后的Fe2+会在一系列铁转运蛋白 (iron-regulated transport, IRT)的运输下转运到根皮层细胞[11],之后再进一步通过各类转运蛋白运输到细胞的各个组织器官供植物体吸收。机理Ⅱ植物包括水稻、玉米、小麦和大麦等多种农作物。研究发现,在严苛的缺铁条件下,禾本科植物往往能比双子叶或非禾本科植物表现出更高的抗性[12],其主要原因是这些植物在受到缺铁信号胁迫时往往能够分泌麦根酸类 (mugineic acid, MA) 物质[13],这类物质能够与根系微环境中的Fe3+螯合形成Fe3+-PS复合体,最终被根表皮细胞的细胞膜上的YS/YSL (yellow stripe/yellow stripe like) 家族转运蛋白吸收[14]。
作为植物接触和响应外界信号的第一道屏障,细胞壁在植物抵御铝毒和镉毒的过程中发挥了重要的作用[15-16]。Chang等[17]研究表明,在铝毒胁迫下,植物细胞中的铝主要集中在细胞壁的果胶中。为了进一步明确果胶在植物耐铝中所发挥的作用,Zheng等[18]利用果胶酶可以降解果胶的原理,发现去除细胞壁果胶后,细胞壁可结合的Al含量减少了约50%,说明细胞壁果胶成分在结合Al方面确实起着重要的作用。而对于细胞壁缓解镉毒的相关研究,Zhu等[16,19]研究发现,细胞壁组分中的半纤维素可以结合镉,外源添加生长素可增强半纤维素对镉的结合能力,减少镉由地下部向上运输的过程,从而缓解植物镉毒的危害。除了可以缓解镉毒和铝毒,最近的研究表明,细胞壁还参与植物抵抗缺铁逆境的过程[20]。Zhu等[21]研究发现,NaCl可以通过激发根系细胞壁铁的再利用和再分配机制来缓解拟南芥的缺铁症状,进一步研究显示,脱落酸作为一类植物逆境激素,可以通过参与调解细胞壁组分的合成来响应植物缺铁的信号。
硼也是植物生长发育所必需的微量元素,在植物中主要以硼-糖复合物的形式存在于细胞壁中[22],可以用来维持植物细胞壁的稳定性[23]。同时,硼还能够参与碳水化合物的运输、花粉萌发和花粉管生长等一系列生理生化过程,对作物的产量和品质都有极其重要的影响[24]。一般认为,细胞中 80%以上的硼可以和细胞壁的果胶成分相结合,形成大小合适的细胞壁孔径,从而调节其他养分的吸收和转运[25]。最近研究发现,硼可以通过胶联细胞壁果胶成分来缓解植物体内的铝毒[26-27],硼还可以和钙协同作用缓解植物铝毒的症状[28],锌硼之间的交互作用对植物生长、光合作用和水分的吸收都起着至关重要的作用[29]。但是,外源添加硼是否能够缓解植物的缺铁症状还鲜有研究,本试验以模式作物拟南芥为研究材料,试图揭示在缺铁的条件下,微量元素硼能否可以通过调节细胞壁组分来提高植株体内有效铁的含量,从而达到缓解植物缺铁的目的。
1 材料与方法
1.1 植物材料和培养条件
供试材料为野生型拟南芥Col-0 (Columbia ecotype)。挑选无病虫害的拟南芥种子,首先用75%乙醇处理 5 min,对种子表面进行消毒,再用无菌水清洗3次;然后将用全营养液浸泡过的海绵塞入1.5 mL去底eppendorf离心管中;再将消毒完毕的种子用牙签点在湿润的海绵上,随后放入光照培养箱中。培养室内植物生长的条件:温度为24°C,光照 16 h,黑夜 8 h,光照强度为 140 μmol/(m2·s)。
全营养液成分:大量元素浓度 (mmol/L) 为KNO36.0、Ca (NO3)24.0、MgSO41.0、NH4H2PO40.1;微量元素浓度 (μmol/L) 为 Fe (III) -EDTA 50、H3BO312.5、MnSO41.0、CuSO40.5、ZnSO41.0、H2MoO40.1、NiSO40.1。用1 mol/L HCl或NaOH调节溶液pH为 5.6。
在光照培养箱培养7 d后,将幼苗移至全营养液(pH 5.6) 生长2周。最后挑选长势一致的拟南芥移入1.25 L用黑色塑料袋包裹的罐子里,每个罐子种 9 棵苗。对以上样品进行如下处理:+Fe (pH 5.6的全营养液);+Fe + 100 μmol/L H3BO3;+Fe + 1000 μmol/L H3BO3;-Fe (pH 5.6不含铁的营养液);-Fe + 100 μmol/L H3BO3;-Fe + 1000 μmol/L H3BO3。处理中每隔3 d换一次营养液,处理共进行了7 d。
1.2 叶绿素含量的测定
利用便携式叶绿素仪 (Konica Minolta SPAD-502,Tokyo, Japan) 测定表征植株新叶叶绿素含量的SPAD值。
1.3 总铁含量的测定
切除处理后拟南芥的根系和地上部,用蒸馏水清洗3次,在70°C烘箱中放置2 d后,分别称重,记录干重。再把样品放入20 mL用酸浸泡过的消煮管中,加入2 mL HNO3/HClO4 (4∶1, v/v),然后将消煮管放在消煮炉中130°C加热,直至样品澄清透亮,最后加入8 mL蒸馏水定容至10 mL,滤纸过滤后采用电感耦合等离子体原子发射光谱法 (ICP-AES)测定溶液中的铁含量[30]。
1.4 有效铁含量的测定
参照Lei等的方法[31],具体操作步骤如下:将处理后的植株根系和地上部分别用去离子水清洗后称取鲜重,加入液氮后在研钵中充分研磨,最后加入8 mL去离子水充分浸提。24 h后对浸提液13200 rpm离心10 min,取上清液采用电感耦合等离子体原子发射光谱法 (ICP-AES) 测定溶液中的铁含量。
1.5 细胞壁成分的分级提取及细胞壁组分铁的测定
细胞壁的提取:将拟南芥根系在去离子水下冲洗3遍后,用吸水纸吸干多余的水分。用镊子将根系转移到干净的研钵中,加入过量的液氮充分研磨,然后加入8 mL 75%乙醇将研磨液转移至10 mL离心管中,放在漩涡震荡仪上使之充分混匀,静置20 min后5000 rpm离心10 min后倒掉上清液。然后依次加入丙酮、1∶1甲醇、氯仿的混合液以及甲醇,每次均在漩涡震荡仪上震荡数分钟使提取液充分混匀, 然后静置20 min后离心弃上清液。最后细胞壁粗提物放入冷冻干燥机干燥,4°C保存备用[32]。
果胶的提取:称取已经提取好约2 mg的细胞壁放在1.5 mL离心管中,加入1 mL去离子水后在100°C沸水中水浴1 h,然后在12000 rpm下离心10 min,用移液枪吸取上清液至5 mL离心管中,再重复以上步骤2遍,最后用去离子水定容至3 mL即为所提果胶溶液[33]。
半纤维素的提取:在提取果胶后的残渣中加入1 mL 24% KOH,室温静置12 h后,12000 rpm下离心 10 min,取上清液于5 mL离心管中,再重复一次上述步骤,将两次所得的上清液合并在一起,用去离子水定容至2 mL即为半纤维素溶液。
细胞壁铁含量的测定:称取约2 mg的粗提细胞壁于1.5 mL离心管中,加入1 mL 2 mol/L HCl后放入摇床室温震荡3 d,然后利用电感耦合等离子体原子发射光谱法 (ICP-AES) 测定细胞壁中的铁含量。
细胞壁组分铁含量的测定:分别取果胶和半纤维素溶液利用电感耦合等离子体原子发射光谱法(ICP-AES) 测定其铁含量。
1.6 半纤维素含量的测定
半纤维素含量一般用总糖的含量来表示。具体操作如下:取200 μL半纤维素于1.5 mL离心管中,随后在离心管中加入10 μL 80%的苯酚和1 mL浓硫酸,室温静置15分钟后再放入100°C沸水中水浴15分钟,快速取出离心管置于冰上冷却。然后在490 nm波长下比色。标准曲线的制作参照Dubios等方法[34]。
1.7 RNA提取和基因表达分析
拟南芥幼苗在+Fe + 100 μmol/L H3BO3、+Fe +1000 μmol/L H3BO3、-Fe+100 μmol/L H3BO3、-Fe +1000 μmol/L H3BO3溶液中处理7 d后,收集根系放入液氮中,随后在研钵中加入液氮充分研磨,然后用植物RNA提取试剂盒 (TIANGEN) 并按照相关说明要求提取RNA,提取后的RNA用nanodrop检测样品浓度和质量。先通过RNA浓度测定换算成含有1 μg的样品,然后用PrimeScript RT试剂盒 (Takara)进行反转录合成cDNA。反转录后的cDNA放入-20°C冰箱保存。
实时荧光定量PCR采用TAKARA公司生产的SYBR Premix ExTaq体系进行 (Takara Bio,Inc,Japan)。首先将反转得到的cDNA稀释10倍用于定量PCR的模板。PCR循环体系为10 μL体系,其中1 μL 稀释后的 cDNA,5 μLSYBR Premix ExTaq,0.5 μL的正向和反向引物,3 μL的无菌蒸馏水。PCR反应的程序为: 95°C初预热1 min,95°C变性15 s,55°C退火15 s,72°C延伸20 s,整个程序共45个循环。以tublin作为内参基因,采用公式2-ΔΔCT计算不同处理间基因的相对表达量。上述试验每个均有4个生物学重复和3个机械重复。
相关基因引物如下:
TUBLIN
上游引物 5’-AAGTTCTGGGAAGTGGTT-3’
下游引物 5’-CTCCCAATGAGTGACAAA-3’
FRD3
上游引物 5’-TTTTGTCGGGCGTTTAGG-3’
下游引物 5’-TTGCTGTGGCTGGTTGGT-3’
YSL2
上游引物5’-GGATACTTATTCTTCTCCCTT GTC-3’
下游引物 5’-CCATCGTTTTTTCCTGCC-3’
NAS1
上游引物5’-CATGATCTTCCACACAACGG AC-3’
下游引物 5’-CGACGTCATATTGGTCAA GGC-3’
1.8 一氧化氮 (NO) 含量的测定
利用3-氨基-4-甲氨基-2′-7′二氟荧光素测定拟南芥根系NO含量。具体操作如下,取根尖1 cm处在20 mmol/L的HEPE缓冲液中冲洗20 min,然后用镊子将根尖剪出放在装有10 μmol/L荧光染料的离心管中避光染色30 min,最后再用HEPE缓冲液冲洗根系3次,每次15 min。制片,在荧光显微镜下观察,拍照,利用photoshop 软件计算荧光度。
1.9 数据处理
数据采用Excel2013、Sigmaplot13.0、Statistix8.0进行分析整理和绘图。
2 结果与分析
2.1 外源硼对拟南芥缺铁症状的缓解作用
为了探究外源添加硼在缺铁胁迫中的作用,本试验以模式植物拟南芥为材料,在正常和缺铁的条件下采用不同浓度的硼处理后观察植株表型并测定不同部位有效铁含量。结果显示,在正常全营养液条件下,添加外源硼不能改变植株的生长情况。当受到缺铁胁迫时,植株新叶首先出现黄化现象,外源施加硼 (1000 μmol/L H3BO3) 可以显著改善缺铁症状 (图1-A);利用便携式叶绿素仪测定植株新叶的叶绿素含量 (SPAD值),结果表明,缺铁情况下植株叶片的叶绿素含量随着硼浓度的增加而显著增加 (图1-B)。值得关注的是,在缺铁胁迫下,外源添加硼后可以显著增加植株根系和地上部有效铁的含量 (图1-C、D),表明硼缓解缺铁症状的主要原因可能是植株体内铁的再利用机制。
2.2 外源硼对细胞壁铁再利用的促进作用
在缺铁的条件下根系仍含有一定的有效铁含量,笔者猜测可能与植株体内铁的再利用有关。因此为了探究其内在的铁再利用机制,笔者用不同浓度梯度的硼酸处理拟南芥幼苗7 d,分别测定了加铁和不加铁情况下根系细胞壁铁的含量和其组分上结合的铁含量。结果显示,与单独缺铁环境相比,外源添加硼后细胞壁铁和半纤维素铁含量都显著降低 (图2-A、B),且随着硼酸浓度的增加,细胞壁组分结合的铁含量降低。进一步测定了细胞壁的半纤维素含量发现,随着外源硼酸浓度的增加,细胞壁半纤维素含量也逐渐减少 (图2-C)。综上分析,推测硼可以通过提高细胞壁铁含量释放来增加植物体内有效铁的含量,从而确保植株在缺铁的条件下正常生长。
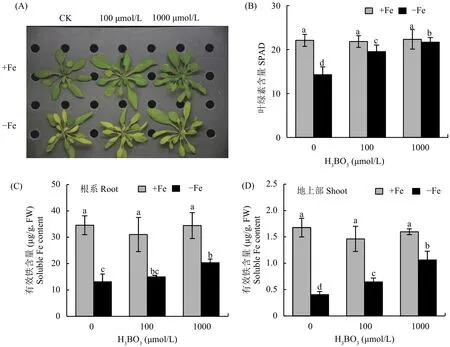
图1 不同浓度硼处理后叶片表型、叶绿素含量以及根系和地上部有效铁含量Fig. 1 Phenotype and chlorophyll content of leaves, and soluble Fe contents in root and shoot after different concentrations of boron treatments
2.3 外源硼对植株体内铁由根系向地上部转运的促进作用
外源添加硼可以通过增加地上部有效铁的含量从而缓解植株的缺铁症状,为了进一步探讨其内在的生理机制,测定了植株根系和地上部的总铁含量。试验结果显示,在铁含量充足的条件下,硼不影响根系和地上部总铁含量的积累;但是在缺铁的条件下,与不施加硼相比,外源施加硼酸,尤其是施加 1000 μmol/L H3BO3,根系和地上部单位质量的总铁含量都得到显著增加 (图3-A、B)。由图3-C可以得出外源添加硼可以参与拟南芥体内的铁由根系向地上部转运的过程。

图2 不同处理拟南芥细胞壁铁含量及半纤维素和半纤维素铁含量Fig. 2 Iron contents in cell wall, hemicellulose and hemicellulose content after different boron treatments
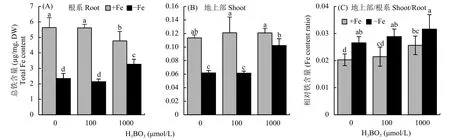
图3 不同浓度硼处理后根系和地上部铁含量Fig. 3 Total iron content in root and shoot after different concentrations of boron treatments
2.4 拟南芥体内铁转运相关基因表达的变化
前面的结果表明,外源添加硼后可以促进根系铁向地上部的转运,因此本试验主要测定了外源添加硼前后这 3 个转运蛋白的表达变化。结果显示,铁充足的情况下外源硼对这 3 个基因的影响不大。在缺铁处理 7 d后,AtFRD3和AtNAS1基因表达显著上调,却抑制AtYSL2的表达 (图4-A、B、C);然而再添加外源硼,特别是 1000 μmol/L硼酸后,这3 个基因的表达量显著高于单纯的缺铁条件 (图4),暗示硼可能主要是通过调节AtFRD3、AtNAS1以及AtYSL2基因的表达来增加其有效铁从根部向地上转运的过程。
2.5 拟南芥根系一氧化氮 (NO) 含量的变化及其作用
为了明确一氧化氮 (NO) 和硼对缺铁信号的影响,我们首先研究了缺铁胁迫下外源加入硼后对内源NO代谢的影响。结果显示,在加铁条件下,外源施加硼对根系NO含量没有显著影响 (图5-A、B),但是在缺铁情况下,外源施加硼后根系NO含量是不施加硼情况的 1.5 倍 (图5-C、D),暗示信号分子NO可能参与了调控细胞壁铁的再释放过程。为了进一步确定NO的作用,我们又对以上4个处理分别外源添加NO清除剂c-PTIO,结果显示在加入c-PTIO后,以上4个处理根系NO含量皆显著降低,且加入c-PTIO后上述 4 个处理的NO含量均处于同一水平上,说明c-PTIO对拟南芥根系NO的清除作用十分明显 (图5-E、F、G、H)。探究缺铁条件下在营养液中加入NO清除剂c-PTIO后,外源添加硼缓解拟南芥缺铁的症状可以被逆转,这进一步说明硼缓解缺铁的症状是由信号分子NO所介导的(表1)。
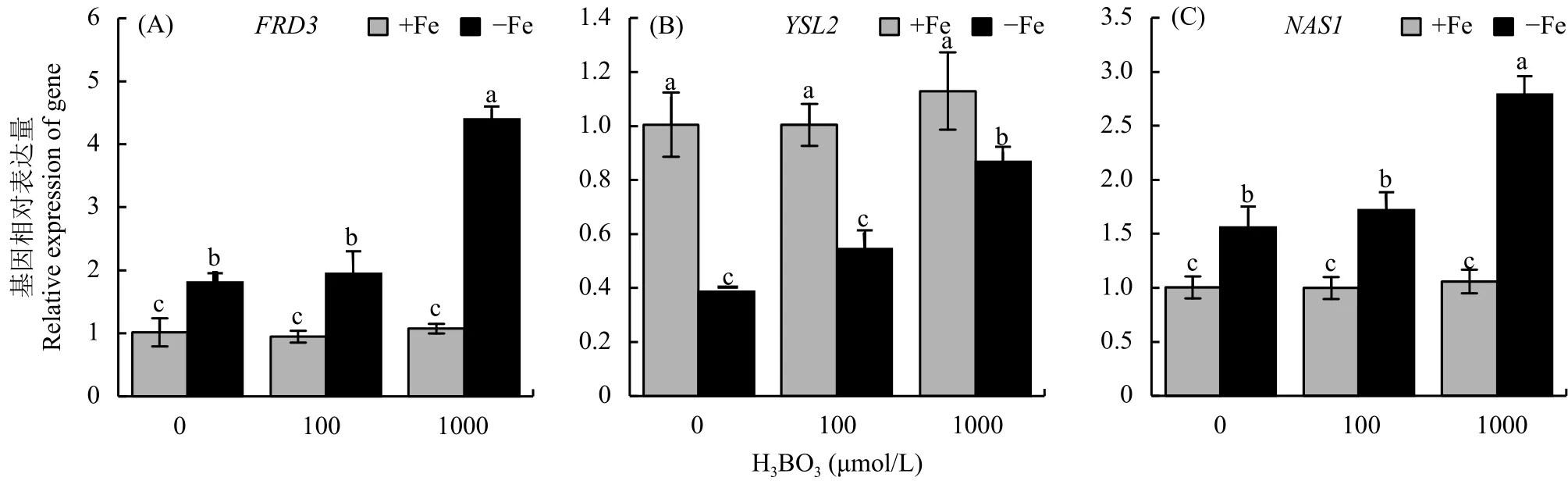
图4 不同浓度硼处理后铁转运相关基因相对表达量Fig. 4 The relative expression of iron transporter after different boron treatments

图5 不同浓度硼处理后对根系NO含量的影响Fig. 5 Effect of different boron treatments on NO production in root
3 讨论
近年来,微量元素硼在植物逆境中发挥的重要作用也越来越受到人们的重视,比如可以在豌豆(Pisum sativum) 中抵御铝毒。研究表明,硼可以促进铝在细胞壁果胶中的累积,并且通过抑制铝的解吸作用来降低铝在细胞中的可移动性。进一步结果显示,硼还可以通过降低果胶的甲酯化程度来增加细胞表层的负电荷,最终达到固定Al3+的作用[27]。不仅如此,硼还在植物盐害中起关键的作用,Bastias等[35-36]发现硼可以通过维持细胞壁的延展性来调节植物叶片的水势和渗透压力,遗传学证据显示,水孔通道蛋白也能够参与这种硼缓解盐害的过程。在本试验中发现,随着外源添加1000 μmol/L H3BO3时,在缺铁的条件下,拟南芥根系和地上部的有效铁含量都能够显著提高 (图1)。很明显在营养液缺铁的情况下,仍然能够检测到植物根系含有可溶性铁。根据前人的研究发现,细胞壁,尤其是细胞壁的组分半纤维素,是拟南芥根系铁的重要结合位点。因此我们猜测在缺铁的条件下,硼增加拟南芥体内有效铁的含量是由于细胞壁铁的再利用机制导致的。
同时,一氧化氮 (NO) 是植物体内重要的信号分子,它在调节植物生长发育以及帮助植物抵御逆境胁迫中发挥着重要的作用。本试验中发现,外源添加硼酸可以促进拟南芥根系细胞壁铁的释放来增加体内的有效铁含量,那么硼又是通过什么信号途径介导缺铁反应的?因为之前的相关铁含量和基因表达量数据均显示1000 μmol/L H3BO3可以显著缓解缺铁症状,因此本试验选取了+Fe、+Fe + 1000 μmol/L H3BO3、-Fe、-Fe + 1000 μmol/L H3BO34 个处理分别测定其根系NO含量,检测到缺铁环境中加硼后也能促进根系NO的释放,暗示信号分子NO确实也能够参与调控植物体内铁的再利用过程,而在加入NO清除剂c-PTIO后,外源添加硼缓解拟南芥缺铁的症状可以被逆转 (表1),这也就进一步解释了硼缓解缺铁的症状是由信号分子NO所介导的。
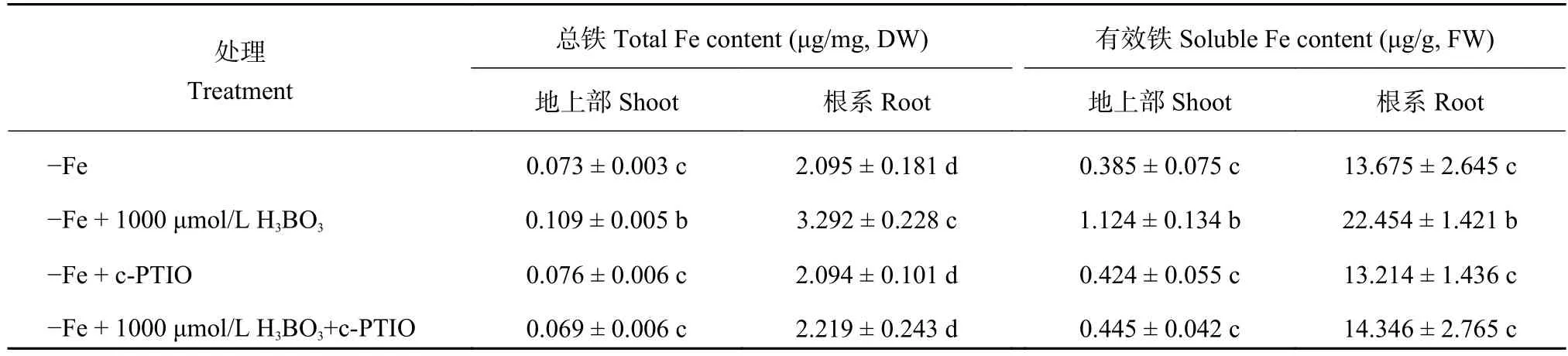
表1 NO清除剂c-PTIO对缺铁情况下根系和地上部铁含量的影响Table 1 Effect of NO scavenger c-PTIO on iron contents in root and shoot
拟南芥根系细胞壁在提高植物体内铁的再利用方面起着十分重要的作用。Andersen等[37]发现,在藻类中细胞壁的不同结构可以影响铁在体内的分布。进一步研究显示,细胞壁木质纤维素的结构可以影响水稻和拟南芥种子中铁含量的累积,具体表现为将位于细胞壁纤维素表面的铁结合肽和碳水化合物结合肽的融合多肽转入拟南芥和水稻后可以明显看到种子中铁含量的积累和生物量的增加,对于提高粮食作物的产量和解决全世界范围内铁缺乏的问题具有积极的指导意义[38]。Zhu等[21]研究发现,NaCl可以缓解拟南芥的缺铁症状,其主要原因是缺铁时外源添加NaCl后细胞壁组分半纤维素含量发生变化,从而导致细胞壁半纤维素上结合的铁游离到组织中供植物吸收,最终达到缓解植物缺铁的效果;其后续的研究还发现,植物激素脱落酸 (ABA)可以作为一种信号分子,参与植物体内细胞壁铁的再转运机制。植物细胞壁的半纤维素主要是在高尔基体中合成,在拟南芥中半纤维素最主要的成分是木葡聚糖。传统的观点认为,半纤维素的主要成分不带电或者带有中性电荷,因此很难像细胞壁果胶等成分一样结合金属阳离子。但是由于果胶与半纤维素之间能以共价键相结合,所以半纤维素上的金属阳离子结合位点有可能会被果胶中不同形式的多糖所占据[39]。最新的研究结果显示,细胞壁的半纤维素可能通过与铝离子形成某种形式的复合物来参与调控植物体内铝的吸收与释放过程[33]。但是有关细胞壁半纤维素上铁的结合位点的研究仍未有报道。本试验中,在缺铁条件下外源添加硼后,拟南芥根系细胞壁铁的含量显著降低,同时细胞壁组分半纤维素含量和半纤维素结合的铁含量也相应减少,因此笔者认为外源添加硼可以通过改变细胞壁组分半纤维素的含量,解吸半纤维素上吸附的铁来提高体内的有效铁含量。
拟南芥体内的一系列转运蛋白不仅负责根系对土壤中铁的吸收,还和体内铁的长距离运输密切相关。铁在木质部运输主要以铁—柠檬酸复合物的形式存在,前人已经报道的AtFRD3家族蛋白可以参与这一过程,遗传学证据分析,Atfrd3突变体在铁充足情况下叶片黄化,地上部有效铁含量显著降低但是根系却积累大量的铁,过表达Atfrd3后能够回补这种缺铁症状,说明AtFRD3蛋白确实参与了铁由根系向地上部运输的过程[40]。关于韧皮部运输,AtNAS1和AtYSL2转运蛋白被认为是在铁韧皮部运输中起着重要作用。当在拟南芥中敲除AtNAS1和AtYSL2后,地上部铁含量大幅度下降,并且伴随着幼叶出现脉间失绿的现象,暗示着AtNAS1和AtYSL2可以调控拟南芥体内铁的动态平衡过程[41-42]。在本次试验中发现,在缺铁的条件下外源添加硼后,尤其是添加1000 μmol/L H3BO3后,拟南芥根系中AtFRD3、AtNAS1和AtYSL2的基因表达量都显著高于正常的缺铁条件,说明硼可以通过调控以上3个基因的表达来促进体内的铁从根系向地上部运输的过程。
4 结论
在缺铁的条件下,外源添加硼可以通过改变拟南芥体内细胞壁半纤维素含量来促进细胞壁铁的解吸,从而增加根系和地上部的有效铁含量。通过相关基因表达量分析,调控铁运输过程的几个关键转运蛋白AtFRD3、AtNAS1和AtYSL2参与并能促进铁从根系向地上部转运的过程,而信号分子NO能够参与这一过程并最终缓解植物的缺铁症状。
